无机砷短期胁迫对铜藻幼苗氧化损伤、抗氧化酶及抗氧化物的影响
张鹏,刘玮,王铁杆,钟晨辉,陶月良
1.浙江省海洋水产养殖研究所/浙江省近岸水域生物资源开发与保护重点实验室,浙江 温州 325000;2.山东省海洋生物研究院藻类研究中心,山东 青岛 266104;3.福建省水产研究所/福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361000;4.温州大学生命与环境科学学院,浙江 温州 325000
砷污染是目前世界关注重要环境问题,其来源主要为矿业采掘、农药施用及化石燃料等途径(Basu et al.,2001)。砷污染的危害较为深远,砷化物不仅本身具有一定毒性(朱濛等,2020),而且其能在生物体内积累,并可通过食物链传递、富集,从而产生广泛危害(Nakajima et al.,2010;杜森等,2019;赵宁宁等,2019)。目前中国是受砷污染较为严重的国家之一,地表水体被砷污染的现象较为突出(杨婉玲等,2015),经由地表径流,近岸海域也是受砷污染影响的重要区域(胡立成等,2017)。在近岸海域分布的大型海藻体内已发现有砷富集现象,尤其在墨角藻目海藻中无机砷积累较为明显(Koch et al.,2007;杨承虎等,2017),这表明大型海藻对砷胁迫具有一定耐受性。通常砷胁迫会导致生物体内严重的过氧化损伤,这不仅会激活生物体内抗氧化酶系统应对胁迫产生的过量活性氧(Basu et al.,2001;Flora,2011),而且在植物中以NPT为代表的抗氧化物能够络合砷离子,通过络合物转运区隔,以减轻胁迫效应(史静等,2015;马思思等,2020)。但在大型海藻中无机砷胁迫能对藻体产生何种影响,且藻体如何应对无机砷胁迫目前并不清楚。
铜藻(Sargassum horneri)隶属于褐藻门、墨角藻目、马尾藻科,是近岸海藻场构建的重要种类。近年来随着漂浮铜藻的出现,针对铜藻提取物体外抗氧化活性相关研究逐渐受到关注(袁付红等,2019;张玉等,2018;郑丽杰等,2020),但对于铜藻体内抗氧化系统的研究相对较少。有研究发现相较于海带、裙带等大型海藻,铜藻能够富集更高浓度的无机砷(陈露等,2020),但在砷胁迫条件下铜藻抗氧化系统的胁迫应对机制并不清楚。因此以铜藻为目标海藻开展砷胁迫条件下的生理研究,有利于深入了解大型海藻应对外源砷胁迫的抗逆生理特点。本研究以铜藻为研究对象,探讨了不同价态、浓度的无机砷(As3+、As5+)短期胁迫下,海藻体内氧化损伤、抗氧化酶及抗氧化物等生理指标的响应情况,为揭示铜藻砷胁迫下抗氧化系统调节机制提供科学参考。
1 材料与方法
1.1 实验材料
试验样品为人工繁育的铜藻幼苗,种菜来自浙江南麂岛(27°27′N,121°03′E)。幼苗在室内悬浮培养,培养温度18 ℃,光照强度2400 lx,光照周期为光照12 h,黑暗12 h。培养基采用盐度30的灭菌海水配制的PES培养基,每5天更换1次培养液。选取藻体长度3 cm的健康幼苗用于试验。
1.2 砷浓度实验组设置
砷浓度实验组分为As3+和As5+实验组,在培养基中分别添加NaAsO2、Na2HAsO4·7H2O获得As3+和As5+的浓度梯度实验组。鉴于铜藻砷富集能力较强(陈露等,2020),为获得铜藻砷胁迫下的半效应浓度本研究实验设置了较高的砷胁迫浓度,As3+和As5+的浓度梯度分别设置为0、50、100、150、200 mmol·L−1。将实验藻体用灭菌海水冲洗后,分别转入带有2 L培养基的3 L的三角瓶中进行充气悬浮培养;各实验组设置3个重复,每个重复包含30株幼苗。藻体胁迫处理24 h后取出,先用灭菌海水冲洗,再用去离子水反复冲洗,待拭干藻体表面水分后,进行后续生理指标测定。
1.3 生理指标测定
以相对电导率为指标衡量铜藻幼苗细胞损伤率。RC测定时称取0.5 g海藻幼苗,放入带有15 mL去离子水(电导率<0.1 US·cm−1)的试管中,18 ℃下,在 200 r·min−1的摇床上振荡 2 h,随即测定溶液电导率 C1。随后沸水浴 30 min,再在 200 r·min−1的摇床上振荡 2 h,待冷却至 18 ℃后测定溶液电导率C2,设置3次重复。相对电导率计算公式如下:

氧化损伤指标(OFR、MDA)、抗氧化酶活性(SOD、POD、CAT)及抗氧化物含量(GSH、NPT)的测定使用上海酶联生物公司的相关试剂盒进行测定,测定时取 0.2 g藻体液氮研磨后作为待测样品进行分析。
1.4 数据分析
不同砷浓度实验组比较采用单因素方差分析,其组间比较采用LSD法,不同价态砷实验组比较采用t检验,显著性水平为α=0.05。方差分析及主成分分析过程由SPSS Statistics 23.0软件完成,铜藻幼苗半效应浓度(EC50)采用Logistic方程法(段美红等,2020)计算获得,对相对电导率数据进行Logistic非线性拟合,其拟合方程为:

式中,y为相对电导率值代表细胞伤害率;x为实验组砷浓度;a为细胞伤害率饱和量,b、k为方程系数。半效应浓度(EC50)计算公式为:

2 结果
2.1 砷胁迫下相对电导率变化及半效应浓度的确定
不同浓度砷胁迫下藻体电导率变化如图 1所示,随着砷浓度增加藻体电导率显著提高(P=0.000,α<0.05,下同)。As3+实验组中,当浓度由 50 mmol·L−1升高至 200 mmol·L−1时,藻体相对电导率由(54.5%±5.0%) 提高至 (95.5%±3.5%);同样在 As5+实验组中,藻体相对电导率也由 (32.4%±3.8%) 逐渐提高至 (91.4%±3.7%)。总体上,不同价态砷实验组的电导率差异不显著。但两两比较发现,在 50 mmol·L−1及 100 mmol·L−1浓度时不同价态砷实验组间 存 在 显 著 差 异 ( 50 mmol·L−1P=0.007 , 100 mmol·L−1P=0.001),且 As3+实验组的相对电导率高于As5+实验组。

图1 不同浓度砷胁迫下铜藻相对电导率Fig.1 Relative conductivity changes of S.horneri under different concentrations of arsenic stress
分别对不同价态砷实验组电导率进行 Logistic曲线拟合(图 2),其中 As3+实验组曲线回归系数(r2=0.757)优于 As5+实验组曲线回归系数(r2=0.661)。曲线分析发现,在 0—100 mmol·L−1浓度区间时,As3+实验组相对电导率迅速上升,而As5+实验组相对电导率则上升相对迟缓;在 100—200 mmol·L−1浓度区间时,As3+实验组相对电导率已达到平台期,而 As5+实验组相对电导率仍呈上升趋势。As5+实验组 EC50值为 116.3 mmol·L−1,而 As3+实验组 EC50值仅为 50.1 mmol·L−1,两者比值为2.3∶1。

图2 铜藻相对电导率的Logistic拟合曲线Fig.2 Logistic fitting curves based on relative conductivity of S.horneri
2.2 砷胁迫下OFR与MDA变化
砷浓度对铜藻 OFR产生速率影响显著(P=0.000)(图3),As3+、As5+实验组的 OFR产生速率均随砷浓度上升而提高。对比不同价态砷实验组发现,虽然As3+实验组OFR产生速率比As5+实验组更早到达平台期,但不同价态砷实验组OFR产生速率总体差异未达到显著水平(P=0.196),且相同浓度下As3+、As5+实验组差异也不明显。

图3 不同砷浓度下铜藻OFR和MDA变化情况Fig.3 Variation of OFR and MDA in S.horneri under different concentrations of arsenic
藻体内 MDA含量受砷胁迫浓度变化明显(P=0.000)。As3+实验组随砷浓度上升,MDA含量迅速提高并在100 mmol·L−1浓度时达到相对稳定状态;As5+实验组MDA含量随砷浓度上升较为迟缓,在 150 mmol·L−1时 MDA 含量才达到相对稳定状态。不同价态实验组MDA含量最大值均出现在200 mmol·L−1时,但差异并不明显(P=0.125)。虽然在50 mmol·L−1及 100 mmol·L−1浓度时 As3+、As5+实验组MDA含量存在明显差异(50 mmol·L−1P=0.011,100 mmol·L−1P=0.004),但总体上不同价态实验组MDA含量差异未达到显著水平(P=0.274)。
2.3 砷胁迫对抗氧化酶系统的影响
砷胁迫浓度对 SOD活性产生了明显影响(P=0.000)(图4)。As3+实验组随着砷浓度上升SOD活性首先显著上升,并在As3+100 mmol·L−1时达到酶活最大值 (25.6±2.1) U·g−1,随后 SOD 活性随砷浓度上升呈不明显的下降趋势。As5+实验组在 0—150 mmol·L−1范围时,SOD活性随砷浓度上升而持续升高;150—200 mmol·L−1范围时,SOD 活性变化并不明显(P=0.850)。砷胁迫浓度对POD活性的影响也达到显著水平(P=0.000),在 0—100 mmol·L−1范围时,随砷浓度上升 As3+、As5+实验组POD 活性均明显提高;在 100—200 mmol·L−1范围时,As3+、As5+实验组POD活性变化均不显著。不同于SOD和POD,CAT活性对砷胁迫浓度变化并未产生明显响应(P=0.270)。

图4 不同砷浓度下SOD、POD和CAT的活性变化Fig.4 Activities of SOD,POD and CAT varied in S.horneri under different concentrations of arsenic
对不同价态实验组对比发现,100 mmol·L−1浓度时As3+实验组SOD活性、POD活性均明显高于As5+实验组酶活性(SOD P=0.000,POD P=0.000),但总体上不同价态实验组SOD、POD、CAT活性差异均不明显(SOD P=0.087,POD P=0.218,CAT P=0.777)。
2.4 砷胁迫下GSH和NPT变化
GSH含量、NPT含量均受砷胁迫浓度显著影响(图 5),在 0—50 mmol·L−1范围时,As3+、As5+实验组GSH含量与NPT含量均随砷胁迫浓度增加而显著上升。在 50—150 mmol·L−1范围时,As3+、As5+实验组 GSH含量变化并不明显,As5+实验组 NPT含量变化也不显著,但 As3+实验组 NPT含量呈下降趋势,且(As3+)150 mmol·L−1时 NPT 含量明显低于(As3+)50 mmol·L−1时的值(P=0.011)。在 50—150 mmol·L−1范围时,As3+、As5+实验组 GSH 含量与NPT含量虽有下降趋势,但变化并不显著。
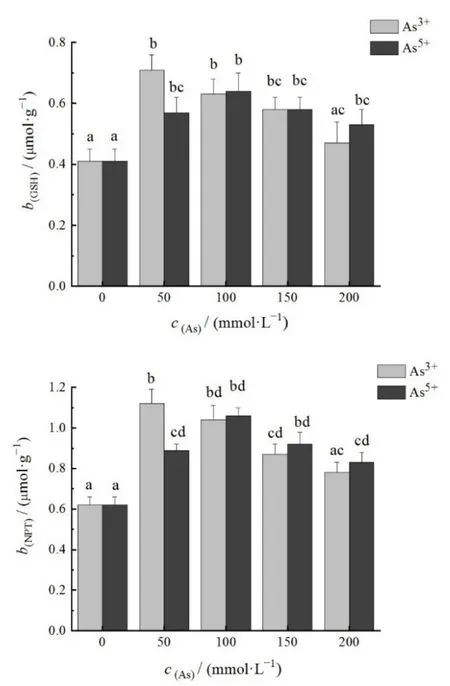
图5 不同砷浓度下GSH和NPT的浓度变化Fig.5 Variations of GSH and NPT content in S.horneri under different concentrations of arsenic
相同砷浓度时不同价态实验组两两对比发现,GSH含量均无明显差异,NPT含量仅在砷胁迫浓度为 50 mmol·L−1时存在明显差异(P=0.021)。GSH 含量、NPT含量各自在不同价态实验组间总体差异不显著。
2.5 抗氧化指标主成分分析及综合排序
对所有实验组的5个抗氧化生理指标(SOD、POD、CAT、GSH、NPT)进行主成分分析,共提取到2个主成分,其贡献率分别为55.325%、29.535%,累计贡献率达84.860%,且两个主成分特征值均大于1。两个主成分表达式分别为:

Y1、Y2为主成分,x1、x2、x3、x4、x5分别代表SOD、POD、CAT、GSH、NPT的标准化值。主成分1中NPT、GSH、POD、SOD的系数较大,是反映抗氧化物(NPT、GSH)和抗氧化酶(POD、SOD)的综合指标;主成分2中CAT的系数较大,主要反映了CAT指标。通过贡献率对主成分值加权对各实验组铜藻抗氧化综合得分情况进行排序,结果见表1。排名前 3 位的是实验组为(As5+)100 mmol·L−1、(As3+)50 mmol·L−1、(As5+)150 mmol·L−1。在 As3+实验组中,随着浓度的升高,铜藻抗氧化综合得分呈下降趋势;而在As5+实验组中,随着浓度的升高,铜藻抗氧化综合得分则呈先上升后下降趋势。
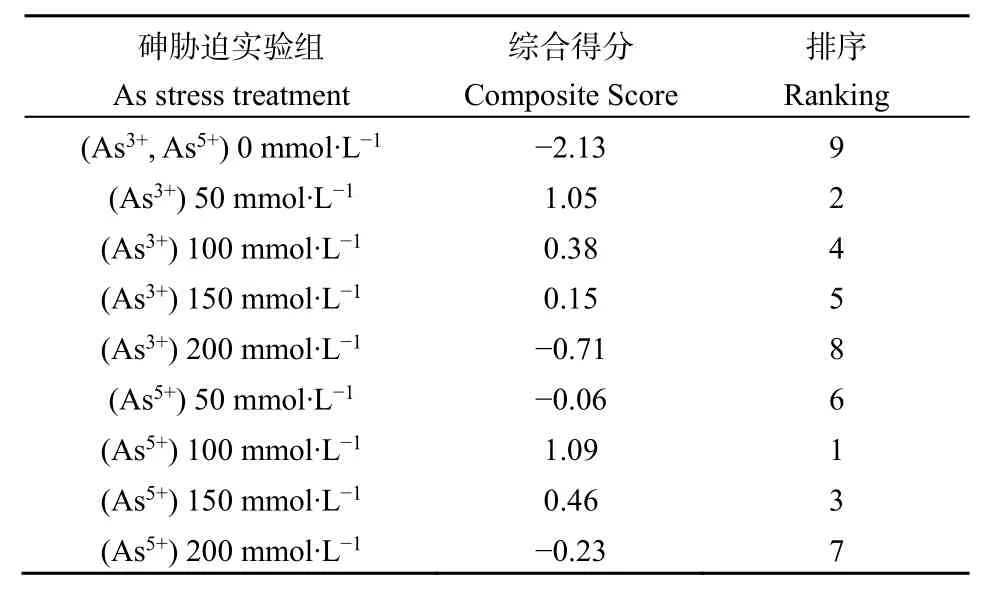
表1 砷胁迫实验组抗氧化综合得分排序Table 1 Ranking arsenic stress treatments with antioxidant comprehensive score
3 讨论
3.1 砷胁迫对铜藻细胞损伤的影响
砷作为一种植物非营养元素本身具有一定的生物毒性并可在海藻体内富集(Nakajima et al.,2010;陈露等,2020),并对细胞产生多种氧化损伤影响正常生长(Rao et al.,2004;Flora,2011)。砷胁迫条件下可诱导产生过量的活性氧(Hei et al.,2004),由此导致细胞膜脂质发生过氧化损伤,其中MDA不仅是膜脂中不饱和脂肪酸的过氧化产物,还是反映脂质过氧化程度的重要指标(陈贵等,1991;Cooper et al.,2009)。当具有通路作用的细胞膜脂质损伤加剧后会导致细胞透性变化,甚至细胞膜破损、胞质流出造成细胞死亡(Ferreri et al.,2007;范宁波等,2020)。本研究发现,不同价态的砷胁迫均能导致铜藻体内 OFR产生速率提高,且 As3+、As5+砷胁迫浓度对藻体内 OFR产生速率具有显著影响,这与在其他物种中的研究结果类似(Luna et al.,2010);As3+、As5+砷胁迫均能明显促使铜藻体内 MDA含量上升,这与在大豆、香蒲(Typha angustifolia L.)等植物中研究结果一致(胡家恕,1995;陈天等,2020)。在As3+、As5+砷胁迫条件下,伴随着铜藻体内 OFR产生速率及 MDA含量的上升,藻体的相对电导率也明显提高,其中 200 mmol·L−1时 As3+、As5+实验组的藻体相对电导率较对照组 0 mmol·L−1分别提高了 4.2、4.0倍,这表明在实验浓度下不同价态的砷胁迫均对铜藻幼苗产生了明显的细胞损伤。由于本研究选取的砷胁迫浓度较高,As3+、As5+实验组的铜藻幼苗均受到严重细胞损伤,因此不同价态实验组在相对电导率、OFR产生速率及MDA含量等指标总体差异不显著,但在50、100 mmol·L−1低浓度实验组不同价态的砷胁迫对藻体产生的胁迫效果并不一致,As3+实验组的相对电导率、MDA含量明显高于 As5+实验组。不同价态砷胁迫EC50对比发现,As5+EC50值为As3+EC50值的2.3倍,综合低浓度砷胁迫实验组相对电导率、MDA含量差异,我们认为在 50—100 mmol·L−1浓度范围内As3+相较于 As5+对铜藻幼苗产生的胁迫效应更强,这在动物的相关研究中也有类似发现(Basu et al.,2001)。
3.2 砷胁迫对铜藻抗氧化系统的影响
抗氧化酶与抗氧化物共同组成了生物体的抗氧化系统,并在应对外界胁迫产生的氧化损伤中发挥重要作用(Sanità di Toppi et al.,2008)。SOD 能将 OFR转化为 H2O2,而 POD、CAT则进一步将H2O2转化为H2O(马思思等,2020)。本研究发现,随着砷胁迫浓度的增加,铜藻中SOD、POD的酶活性明显升高,但CAT酶活性则变化不明显。这与重金属胁迫下大叶井口边草(Pteris cretica var.nervosa)、中国莲(Nelumbo nucifera)及梭鱼草(Pontederia cordata)等植物中的SOD、POD活性变化趋势较为一致(樊香绒等,2013;胡拥军等,2015;马思思等,2020),这表明铜藻可通过 SOD与POD协同作用消除非生物胁迫下产生的活性氧。然而也有研究发现,SOD与CAT可协同减轻半叶马尾藻(Sargassum hemiphyllum)的镉胁迫效应(叶鹏浩等,2019),这可能是由于不同海藻种类的抗氧化酶系统对不同重金属胁迫的响应机制存在差异而导致的结果。NPT能与游离态重金属络合消除或降低重金属造成的氧化损伤(原海燕等,2013),且有研究发现 As5+胁迫能明显提高烟草(Nicotiana tabacum)、桐花树(Aegiceras corniculatum)幼苗中NPT含量(Wojas et al.,2010;吴桂容等,2016)。本研究发现,在铜藻中不仅As5+胁迫能促使NPT含量上升,而且As3+胁迫也具有类似效果。GSH在植物缓解砷胁迫的过程中发挥着重要的抗氧化作用(Pu et al.,2014;吴桂容等,2016),但是GSH会随着胁迫作用的加剧而逐渐被消耗(Bankaji et al.,2015;芮海云等,2018)。我们发现铜藻幼苗为应对砷胁迫会提升藻体 GSH含量,且随着胁迫浓度的增加藻体内GSH含量出现下降趋势。总之,砷胁迫浓度对铜藻抗氧化系统中抗氧化酶(SOD、POD)和抗氧化物(GSH、NPT)影响较为明显。
不同价态的砷胁迫对铜藻抗氧化系统产生的影响并不完全一致。本研究选取了较高的砷胁迫浓度,由于铜藻幼苗受到较强的氧化损伤,因而总体上不同价态砷胁迫对抗氧化系统产生的差异并不显著。但不同价态实验组两两比对发现,在较低砷浓度范围(50—100 mmol·L−1)和高浓度范围(150—200 mmol·L−1)时,不同价态实验组的部分抗氧化系统生理指标存在显著差异。如50 mmol·L−1时As3+实验组的 NPT含量明显高于 As5+实验组;100 mmol·L−1时 As3+实验组的 SOD、POD 活性明显高于 As5+实验组;相较于 100 mmol·L−1As3+实验组,200 mmol·L−1As3+实验组的 GSH 含量、NPT 含量显著降低,但As5+实验组的GSH含量、NPT含量降低并不明显。
3.3 铜藻抗氧化系统的主成分分析
我们对铜藻抗氧化系统中SOD、POD、CAT、GSH、NPT等抗氧化生理指标进行主成分分析,提取到两个主成分Y1和Y2,其中Y1贡献率达到55.3%,是Y2贡献率的1.9倍。在Y1中,NPT、GSH、SOD、POD均具有较高的贡献系数,这表明NPT、GSH、SOD、POD在铜藻抗氧化过程中起到了重要作用。这与随着砷胁迫浓度的增加铜藻中的抗氧化酶(SOD、POD)酶活及抗氧化物(GSH、NPT)的含量上升的实验结果相一致。从图6可以看出,GSH、NPT的向量方向及长度较接近,这表明两种抗氧化物对各砷胁迫实验组具有相似影响,同理 SOD、POD也对各实验组具有相似影响;但GSH、NPT与SOD、POD的向量方向却不相同,这表明抗氧化物(GSH、NPT)与抗氧化酶(SOD、POD)对各砷胁迫实验组的影响存在差异。对低浓度实验组(As3+50 mmol·L−1;As5+100 mmol·L−1)而言,抗氧化物(NPT、GSH)发挥主导作用;而对高浓度实验组(As3+100 mmol·L−1;As5+200 mmol·L−1),抗氧化酶(SOD、POD)则发挥主导作用。这与镉胁迫下地衣(Trebouxia impressa)的生理研究结果类似(Sanità di Toppi et al.,2008),即当镉胁迫浓度较低时,以NPT为代表的抗氧化物起主要防御作用,而当镉胁迫浓度较高时,NPT类的抗氧化物下降,以抗氧化酶及胁迫蛋白发挥主要防御作用。
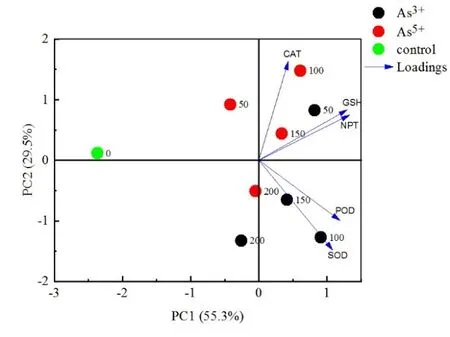
图6 铜藻抗氧化系统PCA分析Fig.6 PCA analysis of antioxidant system in S.horneri
基于主成分对各砷胁迫浓度实验组进行抗氧化综合得分计算并排序。结果表明随砷胁迫浓度升高,As3+实验组抗氧化综合得分持续降低,而As5+实验组抗氧化综合得分则先升高后下降。我们发现临近 EC50的砷胁迫实验组倾向具有较高的抗氧化综合分值,由此推断过度的细胞氧化损伤是导致抗氧化综合分值下降的重要原因,而抗氧化综合分数的变化一定程度上也反映了铜藻幼苗抗氧化系统对砷胁迫的响应。随着砷浓度提高,胁迫压力增加,藻体内抗氧化酶活性及抗氧化物含量相应上升,使得抗氧化综合分值升高;当砷浓度过高时,藻体细胞氧化损伤加剧,部分细胞死亡,使得藻体内抗氧化酶活性及抗氧化物含量降低,导致抗氧化综合得分降低。由于As3+EC50较低,相对较低的As3+胁迫浓度即能造成较为严重的氧化损伤,因此As3+实验组抗氧化综合得分随砷浓度升高持续降低;As5+EC50较高,因此As5+实验组抗氧化综合得分随砷浓度升高先升高,待砷浓度大于100 mmol·L−1时,细胞氧化损伤加剧,导致As5+实验组抗氧化综合得分出现下降趋势。
4 结论
As3+、As5+胁迫均能诱导铜藻幼苗产生氧化损伤,但铜藻As3+EC50的值仅为As5+EC50的43.5%。随着As3+、As5+砷胁迫浓度的上升,铜藻OFR产生速率、MDA含量及藻体相对电导率呈上升趋势,为了减轻砷胁迫造成的氧化损伤,抗氧化酶(SOD、POD)活性和抗氧化物(GSH、NPT)含量也相应提高,但随着氧化损伤加剧,抗氧化物(GSH、NPT)含量出现不同程度的降低。砷胁迫浓度对氧化损伤指标(OFR产生速率、MDA含量、相对电导率)、抗氧化酶(SOD、POD)活性和抗氧化物(GSH、NPT)含量均有显著影响。主成分分析表明,在较低浓度砷胁迫下,藻体抗氧化系统倾向于抗氧化物(GSH、NPT);而在较高浓度砷胁迫时,藻体抗氧化系统倾向于抗氧化酶(SOD、POD)。砷胁迫浓度过高,可导致藻体氧化损伤进一步加剧,部分细胞的损伤死亡则减弱了藻体抗氧化系统的响应。

