Kv1.5蛋白基于PI3K/Akt信号通路影响内毒素致大鼠血管内皮细胞损伤*
安 宁, 许 涛, 周 贤, 张晓霞, 杨 涛, 许美霞△
1华中科技大学同济医学院附属协和医院麻醉与危重病研究所,武汉 430022 2华中科技大学同济医学院附属普爱医院重症医学科,武汉 430034
血管内皮细胞损伤是介导脓毒症(sepsis)导致的血管麻痹、凝血激活和循环衰竭的核心环节。减轻血管内皮细胞损伤对于防治脓毒性休克和循环衰竭具有重要的临床意义[1-3]。Kv1.5蛋白是一类电压依赖性氧敏感钾离子通道,参与细胞的增殖、凋亡及炎症等病理过程。近期研究发现,Kv1.5蛋白在内皮细胞中表达,并参与内皮细胞功能的调节[4-5]。我们前期研究证实,Kv1.5蛋白与血管内皮细胞损伤密切相关,在脓毒症动物模型中,Kv1.5蛋白在大鼠血管内皮细胞中表达明显增加。本研究通过建立脓毒症动物模型,并给予Kv1.5通道特异性阻滞剂DPO-1(diphenyl phosphine oxide-1)干预,观察内皮细胞损伤情况,并检测内皮细胞PI3K、p-Akt蛋白及基因的表达,以探讨Kv1.5是否通过PI3K/Akt信号通路介导脓毒症相关内皮细胞损伤。
1 材料与方法
1.1 实验动物与试剂
成年清洁级SD雄性大鼠60只,体质量(200±20)g,购自华中科技大学同济医学院实验动物中心。LPS及DPO-1购于美国Sigma公司;硫酸肝素(heparin sulfate,HS)、多配体蛋白聚糖1抗体(syndecan-1,SDC-1)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)试剂盒、兔抗PI3K、p-Akt均购于武汉三鹰生物技术有限公司,引物由武汉巴菲尔生物技术服务有限公司合成。
1.2 实验方法
1.2.1 动物模型制备与分组 SD大鼠在实验前12 h开始禁食,实验前4 h禁水。将这些大鼠随机分为5组,每组12只。Control组:尾静脉注射0.9%NaCl溶液;LPS组:尾静脉注射LPS 5 mg/kg(以等渗NaCl溶液稀释至1 mL)制造大鼠脓毒症模型;DPO-1低、中、高剂量组:先经腹腔分别注射1、3、5 mg/kg DPO-1,30 min后尾静脉注射LPS 5 mg/kg。各组大鼠均在自然光下继续饲养6 h。
1.2.2 ELISA法检测血清中HS、SDC-1、TNF-α、IL-6含量 大鼠股静脉取血,分离血清,按照ELISA试剂盒方法检测各组HS、SDC-1、TNF-α、IL-6含量。
1.2.3 Western blot检测PI3K及p-Akt蛋白的表达收集待测组织样品,BCA试剂盒测定待测样品蛋白浓度。用5%牛血清白蛋白(BSA)室温封闭1 h。一抗用5%BSA封闭液按1∶200稀释,4℃孵育过夜。二抗(辣根过氧化物酶标记的IgG)用5%BSA封闭液按1∶2000稀释,室温孵育2 h。用ECL显影。
1.2.4 实时荧光定量PCR(qPCR)检测PI3K mRNA及p-Akt mRNA的表达水平 用Trizol法提取总RNA,按Fermentas试剂盒说明书方法进行Real-time PCR检测,引物序列见表1。逆转录cDNA反应条件:25℃ 5 min,50℃ 15 min,85℃ 5 min,4℃ 10 min,30个循环;72℃ 4 min,4℃ 4 min。Real-time PCR反应条件:第一循环50℃ 2 min,95℃ 10 min,之后95℃ 30 s和60℃ 30 s共40个循环。

表1 引物序列表
1.3 统计学方法
2 结果
2.1 各组大鼠血清HS及SDC-1的含量
LPS组血清HS、SDC-1水平分别为(41.53±1.67)ng/mL、(4.68±0.13)ng/mL,较Control组明显升高(均P<0.01);DPO-1低剂量组(1.0 mg/kg)较LPS组HS及SDC-1水平下降(P=0.027,0.032),DPO-1中、高剂量组(3、5 mg/kg)较LPS组大鼠血清HS、SDC-1水平明显下降(均P<0.01)。见图1。
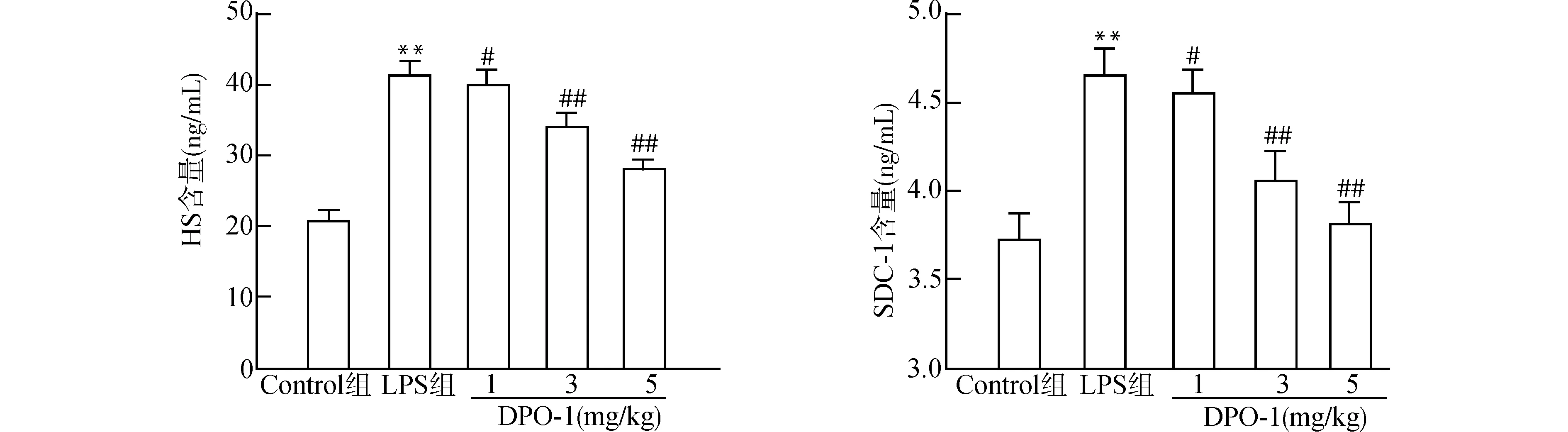
与Control组比较,**P<0.01;与LPS组比较,#P<0.05 ##P<0.01
2.2 各组大鼠血清中TNF-α及IL-6含量变化
LPS组TNF-α、IL-6含量分别为(460.82±18.33)pg/mL、(312.33±10.42)pg/mL,LPS组较Control组TNF-α、IL-6含量明显增加(均P<0.01),而DPO-1预处理后,TNF-α、IL-6含量较LPS组减少(均P<0.05),且这一抑制效应随DPO-1剂量增加而增大。见图2。
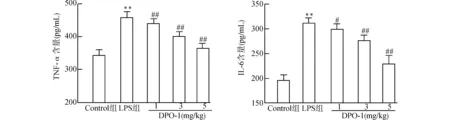
与Control组比较,**P<0.01;与LPS组比较,#P<0.05 ##P<0.01
2.3 各组大鼠胸主动脉内膜组织PI3K及p-Akt蛋白的表达水平
LPS组较Control组PI3K及p-Akt蛋白表达明显减少(均P<0.01),给予不同剂量DPO-1预处理后,与LPS组比较,PI3K及p-Akt蛋白表达均增加(均P<0.01)。见图3。
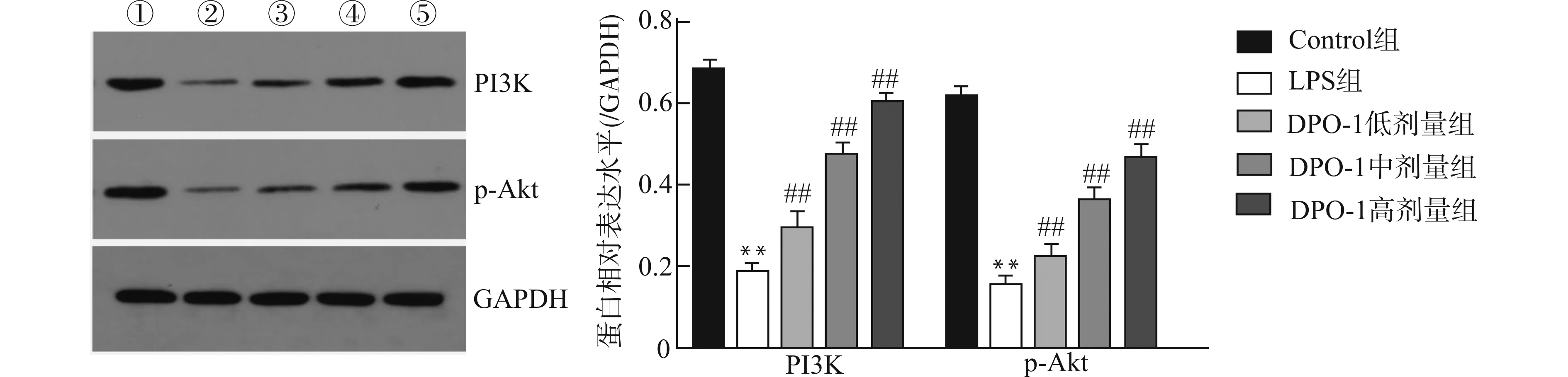
①:Control组;②:LPS组;③:DPO-1低剂量组(1 mg/kg);④:DPO-1中剂量组(3 mg/kg);⑤:DPO-1高剂量组(5 mg/kg);与Control组比较,**P<0.01;与LPS组比较,##P<0.01
2.4 各组大鼠胸主动脉内膜组织PI3K及p-Akt mRNA的表达水平
LPS组PI3K mRNA及p-Akt mRNA表达水平较Control组明显下调(均P<0.01),给予DPO-1预处理后,与LPS组比较,DPO-1低剂量组PI3K mRNA及p-Akt mRNA表达上调(P值分别为0.034、0.023),DPO-1中、高剂量组PI3K mRNA及p-Akt mRNA表达明显上调(均P<0.01),见图4。提示LPS诱导血管内皮细胞损伤时,下调PI3K及p-Akt基因表达,给予DPO-1预处理可上调PI3K及p-Akt基因表达。
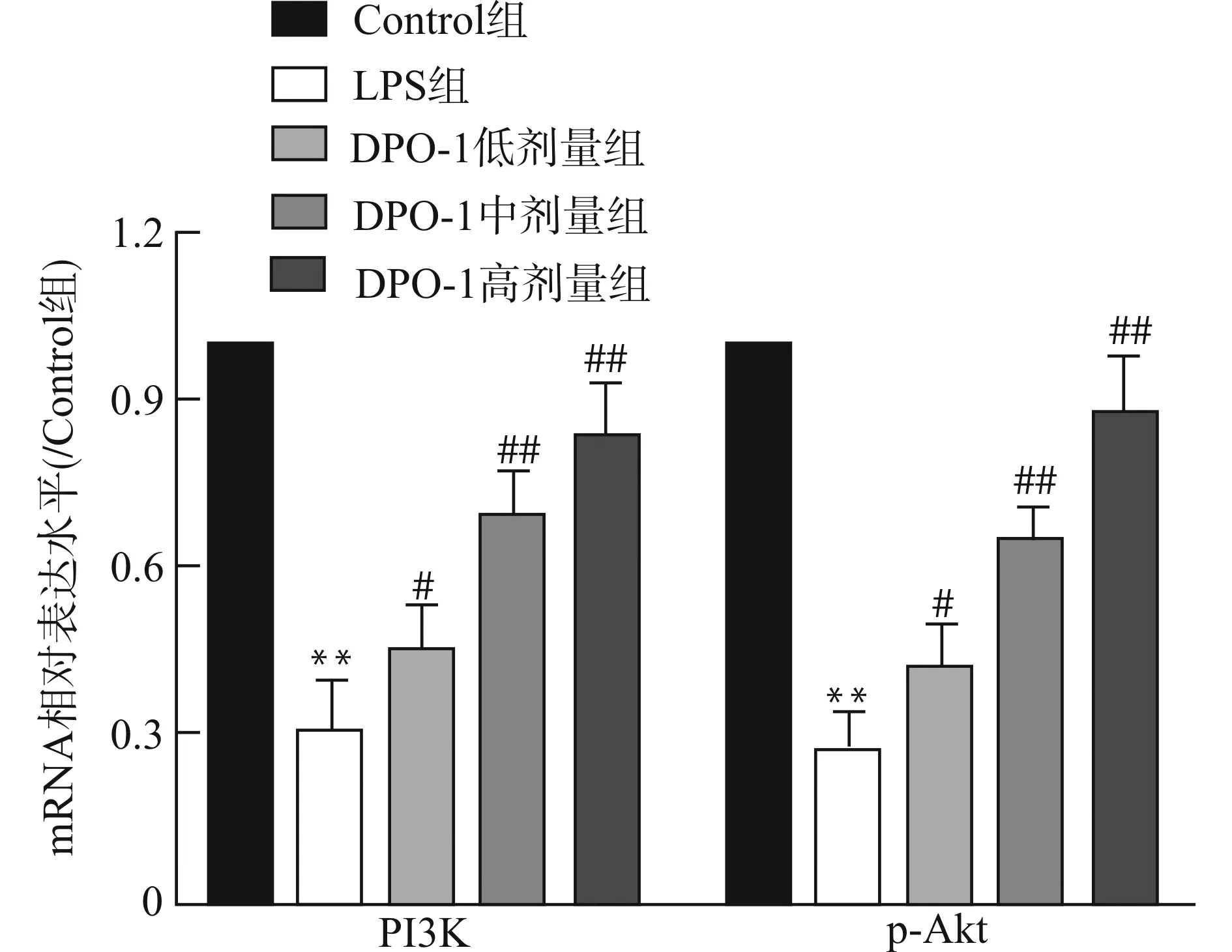
与Control组比较,**P<0.01;与LPS组比较,#P<0.05 ##P<0.01
3 讨论
血管内皮屏障破坏、血管通透性增高是脓毒症、多器官功能障碍发生发展的重要因素[1-3]。糖萼是血管内皮屏障的重要组成部分,是覆盖于血管内皮细胞表面的多糖蛋白复合物的总称。研究发现,脓毒症时,机体产生大量的炎症介质,导致血管内皮糖萼大量脱落并降解,血管内皮直接暴露在各种炎症因子下,内皮细胞受损,受损的内皮细胞失去了对血管通透性及张力的调节,从而导致血管通透性增加及微循环功能障碍[6-8]。因此,糖萼降解的程度与内皮功能障碍和炎症的应激反应密切相关。硫酸肝素(HS)及多配体蛋白聚糖1抗体(SDC-1)是糖萼的主要构成部分,是内皮糖萼的有效标志物,其在血清中的浓度变化可直接反映内皮糖萼的完整状态[8-9]。本研究通过静脉注射LPS建立脓毒症血管内皮细胞损伤动物模型,发现大鼠血清中HS及SDC-1含量明显增加,而给予Kv1.5蛋白通道特异性阻滞剂DPO-1干预后,HS及SDC-1含量减少,提示糖萼脱落减少,血管内皮细胞损伤减轻。
TNF-α、IL-6是炎症反应的核心因子,其可以促进淋巴细胞的活化,诱导内皮细胞产生趋化因子,促进炎症细胞的浸润,激活炎症级联反应,加剧内皮炎症反应,加重内皮细胞损伤[10-11]。本研究结果显示,LPS组大鼠血清的TNF-α、IL-6水平较对照组显著升高(均P<0.05),提示Kv1.5蛋白诱导血管内皮细胞并发的炎症反应增大,给予Kv1.5特异性通道阻滞剂可有效抑制大鼠血清TNF-α、IL-6水平,减轻大鼠血管内皮细胞的炎症反应。
PI3K/Akt信号通路是一条氧化还原敏感性通路,它可被氧化应激所激活,参与细胞增殖与凋亡、基因转录、细胞迁移以及细胞周期等多种活动的调控[12-13]。研究发现,PI3K/Akt信号通路可提高Nrf2的转录,增加HO-1的表达,减轻内毒素诱导的肺泡巨噬细胞氧化应激及炎症损伤[14]。而新近体外研究显示,激活PI3K/Akt通路可减轻内毒素致血管内皮细胞损伤,而PI3K/Akt通道阻滞剂可抑制这种效应[15]。我们的研究显示,脓毒症细胞模型组PI3K、p-Akt蛋白及mRNA表达下调,给予Kv1.5特异性通道阻滞剂DPO-1干预后,可逆转这种抑制效应,PI3K、p-Akt蛋白及mRNA表达上调,提示Kv1.5特异性通道阻滞剂减轻大鼠血管内皮细胞损伤可能与激活PI3K/Akt信号通路有关。

