依托咪酯调控Sirt1/FOXO1通路对心肌缺血再灌注大鼠模型的保护作用*
陈彰强, 余 丹, 彭晓红, 李 鹏
武汉市第四医院,华中科技大学同济医学院附属普爱医院麻醉科,武汉 430032
心血管疾病一直是发病率和死亡率最高的威胁人类健康的主要疾病之一。近年来,由于动脉搭桥术、溶栓疗法和经皮冠状动脉介入治疗等的建立和应用,缺血性心肌组织可及时恢复血液供应,但是随后的心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)严重影响患者的康复率和预后[1-2]。大量证据表明,这种伤害在一定程度上是由活性氧(reactive oxygen,ROS)或自由基的过量产生引起的。能量代谢和氧化应激在其中发挥至关重要的调节作用[3]。因此,寻找安全有效的药物及治疗策略减轻MIRI仍是研究的重点。
麻醉药对心肌的保护作用在各种动物模型中得到了广泛研究,其机制包括减少ROS,增强内源性抗氧化剂和调节离子迁移等。依托咪酯(Etomidate,Eto)已在临床上用于诱导麻醉[4],并已证明可以防止各种器官的缺血再灌注(ischemia reperfusion,I/R)损伤,如骨骼肌[5]、大脑[6]和下肢[7]。重要的是,临床研究发现Eto复合硬膜外麻醉在老年冠心病患者围术期能够降低术后肌钙蛋白I(cardiac troponin I,cTnI)升高程度,非体外循环下冠状动脉搭桥术患者在麻醉诱导时使用Eto更有利于维持气管插管期间的血流动力学稳定和氧代谢平衡,对心肌有一定的保护作用[8-9]。动物研究也发现,其可抑制心肌细胞凋亡,减少心脏功能障碍和氧化应激,减轻大鼠的I/R损伤[10]。但其具体的机制尚不清楚,Eto是通过何种途径调控氧化应激,进而减轻MIRI,还尚未可知。沉默信息调节因子1(silence information regulator 1,Sirt1)是进化最保守的哺乳动物沉默调节蛋白,参与多种重要生物学功能的调节,例如氧化应激、能量代谢、细胞凋亡和自噬[11]。研究发现激活Sirt1可能是减轻以氧化应激为特征的I/R损伤的重要机制[3]。为了进一步说明先前的发现,本研究以Sirt1为切入点,深入探究Eto治疗MIRI的具体作用机制。
1 材料与方法
1.1 实验动物
SPF级健康雄性SD大鼠60只,体重(260~280)g,购自北京维通利华实验动物技术有限公司,许可证为SCXK(京)2019-0009。将动物在受控的环境条件[环境温度(24±2)°C,湿度(55±5)%,光照12 h/黑暗12 h]下饲养,自由饮水和摄食。研究已由机构动物护理和使用委员会批准,并遵循《实验动物的护理和使用指南》。
1.2 主要试剂及仪器
Eto脂肪乳注射液(福尔利,江苏恩华药业集团有限公司,国药准字H20020511,10 mL:20 mg);EX527(Sirt1特异性抑制剂,美国ApexBio,A4181);苏木精-伊红(HE)染色试剂、RIPA裂解液、BCA试剂盒、线粒体膜电位检测试剂盒(JC-1法)、Annexin Ⅴ-FITC细胞凋亡检测试剂盒(碧云天生物科技公司,批号分别为C0105、P0013B、P0012S、C2006、C1062L);活性氧(ROS)检测试剂盒DCFH-DA(CA1410-500)购自北京索莱宝科技有限公司;肌酸激酶同工酶MB(creatine kinase isoenzyme MB,CKMB)(H197)、肌钙蛋白I(cardiac troponin I,cTnI)(E019-1-1)、乳酸脱氢酶(lactate dehydrogenase,LDH)(微板法,A020-2-2)、超氧化物歧化酶(superoxide dismutase,SOD)(WST-1法)(A001-3-2)、丙二醛(malondialdehyde,MDA)(TBA法)(A003-1-2)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒(比色法)(A005-1-2)均购自南京建成生物工程研究所;兔抗Sirt1(ab189494)、Ac-FOXO1(ab52857)、β-actin(ab8227)、羊抗兔IgG H&L(HRP)(ab205718)购自英国Abcam公司;兔抗Bcl-2(bs-0032R)、Bax(bs-0127M)、Caspase-3(bs-0081R)均购自北京博奥森生物技术有限公司。
RWD407型小动物呼吸机(深圳瑞沃德生命科技有限公司);动物ECG心电图系统(美国Nasiff Associates公司);超高分辨率小动物彩色多普勒超声实时影像系统(Vevo 2100,加拿大VisualSonics公司);BD FACSCantoⅡ流式细胞仪、多功能酶标仪(iMark680)、蛋白转膜装置(美国Bio-Rad公司);倒置荧光显微镜(IX73,购自日本Olympus公司)。
1.3 分组、模型制备及给药
大鼠适应性饲养1周后,随机分为假手术组(Sham组)、MIRI组、Eto低、高剂量组(L-Eto、H-Eto组,0.5、1 mg/kg)[10]、通路抑制剂组(Eto+EX527组,1 mg/kg Eto+2 mg/kg EX527)[12],每组12只。除Sham组外,其余大鼠采用手术结扎冠状动脉左前降支的方法复制大鼠MIRI模型[3,12]:大鼠于术前禁食不禁水12 h,用戊巴比妥钠(50 mg/kg)麻醉后,仰卧位固定,连接肢体心电图电极和小动物呼吸机,心前区脱毛备皮,碘伏消毒,沿左侧第3、4肋间切开皮肤,快速开胸,暴露心脏,使用止血钳将左心耳提起,以0号缝合线在左心耳下方2 mm(冠状动脉左前降支)活结结扎,45 min后打开结扎线恢复血流行再灌注2 h。以缺血时心肌局部苍白或发绀,心电图ST段持续抬高,再灌注时心肌红润且ST段下降50%以上为MIRI模型建立成功。Sham组不进行结扎,其余操作同上;术中死亡大鼠进行随机补充。将造模成功大鼠随机分为MIRI组、L-Eto组、H-Eto组、Eto+EX527组,每组12只。Eto组大鼠于再灌注后2 h即刻尾静脉注射相应剂量的Eto(生理盐水稀释);通路抑制剂组在注射1 mg/kg Eto的同时,腹腔注射2 mg/kg的EX527(DMSO溶解稀释);1次/d,持续28 d;Sham组和MIRI组注射等量生理盐水。末次给药2 h后进行取材和指标检测。
1.4 取材及指标检测
1.4.1 心功能检测 于手术前和末次给药2 h后对每组大鼠进行经胸超声心电图检查。左心室舒张末期容积(LVEDV)、左心室收缩末期容积(LVESV)、左心室射血分数(LVEF)和左心室短轴缩短率(LVFS)用于评估大鼠的心功能。
1.4.2 血清心肌酶检测 心功能检测完成后,腹主动脉取血,静置后以3000 r/min离心15 min,分离血清,按照试剂盒说明书的操作检测血清中cTnI、CK-MB、LDH水平。
1.4.3 氧化应激指标检测 取血后,每组随机选取6只大鼠,取出完整心脏,于冰上用无菌手术刀片切分为两部分,一部分用4%多聚甲醛固定;另一部分按照1∶9的比例加入预冷的生理盐水研磨后,离心,取上清液,制备成10%的组织匀浆,生化法检测匀浆中MDA、SOD、GSH-Px水平。
1.4.4 心肌组织HE染色 取4%多聚甲醛固定的心肌组织,乙醇梯度脱水,石蜡包埋,连续切4 μm薄片,二甲苯脱蜡,梯度乙醇脱苯1 min,蒸馏水冲洗;进行HE染色,观察心脏组织形态变化。
1.4.5 流式细胞术检测心肌细胞凋亡 每组剩余6只大鼠,取出心脏,切分为两部分,一部分液氮速冻后,-80℃冰箱保存待测;另一部分心肌组织在充分剪碎后,加入适量的胰酶消化液,37℃混合裂解30 min,70 μm滤网过滤后,1000 r/min,离心10 min,弃去上清,重悬细胞,制成单细胞悬液。将100 μL的细胞悬液加入5 mL流式管中,然后加入Annexin Ⅴ-FITC和PI各5 μL,避光孵育15 min后加入1×结合缓冲液400 μL,用流式细胞仪检测心肌细胞凋亡情况。
1.4.6 荧光探针测定心肌中ROS水平 取1.4.5项下制备的心肌单细胞悬液,与ROS探针2,7-二氯荧光素二乙酸酯(DCFH-DA)在37°C下孵育1 h,然后在1000×g下离心10 min以收集DCFH-DA染色的心肌细胞。将DCFH-DA染色的心肌细胞重悬,根据ROS试剂盒的说明,在最佳激发波长和发射波长分别为488 nm和527 nm的条件下检测二氯荧光素(DCF)荧光。ROS水平通过检测DCF的荧光强度来确定。
1.4.7 JC-1法检测线粒体膜电位(MMP)变化 通过JC-1荧光标记检测心肌细胞线粒体膜电位的变化。取1.4.5项下制备的心肌单细胞悬液,调整细胞浓度为106/mL。然后,将细胞悬浮液与JC-1溶液混合,于培养箱中避光孵育20 min。通过流式细胞仪测量细胞的相对荧光强度。最终以实验组/对照组相对荧光值对MMP进行定量分析。
1.4.8 Western blot检测心肌组织Sirt1/FOXO1蛋白表达 取-80℃冰箱保存的心肌组织,加入RIPA裂解液研磨后,置于冰上,静置后离心,提取上清液为总蛋白溶液。用BCA法测量蛋白浓度后取等量蛋白质样品(30 μg/孔),SDS-PAGE凝胶电泳,湿转法转膜,5%脱脂奶粉封闭,加入相应一抗(Sirt1、Ac-FOXO1、Bcl-2、Bax、Caspase-3按照1∶1000比例进行稀释)于4℃下孵育过夜,HRP标记的羊抗兔IgG二抗(1∶5000)室温孵育1 h,ECL显色,以β-actin为内参,通过与内参的灰度比,得出目的条带的相对表达水平。
1.5 统计学分析
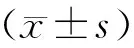
2 结果
2.1 各组大鼠的心脏功能
术前各组大鼠的LVESV、LVEDV、LVEF、LVFS差异均无统计学意义(均P>0.05)。给药结束后,与Sham组相比,MIRI组大鼠的LVESV、LVEDV显著增大,LVEF、LVFS显著下降(均P<0.05);与MIRI组相比,L-Eto组、H-Eto组大鼠的LVESV、LVEDV明显下降,LVEF、LVFS明显升高(均P<0.05);与H-Eto组相比,Eto+EX527组大鼠LVESV、LVEDV明显增大,LVEF、LVFS明显下降(均P<0.05);见表1。
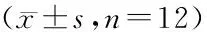
表1 术前及给药后各组大鼠的心功能比较Table 1 Comparison of cardiac function of rats in each group before operation and after
2.2 各组大鼠的血清心肌酶水平
与Sham组相比,MIRI组大鼠血清CKMB、cTnI、LDH水平显著升高(均P<0.05);与MIRI组相比,L-Eto组、H-Eto组大鼠血清CKMB、cTnI、LDH水平明显降低(均P<0.05),与H-Eto组相比,Eto+EX527组大鼠血清中CKMB、cTnI、LDH水平明显升高(均P<0.05);见图1。
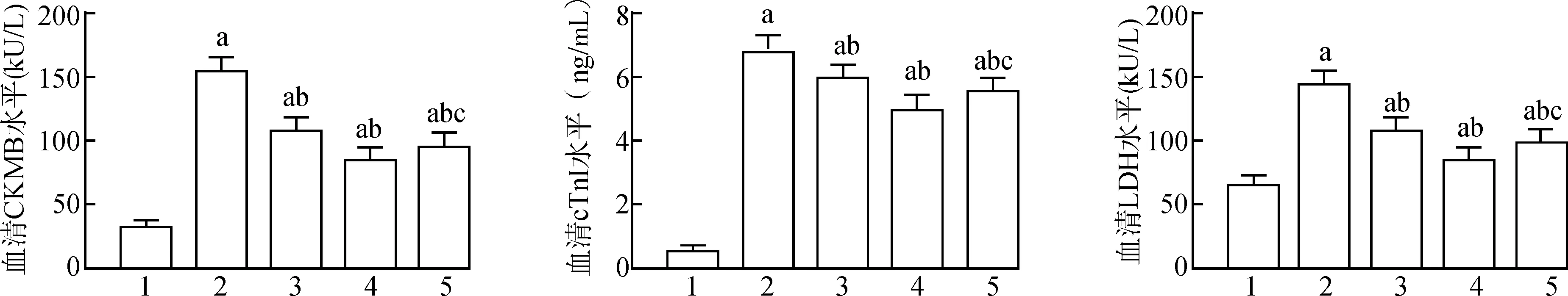
1:Sham组;2:MIRI组;3:L-Eto组;4:H-Eto组;5:Eto+EX527组;与Sham组比较,aP<0.05;与MIRI组比较,bP<0.05;与H-Eto组比较,cP<0.05图1 各组大鼠的血清心肌酶水平Fig.1 Serum myocardial enzyme levels of rats in each group
2.3 各组大鼠心肌组织MDA、SOD、GSH-Px水平
与Sham组相比,MIRI组大鼠心肌MDA水平显著升高,SOD、GSH-Px水平显著降低(均P<0.05);与MIRI组相比,L-Eto组、H-Eto组大鼠心肌MDA水平明显降低,SOD、GSH-Px水平明显升高(均P<0.05),与H-Eto组相比,Eto+EX527组大鼠心肌MDA水平明显升高,SOD、GSH-Px水平明显降低(均P<0.05);见图2。
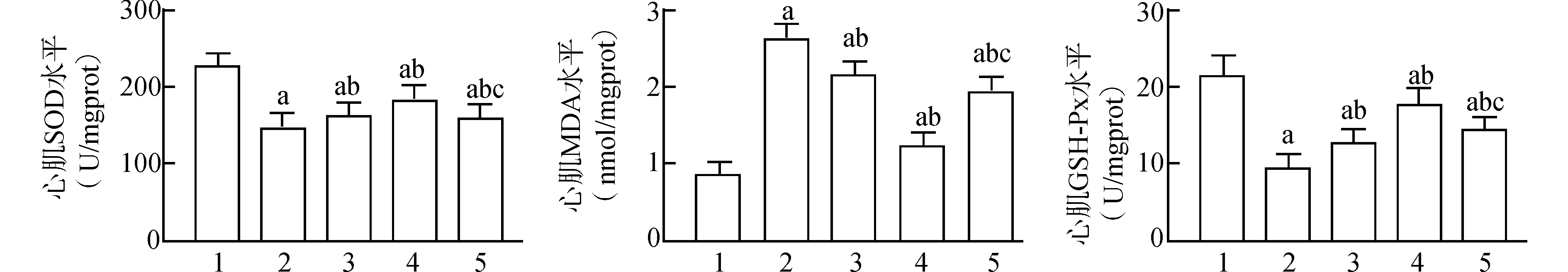
1:Sham组;2:MIRI组;3:L-Eto组;4:H-Eto组;5:Eto+EX527组;与Sham组比较,aP<0.05;与MIRI组比较,bP<0.05;与H-Eto组比较,cP<0.05图2 各组大鼠心肌组织MDA、SOD、GSH-Px水平Fig.2 Myocardial MDA,SOD,GSH-Px levels of rats in each group
2.4 各组大鼠心肌组织病理学变化
Sham组大鼠的心肌细胞形态规则,心肌纤维排列整齐,边界清晰,束状分布;MIRI组大鼠心肌组织染色疏松,心肌纤维紊乱,局部肌纤维横纹消失,可见心肌细胞肿胀、破裂和坏死,大量炎性细胞浸润;L-Eto组、H-Eto组大鼠可见轻度细胞水肿,少量心肌纤维断裂,少量炎性细胞浸润;Eto+EX527组大鼠心肌组织损伤较Eto高剂量组有加重趋势;见图3。
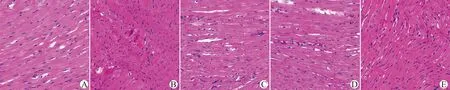
A:Sham组;B:MIRI组;C:L-Eto组;D:H-Eto组;E:Eto+EX527组图3 大鼠心肌组织形态学改变(苏木精-伊红染色,×200)Fig.3 Morphological changes of rat myocardial tissue(HE staining,×200)
2.5 各组大鼠的心肌细胞凋亡率及ROS水平
与Sham组[(6.80±1.21)%、(1.00±0.00)]相比,MIRI组大鼠缺血心肌细胞的凋亡率(32.65±2.08)%、ROS水平(3.58±0.37)显著升高(均P<0.05);与MIRI组相比,L-Eto组、H-Eto组大鼠心肌细胞的凋亡率[(25.02±1.49)%、(17.51±1.34)%]、ROS水平[(2.49±0.22)、(1.78±0.19)]明显降低(均P<0.05),与H-Eto组相比,Eto+EX527组大鼠心肌细胞的凋亡率(26.93±1.87)%、ROS水平(2.66±0.25)明显升高(均P<0.05);见图4。
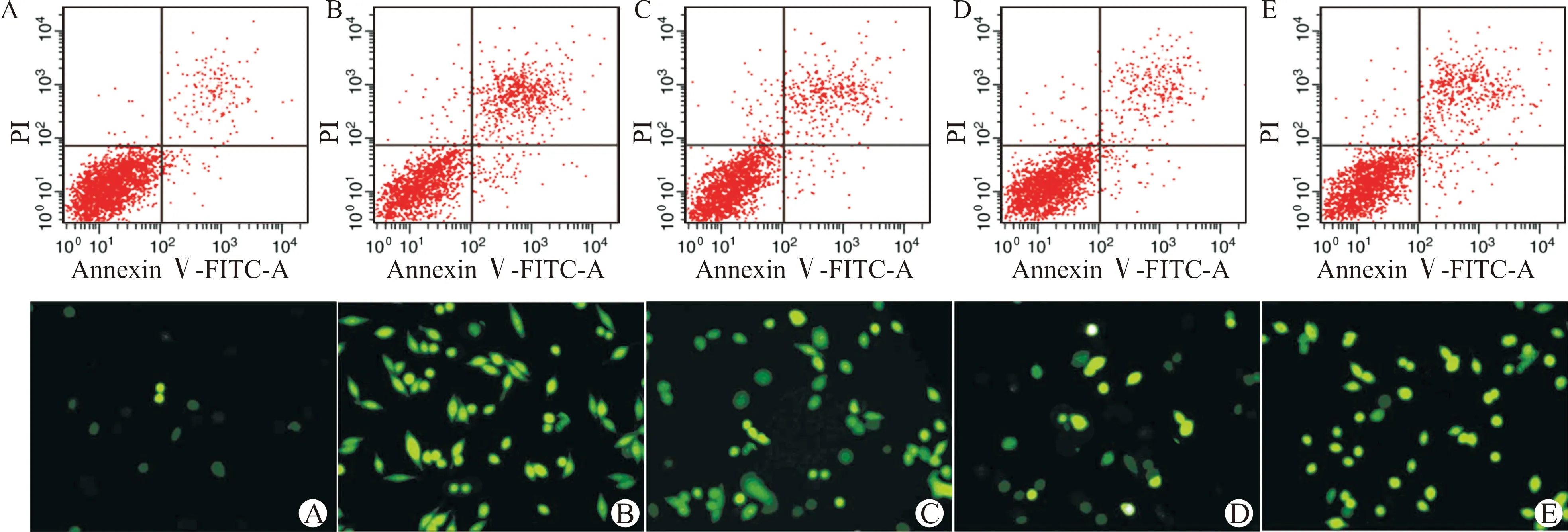
A:Sham组;B:MIRI组;C:L-Eto组;D:H-Eto组;E:Eto+EX527组图4 各组大鼠心肌细胞凋亡(流式细胞术)和ROS水平(DCFH-DA染色,×200)Fig.4 Cardiomyocyte apoptosis(flow cytometry)and ROS level(DCFH-DA staining,×200)of rats in each group
2.6 各组大鼠心肌细胞MMP的变化
与Sham组(1.00±0.00)相比,MIRI组大鼠心肌细胞MMP(0.45±0.05)显著降低(P<0.05);与MIRI组相比,L-Eto组、H-Eto组大鼠心肌细胞MMP[(0.63±0.07)、(0.82±0.08)]明显升高(均P<0.05),与H-Eto组相比,Eto+EX527组大鼠心肌细胞MMP(0.61±0.06)明显降低(P<0.05)。
2.7 各组大鼠心肌Sirt1/FOXO1通路相关蛋白的表达
与Sham组相比,MIRI组大鼠心肌组织Sirt1、Bcl-2的表达显著降低,Ac-FOXO1、Bax、Caspase-3的表达显著升高(均P<0.05);与MIRI组相比,L-Eto组、H-Eto组大鼠心肌组织Sirt1、Bcl-2的表达明显升高,Ac-FOXO1、Bax、Caspase-3的表达明显降低(均P<0.05),与H-Eto组相比,Eto+EX527组大鼠Sirt1、Bcl-2的表达明显降低,Ac-FOXO1、Bax、Caspase-3的表达明显升高(均P<0.05);见图5。
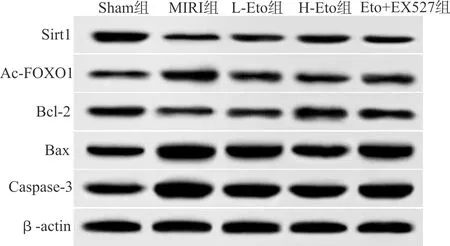
图5 各组大鼠心肌Sirt1/FOXO1通路相关蛋白的表达Fig.5 The expression of proteins related to the Sirt1/FOXO1 pathway in myocardium of rats in each group
3 讨论
MIRI是临床实践中常见的病理过程。当心肌缺血时,由于氧气供应不足,能量代谢发生障碍,使机体代谢产物不能被及时清除,在体内大量堆积产生毒性作用,使心肌发生病变,导致心泵功能减退;同时心肌缺血后会激活氧化应激反应,产生大量的ROS,生成和释放大量炎性因子(如TNF-α、IL-6),促进MIRI的发生、发展[13]。因此,抑制氧化应激在改善MIRI中起着至关重要的作用。
Eto是一种非巴比妥酸盐静脉麻醉剂,当患有心血管疾病的患者接受手术麻醉时,Eto具有更好的保护作用[14]。使用常规临床剂量时,心血管疾病患者和正常患者之间的心率、平均动脉压、平均肺动脉压、中心静脉压、心搏量、肺血管阻力和外周血管阻力等几乎没有区别。据报道,Eto可以通过增强内源性抗氧化剂的活性,降低氧化应激和维持组织中离子平衡迁移来抑制I/R损伤。如在胫骨开放性骨折手术中,术中使用Eto维持镇静可有效升高患者血清SOD水平,降低I/R损伤后ROS和炎性因子的释放,并可以降低术后麻醉并发症的发生率[15]。动物研究也发现,Eto在大鼠MIRI中的保护作用与减轻氧化应激和炎症反应有关[10]。在本研究中发现给予Eto治疗后,MIRI大鼠超声心电图指标得以恢复,这是减少MIRI的标志。此外,已经证明血清心肌损伤生物标志物(如cTnI、LDH和CK-MB)水平升高是手术后不良反应的独立危险因素;ROS、SOD、MDA和GSH-Px的水平反映了氧化应激的水平[16]。Eto治疗改善了心脏病理损伤,降低了心脏标记酶以及氧化应激相关指标的水平,说明Eto可抑制氧化应激,改善MIRI;与以往的研究结果一致,这些结果支持Eto可用于治疗MIRI。
线粒体是能量供应的重要细胞器,与能量代谢有着最直接的联系,在整个I/R的过程中,线粒体功能障碍,是I/R损伤所致心脏功能障碍的重要因素之一[17]。由于对能量的高需求,心肌组织高度富含线粒体。近年来,线粒体在MIRI中的不可替代的作用已逐渐被发现,线粒体是ROS的主要来源,通常细胞抗氧化剂系统可有效去除ROS;但是在MIRI期间,心肌可用氧不足,ATP的产生不足,可导致线粒体产生的ROS压倒了抗氧化剂的能力,导致细胞DNA损伤、Ca2+稳态破坏、线粒体膜去极化,导致细胞色素C的释放和细胞凋亡引起细胞死亡[18-19]。在本研究中,我们通过流式细胞术和荧光探针检测了心肌细胞的凋亡和ROS的产生,结果显示MIRI大鼠缺血心肌细胞的凋亡率和ROS水平显著升高;JC-1探针(一种用于检测线粒体电位变化的敏感荧光染料)评估MMP显示线粒体出现损伤。而Eto可降低ROS水平和心肌细胞凋亡率,增加MMP;Western blot结果进一步显示Eto可上调Bcl-2的表达,下调Bax、Caspase-3的表达;提示Eto可改善线粒体功能障碍,抑制细胞凋亡。
Sirt1是烟酰胺腺嘌呤二核苷酸(NAD+)依赖性脱乙酰基酶,属于Sirtuins家族,参与多种重要生物学功能的调节,如氧化应激、能量代谢、细胞凋亡[11]。Sirt1不仅可以影响线粒体的活性,抑制ROS的生成,还可以影响抗氧化防御系统[20]。Sirt1/FOXO1途径是重要的信号传导途径,被认为参与调节氧化应激、炎症反应和细胞凋亡[21]。FOXO1是心血管系统中重要的转录因子,参与底物代谢和细胞增殖。大量证据表明FOXO1是心脏代谢调节和维持心脏功能的重要因素,Sirt1通过脱乙酰基作用调节下游蛋白FOXO1的表达,从而控制几种对氧化应激有响应的蛋白的表达[22]。研究发现下调Sirt1的表达,可增加FOXO1的表达,促进ROS的产生,从而增加氧化应激和心肌细胞凋亡[23];激活心肌组织和H9c2细胞中的Sirt1/FOXO1信号通路可抑制细胞凋亡和氧化应激损伤,改善MIRI[24]。本研究结果显示,MIRI后大鼠Sirt1的表达下降,Ac-FOXO1的表达升高,Eto治疗后可上调Sirt1的表达,抑制Ac-FOXO1的表达,且给予Sirt1的抑制剂EX527可明显逆转Eto的抗氧化活性和心肌保护作用,提示Eto可能通过激活Sirt1,下调乙酰化FOXO1的表达,抑制氧化应激和细胞凋亡,减轻MIRI。
综上所述,Eto对MIRI的保护作用可能与激活Sirt1,下调乙酰化FOXO1的表达,进而改善线粒体功能障碍,抑制氧化应激和细胞凋亡有关。此外,本研究尚存在一定的局限性,Eto通常被用作麻醉诱导剂,麻醉诱导起效快,失效也快,每天1次Eto治疗会导致血药浓度有限,因此给药剂量和给药时间问题以及Eto是否还能通过其他途径发挥抗氧化作用,均有待进一步研究。且在使用胰蛋白酶消化制备心肌组织单细胞混悬液时,可能对细胞造成一定的损伤,使流式细胞术检测细胞凋亡产生一定误差,后续考虑采用TUNEL或免疫组化检测凋亡蛋白表达。

