甲状腺相关眼病免疫学及遗传学研究进展*
王鑫研, 陈 瑾, 姜发纲, 王兴华, 游雅琰
华中科技大学同济医学院附属协和医院眼科,武汉 430022
Graves病(Graves’ disease,GD)或称弥漫性毒性甲状腺肿,是自身免疫导致的以甲状腺功能亢进、眼部及局部皮肤病变为特征的多系统综合征,是全球甲状腺功能亢进最主要的病因之一[1]。25%~50%GD患者有眼部病变,称为Graves眼病(Graves’ ophthalmopathy,GO),又称甲状腺相关眼病(thyroid-associated ophthalmopathy,TAO),除此之外,TAO还包含其他甲状腺自身免疫性疾病如甲状腺功能减退、慢性淋巴细胞性甲状腺炎、桥本甲状腺炎等造成的眼眶炎症性改变[2]。TAO是眼科临床常见的器官特异性自身免疫性疾病,严重影响患者身心健康。因TAO发病机制尚未完全阐明,目前临床上多为对症治疗,而非对因治疗。目前基于TAO免疫致病机制的研究已有较大的进展,本文对此进行综述,以期为进一步的针对病因治疗提供新的思路。
1 甲状腺相关眼病概述
TAO是GD最主要的甲状腺外表现。其临床表现复杂,主要包括眼睑退缩、眼球突出、复视、眼部软组织炎症和眼球运动障碍,严重者可并发暴露性角膜溃疡、甲状腺相关视神经病变(dysthroid optic neuropathy,DON)等,严重威胁患者视力。其影像学表现为眼外肌梭形增粗,肌止点正常,最常累及的眼外肌依次是下直肌、内直肌、上直肌、外直肌[3]。TAO的具体发病机制未完全阐明,尚无美国食品和药品管理局批准的药物可用,重视TAO的发病机制对疾病的诊疗具有重要意义。近年来,TAO发病、进展过程中免疫相关细胞学、分子学及遗传学机制的研究受到很大关注,新型靶向药物研发也是研究的热点。
TAO是内源性和环境因素相互作用的复杂的多因素疾病。目前已经明确的TAO发生和恶化的危险因素包括年龄、性别、基因和种族、解剖因素、促甲状腺激素受体抗体(thyroid-stimulating hormone receptor antibodies,TRAb)、甲状腺功能异常、放射性碘治疗、吸烟等[4](表1)。在这些因素中,吸烟是TAO首位的可控危险因素(吸烟者与非吸烟者的比值比为7.7),且风险与每天吸烟的数量成正比[5],TAO三级预防策略中均强调戒烟的重要性。
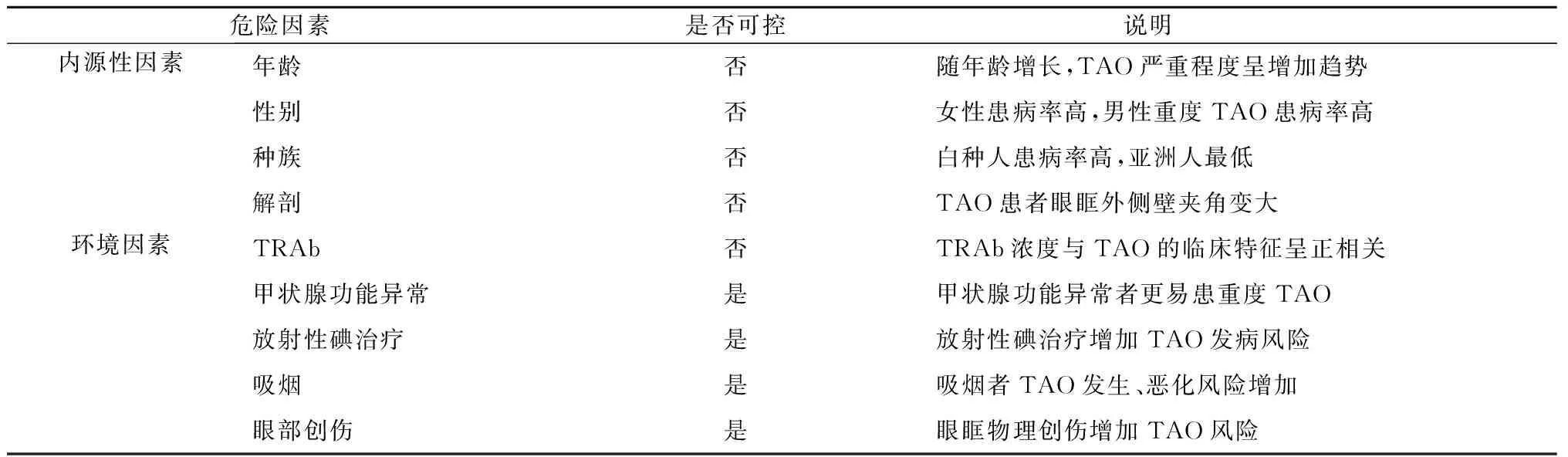
表1 TAO发生和发展的危险因素Table 1 Risk factors for the occurrence and development of TAO
2 甲状腺相关眼病细胞层面研究进展
TAO的许多症状和体征是眼眶内软组织扩增使得眼眶骨性容积内压力增大引起的,其典型的组织学特点为:眼外肌和眼眶脂肪组织淋巴细胞浸润、眼外肌增粗及眼眶脂肪体积增加。在活动性TAO中,眼外肌、提上睑肌、泪腺和眼眶脂肪组织中均有淋巴细胞浸润,主要是CD4+T细胞,但也有少量的CD8+T细胞、B细胞、浆细胞和巨噬细胞,共同参与TAO眼眶炎症反应。
大量研究均证明眼眶成纤维细胞是TAO自身免疫反应主要的效应细胞[6],其表型和功能具有异质性[3]。眼眶成纤维细胞按照细胞表面标志物Thy-1(CD90)的表达与否可分为两个亚群,对炎症细胞因子的反应及功能不同。Thy-1+(CD90)在TAO患者眼眶内过度表达,该细胞亚群在细胞因子的诱导下产生前列腺素-E2(prostaglandin-E2,PG-E2)、白细胞介素-8(interleukin-8,IL-8)和高水平的透明质酸。活化的Thy-1+成纤维细胞分泌转化生长因子-β(transforming growth factor-β,TGF-β),TGF-β通过自分泌方式刺激眼眶成纤维细胞合成和分泌透明质酸,以无定形颗粒物的形式沉积在眼外肌内,占主要地位的亲水性透明质酸可吸收大量水分导致眼外肌增粗,同时诱导Thy-1+成纤维细胞分化成为具有肌动蛋白的肌成纤维细胞,参与炎症反应、细胞修复和纤维化[7]。眼眶脂肪组织为眼球、眼外肌和眶内其他组织提供缓冲保护作用,Thy-1-成纤维细胞在T细胞分泌的促脂前列腺素的诱导下分化成脂肪细胞,其促甲状腺激素受体(thyroid-stimulating hormone receptor,TSHR)的表达增强,并使TAO病程延长[8](图1)。眼眶成纤维细胞多数属于Thy-1+细胞,Thy-1-细胞占比约30%~40%。当受到不同种类细胞因子为主导的刺激时,Thy-1+和Thy-1-眼眶成纤维细胞的平衡决定着眼眶组织病理变化是脂肪生成还是纤维化,患者的症状、体征和病程也会因此有所不同[8]。
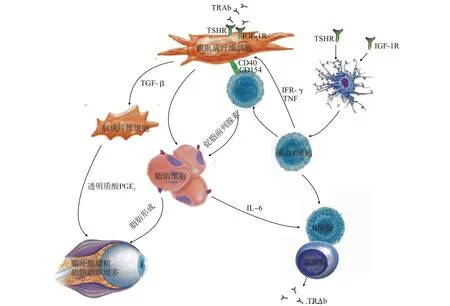
图1 甲状腺相关眼病自身免疫反应模式图Fig.1 Model diagram of the autoimmune process of TAO
3 甲状腺相关眼病分子层面研究进展
自身免疫性甲状腺疾病最主要的自身抗体是TRAb,与甲状腺滤泡上皮细胞表面的THSR结合后刺激其分泌过量的甲状腺激素[9]。正常人眼眶脂肪细胞和成纤维细胞均存在一定的TSHR蛋白,TAO患者TSHR浓度与TAO的活动性和严重程度成正比,因此TSHR是甲状腺和眼眶的共同自身抗原,是介导TAO发生的主要自身抗原[10]。一旦自身反应性T细胞不能对TSHR产生耐受,即造成针对TSHR的自身免疫应答。TSHR-Ⅱ型主要组织相容性(TSHR-MHCⅡ)复合体被抗原提呈细胞(APC)加工,并通过T细胞受体(TCR)呈递给CD4+T细胞。活化的T细胞通过CD40-CD154共刺激通路的桥梁作用识别结合自身反应性B细胞,同时分泌INF-γ和IL-2,诱导B细胞分化为浆细胞,合成和分泌TRAb。TRAb即可介导TAO的自身免疫反应,不仅可特异性识别、结合甲状腺滤泡上皮细胞表面的TSHR增加甲状腺激素的产生,还可识别眼眶成纤维细胞的TSHR,联合辅助性T细胞分泌的IFN-γ和TNF,启动TAO眼眶组织重塑。针对TSHR-MHC Ⅱ 异常形成机制目前有以下一些观点:①肠道感染导致细胞因子失衡;②通过超抗原和促分裂原诱导T细胞和B细胞的非特异性活化;③改变自身抗原,以致机体识别为非自身抗原[11]。
与正常人相比,TAO患者眼眶成纤维细胞还表达较高水平的胰岛素样生长因子-1受体(insulin-like growth factor 1 receptor,IGF-1R),近年来多项研究表明该受体是TAO发病和进展的另一个重要自身抗原。IGF-1R可激活眼眶成纤维细胞合成IL-16和趋化因子T细胞激活性低分泌因子(RANTES因子),促进CD4+T细胞募集至眼眶,还可促进透明质酸的合成,促进脂肪生成,诱导T细胞、B细胞活化[12]。研究表明,TSHR和IGF-1R表达在眼眶成纤维细胞膜的共同区域,以一种复合体的形式存在,两者介导下游信号转导通路相互交叉,在对眼眶成纤维细胞的功能调节中发挥协同作用[13]。
有研究表明,针对眼外肌蛋白(即G2s和Fp)的抗体也与TAO有关。这个观点存在争议,因为在细胞结构完整的情况下,对G2s和Fp等细胞内蛋白质的体液免疫应答不太可能发生,一个合理的解释是在病程后期,这些蛋白质从受损的细胞释放到血清中[14]。
各种免疫细胞在眼眶内募集和浸润依赖于大量细胞因子的产生,细胞因子在TAO的发生、发展和缓解中具有重要的作用,由活化的T细胞(大部分为CD4+细胞)、巨噬细胞、B细胞和眼眶成纤维细胞产生[15]。Th1淋巴细胞及其相关的细胞因子家族(TNF-α、IL-1β、INF-γ、IL-2、IL-12)在TAO病程早期占主导地位,并促进TAO进入活动期。在病程后期,Th2细胞因子家族(IL-4、IL-5、IL-10)占据主导地位,与病程维持和缓解有关[16]。TAO患者的眼眶成纤维细胞CD40的表达水平高于正常对照组,CD40属于TNF-R家族,存在于巨噬细胞、淋巴细胞和甲状腺细胞等多种细胞表面,参与B细胞调节、增殖、抗体产生和记忆细胞的转化。眼眶成纤维细胞通过CD40-CD154共刺激通路与活化的T细胞连接并相互作用,促进成纤维细胞产生IL-6、IL-8和巨噬细胞趋化蛋白-1(MCP-1)[17]。
4 甲状腺相关眼病基因层面研究进展
TAO可以在GD之前、之后或同时出现,因此两者可能存在共同的致病基因。广受关注的易感基因包括肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、人类白细胞抗原(human leucocyte antigen,HLA)、细胞毒性T细胞抗原-4(cytotoxic T-lymphocyte antigen-4,CTLA-4)和其他位点如:细胞间粘附分子(intercellular adhesion molecule-1,ICAM-1)、Toll样受体(TLR)、B7分子等。尽管遗传因素和TAO风险增加之间的相关性是多年的研究热点,但迄今为止,TAO的遗传易感性尚无准确定论。
4.1 免疫相关细胞因子
TAO作为一种自身免疫性疾病,细胞因子在其发展过程中扮演重要角色。主要由浸润在球后组织的白细胞和成纤维细胞释放的细胞因子在眼眶自身免疫应答的级联反应中起关键作用。促炎和抗炎细胞因子之间的任何不平衡都可以改变下游级联反应并触发自身免疫反应。因此,影响促炎或抗炎细胞因子表达的单核苷酸多态性可以预防或促进TAO的发展[18]。伊朗的一系列详尽的免疫遗传学研究探讨了细胞因子基因多态性与TAO之间的关联,确定了促炎和抗炎细胞因子基因多态性和TAO之间的显著关联[19-20]。但不同细胞因子基因表达产生细胞因子的血清和眶内浓度、活性水平差异与TAO的相关性研究很少,对其全面的研究将对TAO免疫遗传机制的揭示具有重要价值。总的来说,关于细胞因子基因多态性与TAO相关性的结果具有争议,可能反映了不同种族群体易感性的遗传模式的差异[21]。
在所研究的细胞因子中,细胞因子TNF-α和IL-1家族的基因多态性对TAO遗传易感性的作用最明显。TNF基因编码的TNF-α,是一个关键的促炎细胞因子,也是TAO新的治疗目标。日本的学者发现,TNF基因5′端启动子/增强子区域(-1031 T/C、-863C/A)的2种核酸多态性与TAO的发展和严重性之间呈正相关[22]。中国的一项研究证实了(-863C/A)与TAO的显著相关性[23]。然而一项针对波兰患者的研究则显示该位点与TAO无显著关联,另一位点(-238G/A)则与TAO存在显著关联[24]。
IL-1可刺激眼眶成纤维细胞增殖、合成糖胺聚糖,诱导甲状腺细胞和眼眶成纤维细胞表达粘附分子、细胞因子、补充调节蛋白和应激蛋白。IL-1超级家族主要成员是IL-1α、IL-1β和IL-1受体拮抗剂(IL-1RA)。IL-1α和IL-1β是促炎细胞因子,参与急慢性炎症反应,IL-1RA与IL-1α、IL-1β竞争结合其受体[21]。正常者与TAO患者、TAO患者用激素治疗前后、TAO活动期和缓解期的血清IL-1α水平都有明显的差异,但只有较少研究报道其基因多态性与TAO显著关联性[25]。活动期TAO患者与健康个体的眼眶成纤维细胞IL-1RA基因的表达和调控间存在显著差异。与正常对照组相比,来自TAO患者的眼球后成纤维细胞表达和释放的细胞内可溶性IL-1RA的数量明显降低,IL-1和IL-1RA之间的不平衡在TAO的发病机制中发挥重要作用[26]。虽然多数研究未证实IL-1RA基因多态性与TAO有关[26],但伊朗的一项研究则发现两者之间的显著关联[20]。IL-1β基因多态性与TAO关系的研究结果有争议,有研究认为两者均为负相关[18],有研究认为两者为正相关[21]。一项包含来自台湾、伊朗和波兰数据的荟萃分析表明,rs1800587(IL-1α,-889T/C)和rs16944(IL-1β,-511A/G)多态性可能在亚洲人口中产生对TAO的易感性[21]。
日本的一项研究确定了8种不同的等位基因,被命名为INF-γ*1到INF-γ*8,其中INF-γ*3和INF-γ*5与TAO相关[27]。伊朗的一项研究表明,INF-γ(UTR5644A/T)位点的多态性与TAO显著相关[19]。
另有促炎细胞因子IL-12(-1188A/C)与伊朗人群TAO的易感性相关[19]。抗炎细胞因子中,TGF-β(+915G/C、+869C/T)、IL-4(-1098T/G、-590T/C)以及IL-10(-1082A/G、-819C/T)呈现出与TAO的相关性[20]。
4.2 人类白细胞抗原(HLA)
人主要组织相容性复合物(MHC)位于6号染色体,主要参与机体的免疫反应。位于MHC组织相容性区域的HLA基因多态性是TAO的遗传易感性因素之一。HLA分子有两种类型:Ⅰ类(A、B和C)和Ⅱ 类(DP、DQ和DR)。HLA-Ⅱ在CD4+T淋巴细胞的激活中扮演重要角色,是GD和TAO发展的关键候选基因之一[28]。
研究不同HLA等位基因与自身免疫反应关联性的主要限制是HLA等位基因与未定义相邻位点之间的连锁不平衡,这种连锁不平衡可能产生对功能的影响,因此需要对不同HLA等位基因的生物效应进行功能研究,以确定这些潜在的遗传关联性[29]。例如,HLA-Ⅰ类抗原HLA-B8与TAO有一定的关联,然而进一步研究表明,这种关联很可能由于HLA-B8和HLA-Ⅱ类分子特别是HLA-DR3(HLA-DRB1*03等位基因)之间的连锁不平衡引起[30]。HLA-DRB1的74位点的多态性具有TAO病理生理相关性,因为它在HLA-DR向T细胞提呈自身抗原中具有重要作用[31],然而也存在有不同意见的研究[24]。据报道,HLA-DR7等位基因在TAO遗传易感性方面也有作用,HLA-DR4、HLA-DPB2·1/8和HLA-DRB3等位基因和TAO有关联[32]。2007年的一项荟萃研究并没有显示HLA-DR3、-DR4和-DR7的多态性与TAO有任何显著关联[33]。日本的研究表明,HLA-A11、-B5、-DW12和-DR14与TAO相关,HLA-DPw2具有保护作用[32]。也有研究表明,与正常对照组相比,HLA-DQB1*0501在TAO患者基因中出现的频率较高[23]。
4.3 细胞毒性T淋巴细胞相关蛋白4(CTLA-4)
CTLA-4基因编码T细胞免疫反应的负调节因子,CTLA-4与GD有很强的相关性,因此很多文献对CTLA-4的基因多态性和TAO相关性进行了研究[34]。部分研究支持两者之间的密切关联[35-36],有些则持相反意见[33-34]。第一外显子第49位的A/G多态性一直是许多研究的重点,这种多态性导致氨基酸交换(苏氨酸/丙氨酸),使得CTLA-4的表达减少[35]。总体来说,TAO与CTLA-4基因多态性之间的显著相关性并没有得到证实,因为多数研究对TAO的定义不同,或者招募TAO患者的病情严重程度不同,再加上设计和数据报导方面的差异,荟萃分析存在相当大的局限性。
4.4 其他遗传因子
体内外研究均表明TSHR是TAO的靶抗原,理论上TSHR基因是GO遗传易感性的合适候选者,然而病例对照研究尚未发现TSHR基因多态性与TAO之间的关联,GD合并TAO患者与单纯GD患者对比、轻重度TAO患者之间对比均未发现TSHR基因多态性的显著差异[36]。TG可影响TAO的病程和严重程度,是TAO的重要靶点之一。有研究报道染色体8q24外显子27上的TG短串联重复序列与TAO有较强的相关性[37]。其他的基因多态性也被报道与TAO有关,比如细胞间粘附分子-1(ICAM-1)[38]、淋巴细胞蛋白酪氨酸磷酸酶(PTPN22)[39],核因子κ-B(NFκ-B)[40]、Toll样受体-9(TLR-9)[41]和CD86[42]。
5 总结与展望
目前关于TAO的易感性和发病机制,许多重要的知识空白需要进一步的研究来填补。TAO是多种易感基因和环境共同作用的结果,与TAO相关联的3个最常报道的遗传位点是CTLA-4、HLA-DRB-1和TNF-α,这三者之间的相互作用可能是TAO易感性和发病机制的重要决定因素。不同的基因以及“基因-基因”和“基因-环境”相互作用影响TAO的易感性、病程、严重程度及对治疗的反应性,对TAO遗传背景的阐明可提高我们对其发病机制的认识,全基因组分析可能发现TAO发病机制中涉及的新基因/蛋白,可作为未来治疗的新靶点。一些TAO候选基因包括IGF-1R编码基因、脂肪形成基因和透明质酸合成基因等仍有待进一步研究。随着人类遗传学项目包括人类基因组计划和人类单核苷酸多态性计划的完成,在不久的将来,可能会发现更多的TAO易感基因,可以更全面地理解TAO的发病机制,为其预防和诊疗提供新的思路。

