热休克蛋白B1在主动脉夹层中的表达变化及临床意义*
程 林, 陈 军, 蒋丁胜, 魏 翔
华中科技大学同济医学院附属同济医院心脏大血管外科,武汉 430030
主动脉夹层(aortic dissection,AD)是由各种病因引起的主动脉内膜破裂,血液从内膜破口进入中膜,主动脉壁形成真假腔的一种主动脉综合征[1-2]。AD是高度致死性疾病,主要以胸痛为临床表现。目前,主动脉夹层的诊断主要依赖于CT血管造影(CT angiography,CTA)等影像学检查。用于主动脉夹层辅助诊断的生物标志物主要包括平滑肌蛋白、可溶性弹性蛋白片段、肌球蛋白重链、肌酸激酶BB亚型以及D-二聚体等,但由于以上生物标志物的特异性均较差,所以其诊断价值并不高。目前对于主动脉夹层的治疗主要是外科手术、介入治疗以及杂交手术治疗,除了降压、镇痛以及控制心率等措施外,尚无有效的保守治疗以及预防策略,主要原因是我们目前对主动脉夹层的发病机制还知之甚少[3]。热休克蛋白B1(heat shock protein B1,HSPB1)主要作为ATP依赖的分子伴侣,参与应激状态时蛋白质重折叠过程,具有重要的抗凋亡与抗氧化作用[4],近年来关于HSPB1在心血管疾病中的作用有较多报道,而HSPB1在主动脉夹层中的作用与机制仍知之甚少。因此,本研究旨在探讨HSPB1在主动脉夹层患者主动脉壁中的表达情况,以期进一步明确其在主动脉夹层发病中的作用。
1 材料与方法
1.1 实验材料
40%甲醛溶液、二甲苯、无水乙醇、七水硫酸镁、碳酸氢钠、三氯甲烷、异丙醇、氯化钠、乙二胺四乙酸、乙酸钠、甘氨酸、十二烷基硫酸钠(SDS)、甲醇、浓盐酸、氟化钠、正钒酸钠均购自国药集团;石蜡购自上海佩欧生物科技有限公司;苏木精染液购自谷歌生物科技有限公司;伊红溶液、超净封片剂、弹性纤维EVG染色液购自贝索生物技术有限公司;Scott蓝化液购自上海信帆生物科技有限公司。RNA提取试剂Trizol溶液购自美国英杰生命技术有限公司;DEPC水购自生工生物工程(上海)股份有限公司;Transcriptor First Strand cDNA Synthesis Kit反转录试剂盒、LightCycler®480 SYBR GreenⅠMaster荧光定量PCR试剂盒、蛋白酶抑制剂cocktail、磷酸酶抑制剂PhosStop购自Roche公司;人源HSPB1定量引物及内参基因18S rRNA定量引物购自武汉擎科生物科技有限公司;Tris-base购自武汉飞羿科技有限公司;Triton X-100、甘油、Coomassice Brilliant Blue G250、酚红、二硫苏糖醇(DTT)、30%聚丙烯酰胺、过硫酸铵、四甲基乙二胺、叠氮钠、牛血清白蛋白、Tween-20购自美国Sigma-Aldrich公司;RIPA裂解液(含蛋白酶抑制剂和磷酸酶抑制剂)购自武汉安特捷生物有限公司;Tris-HCl购自SAFC Biosciences公司;十二烷基硫酸锂(LDS)购自北京沃凯生物科技有限公司;脱脂奶粉购自福州飞净生物科技有限公司;PVDF膜购自Millipore公司;PMSF蛋白酶抑制剂、蛋白免疫印迹显影液、HSPB1抗体购自赛默飞世尔科技(中国)有限公司;蛋白质电泳Marker及BCA蛋白定量试剂盒购自Thermo Scientific Pierce公司。
1.2 实验方法
1.2.1 样本及临床资料的采集 本研究经我院伦理委员会批准,13例主动脉夹层的主动脉壁标本均来自CTA明确诊断为Stanford A型主动脉夹层患者主动脉置换术后的主动脉标本。11例无夹层的主动脉壁标本来源于终末期扩张型心肌病或冠心病心脏移植患者,合并马凡氏综合征、肿瘤、免疫系统疾病、创伤性或医源性主动脉夹层等均不纳入本研究。采集主动脉夹层患者及无夹层对照组入院时的基本临床资料,通过主动脉CTA检查测量主动脉夹层患者主动脉(主动脉弓、升主动脉、胸主动脉、腹主动脉)直径。
1.2.2 苏木精-伊红染色(HE染色) 取得的主动脉壁标本经10%多聚甲醛溶液固定48 h,主动脉组织经过脱水、浸蜡、包埋等处理后,将组织切成5 μm厚的切片进行病理学检测。将切片置于65℃烘箱烤片30 min,使组织切片与玻片贴合紧密,随后进行脱蜡与水合。水合结束后,将玻片置入苏木精工作液孵育30 s,进行细胞核染色。利用1%盐酸乙醇分化5 s,自来水冲洗后放入Scott蓝化液中返蓝,放入伊红溶液中孵育1 min,进行细胞质染色。梯度乙醇脱水,超净封片剂封片。采用正置光学显微镜进行拍照,并分析结果。
1.2.3 EVG弹性纤维染色 烤片、脱蜡及水合步骤与上述HE染色步骤相同。水合结束后向切片滴加高锰酸钾溶液,反应3 min进行高锰酸钾氧化,随后放入蒸馏水中漂洗5 min。滴加草酸溶液,反应3 min进行草酸漂白,蒸馏水中漂洗5 min。95%乙醇溶液中浸泡30 s,常温避光24 h,将玻片放入Elastin染液中浸染。95%乙醇溶液中浸泡2次,每次浸泡2 min,自来水冲洗5 min,蒸馏水中漂洗1 min。滴加Van Gieson染液,反应1 min后进行脱水,95%乙醇溶液中浸泡1 min,100%乙醇溶液中浸泡3次,每次浸泡1 min,二甲苯溶液中浸泡3次,每次浸泡2 min。最后利用超净封片剂进行封片,拍照后分析结果。
1.2.4 荧光定量PCR(qRT-PCR)检测 每例主动脉壁样本取50 mg进行RNA提取,采用Trizol法提取总mRNA。向装有主动脉组织的离心管中加入1 mL Trizol溶液,充分研磨后将组织匀浆液转移至新的离心管中。加入200 μL三氯甲烷,用力摇晃后室温静置5 min,4℃ 12000×g离心15 min。将离心后的上层水相溶液转移至新的离心管中,加入500 μL异丙醇离心去上清,加入1 mL 75%乙醇溶液(用DEPC水配制)充分漂洗RNA沉淀,离心,去上清,将离心管内的溶液用电枪吸净,随后进行风干。风干后,每管加入100 μL DEPC水溶解RNA。提取结束后利用NanoDrop 2000C超微量分光光度计检测RNA浓度。每管取2 μg总RNA利用Transcriptor First Strand cDNA Synthesis Kit反转录试剂盒进行反转录。反转录结束后,利用LightCycler®480 SYBR GreenⅠMaster荧光定量PCR试剂盒进行RT-PCR实验,通过实时荧光定量PCR仪检测主动脉组织中HSPB1 mRNA表达水平。HSPB1的上游引物为:5′-CAGTCCAACGAGATCACCATC-3′,下游引物为:5′-CAGTCTCATCGGATTTTGCAG-3′;内参基因18S rRNA的上游引物为:5′-CTCAACACGGGAAACCTCAC-3′,下游引物为:5′-CGCTCCACCAACTAAGAACG-3′。
1.2.5 蛋白免疫印迹实验 每份主动脉壁标本取500 mg提取蛋白。向装有主动脉组织的离心管中加入300 μL RIPA混合裂解液。充分研磨后,4℃ 12000×g离心15 min。将蛋白上清液转移至新的离心管中。利用BCA蛋白定量试剂盒进行蛋白定量,向蛋白样品中加入DTT溶液和LDS loading buffer调整蛋白浓度至相同水平。将蛋白样品放于95℃恒温金属浴中加热1 min,12000×g离心1 min,随后进行蛋白电泳。向预先配制好的10%SDS-PAGE凝胶泳道中加入相同体积的蛋白样品,80 V电泳30 min,120 V电泳至溴酚蓝跑至胶底。电泳结束后,进行转膜(260 mA,60 min),5%脱脂牛奶室温封闭1 h。TBST溶液清洗3次,每次5 min,4℃孵育一抗过夜。TBST溶液清洗3次,每次5 min,室温孵育二抗1 h。TBST溶液清洗后,利用Image Lab凝胶成像系统进行显影,采集结果并使用Image Lab分析软件进行蛋白表达相对定量分析。
1.3 统计学方法
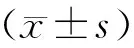
2 结果
2.1 主动脉夹层患者与对照组临床资料及影像学结果对比
主动脉夹层患者有13例,均为Stanford A型主动脉夹层,对照组有11例。所有入选患者的临床资料如表1所示,主动脉夹层患者高血压的发病率更高,其他基本资料差异无统计学意义。主动脉夹层患者主动脉弓直径为(35.7±4.8)mm,升主动脉直径为(46.9±7.3)mm,胸主动脉直径为(33.2±4.2)mm,腹主动脉直径为(24.3±3.6)mm。主动脉夹层患者胸腹主动脉CTA影像检查及三维重建结果显示升主动脉、主动脉弓部及胸主动脉有明显的内膜片及假腔形成(图1)。
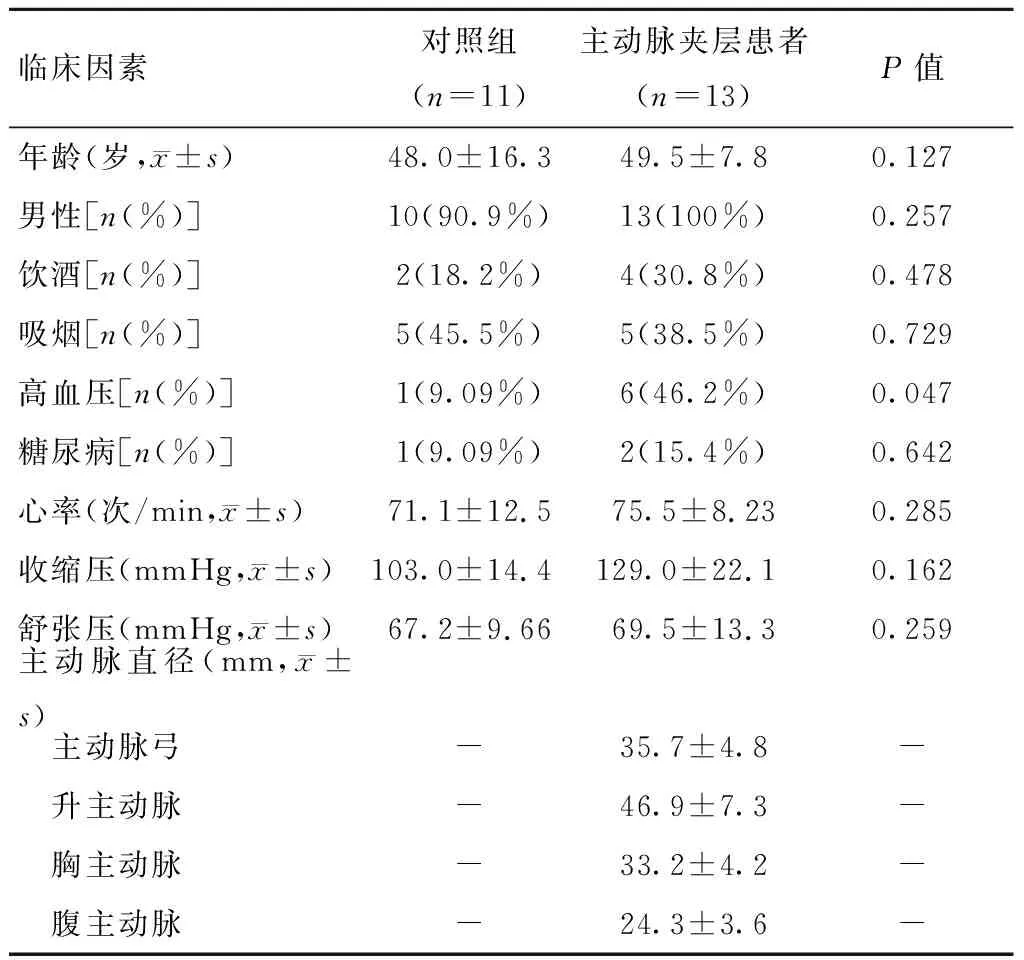
表1 主动脉夹层患者与对照组临床资料对比Table 1 Clinical data of AD patients and control group
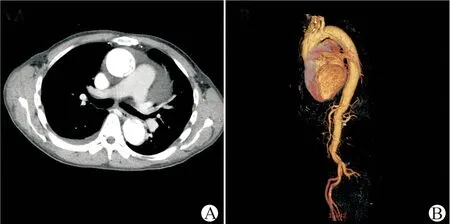
A:主动脉夹层患者胸腹主动脉CTA检查;B:主动脉夹层患者主动脉三维重建图1 主动脉夹层患者影像学检查结果Fig.1 Imaging examination results of AD patients
2.2 主动脉夹层患者与对照组主动脉病理学染色结果比较
主动脉壁HE染色结果显示,在对照组中,主动脉壁结构规整,平滑肌细胞形态正常,排列紧密,而主动脉夹层患者主动脉中膜结构排列紊乱,平滑肌细胞出现退行性改变(图2A)。EVG弹性纤维染色结果显示,对照组主动脉壁弹性纤维结构完整,排列有序,而主动脉夹层患者主动脉壁中弹性纤维断裂明显且伴有数量的减少(图2B)。
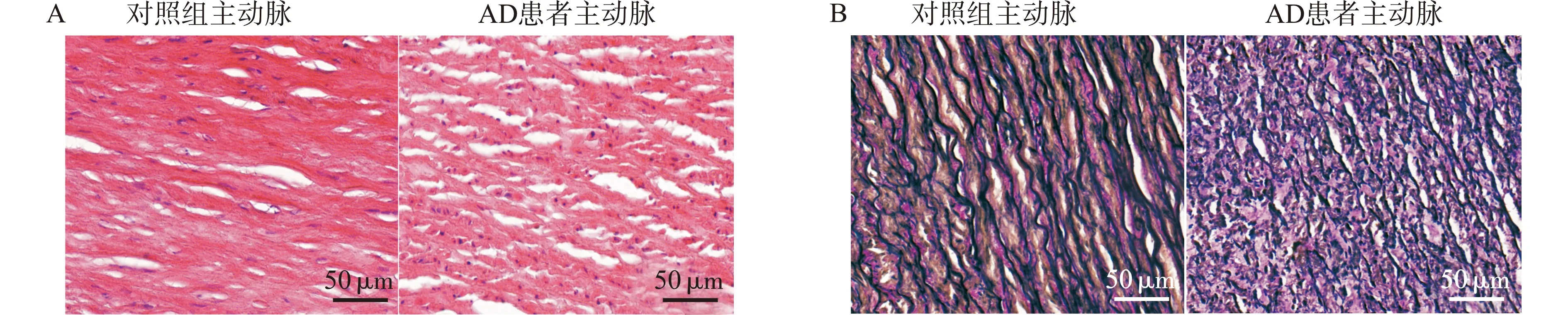
A:主动脉HE染色结果;B:主动脉EVG弹性纤维染色结果图2 对照组与主动脉夹层患者主动脉HE与EVG弹性纤维染色结果Fig.2 HE and EVG staining of aortas in control group and AD patients
2.3 主动脉HSPB1表达水平及与主动脉直径的相关性
qRT-PCR实验和Western blot实验结果提示,主动脉夹层患者主动脉壁中的HSPB1 mRNA及蛋白表达水平显著低于对照组,mRNA与蛋白分别约为对照组的28%与57%(图3A、3B),差异均有统计学意义(均P<0.05)。Pearson相关性分析结果表明,主动脉夹层患者HSPB1的mRNA表达水平与主动脉直径无明显相关性(图3C)。
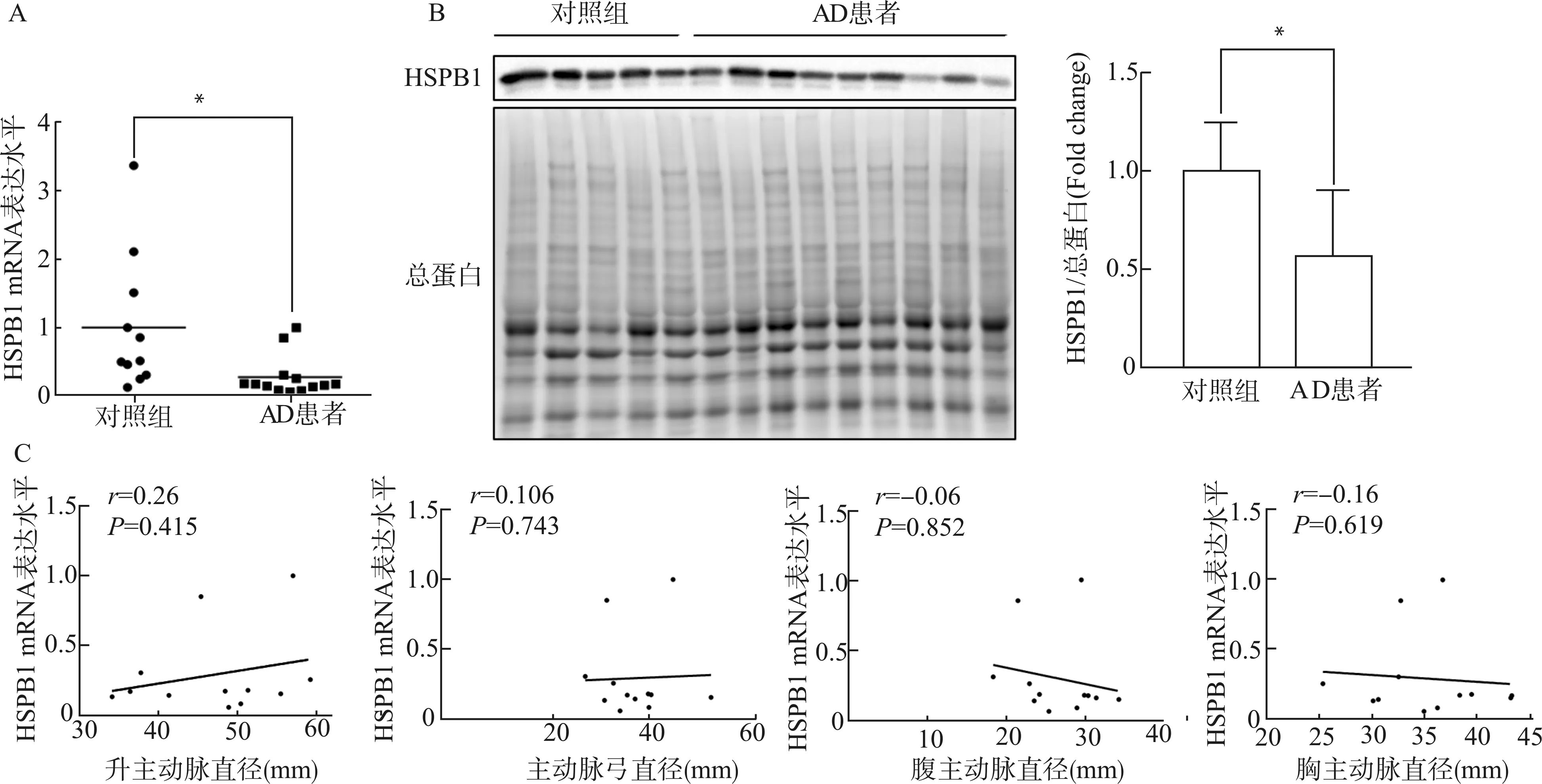
A:对照组与主动脉夹层患者主动脉HSPB1 mRNA表达水平;B:对照组与主动脉夹层患者主动脉HSPB1蛋白表达水平及蛋白定量;C:主动脉夹层患者主动脉直径与HSPB1 mRNA表达水平相关性分析;*P<0.05图3 对照组与主动脉夹层患者主动脉HSPB1表达水平与相关性分析Fig.3 HSPB1 mRNA and protein expression level of aortas in control group and AD patients and correlation analysis between HSPB1 mRNA expression level and aortic diameter
3 讨论
主动脉夹层是一种极为凶险的急危重症,A型主动脉夹层患者在发病48 h内死亡率高达50%[5]。因此,进一步阐明主动脉夹层发生发展的分子机制,对主动脉夹层的防治具有重要的临床意义。HSPB1属于热休克蛋白分子家族中的一员,是一种非ATP依赖性的蛋白分子伴侣,主要参与细胞稳态的维持,抑制细胞衰老以及抗氧化应激等过程[6-7]。关于HSPB1在心血管疾病中的研究结果显示,小鼠心肌梗死的心脏组织中HSPB1 mRNA与蛋白表达水平均明显升高,心脏特异性的HSPB1基因敲除能促进心肌梗死后白细胞的渗出,增强炎性细胞因子的表达以及TLR4/MyD88/NF-κB信号通路的激活,进而导致心脏重构[8]。另外,心脏特异性的HSPB1过表达能下调衰老小鼠心脏组织中衰老标志分子p53与p16的表达,降低衰老心脏组织中活性氧含量以及LC3-Ⅱ与p62的激活,抑制心脏组织纤维化,促进线粒体自噬激活,进而抑制心肌老化诱导的心功能减弱[9]。然而,HSPB1在主动脉夹层病变中是否发挥作用尚未见文献报道。
本研究揭示了主动脉夹层患者主动脉中HSPB1 mRNA与蛋白表达水平显著下调,并且下调的HSPB1 mRNA表达与患者主动脉直径无明显相关性,表明HSPB1 mRNA表达水平的降低与患者主动脉夹层的发生有关。现有研究表明,氧化应激在主动脉夹层的病变过程中具有重要作用。比如,Liao等[10]的研究提示,主动脉夹层患者主动脉中膜抗氧化蛋白超氧化物歧化酶(SOD)蛋白表达水平显著降低,脂质过氧化物丙二醛水平显著增加。同时,熊去氧胆酸能通过抑制氧化应激诱导的血管平滑肌细胞的凋亡从而抑制急性主动脉夹层的形成[11]。此外,国内学者的研究发现巯基乙醇能抑制主动脉的氧化应激、炎症反应,并促进细胞外基质信号通路激活,从而抑制主动脉夹层的形成[12]。以上研究均提示氧化应激在主动脉夹层形成过程中具有重要调控作用。目前,HSPB1主要作为一种蛋白分子伴侣发挥抗氧化应激的作用,本研究中我们发现主动脉夹层患者主动脉中HSPB1 mRNA与蛋白表达水平发生下调,HSPB1表达水平的下调可能进一步导致其抗氧化应激能力减弱,进而诱发主动脉夹层的发生。
综上所述,本研究探究了HSPB1在主动脉夹层中的表达变化,揭示了HSPB1 mRNA下调与主动脉夹层患者主动脉壁直径无明显相关性,提示HSPB1可能参与主动脉夹层的发生,为主动脉夹层发病的机制探索提供了分子水平的依据。然而,导致HSPB1 mRNA与蛋白表达水平下调的机制以及HSPB1在主动脉夹层中发挥作用的确切分子机制还有待于进一步研究。

