早期肠内营养干预对结肠癌患者营养指标及预后的影响
姚坤 李敏
大连医科大学附属第二医院疝与结直肠外科 116023
结肠癌是临床上常见的消化道恶性肿瘤,发病率占胃肠道肿瘤的第三位,好发于直肠与乙状结肠交界处,以40~50岁年龄人群发病率最高,男女比例为2~3∶1〔1〕。目前,手术仍然是治疗结肠癌的重要手段,以结肠癌根治术为常用方法〔2〕。有研究发现,结肠癌患者术前常伴随不同程度的营养不良,加之手术创伤引起机体出现应激反应,严重损伤免疫机制,增加患者术后营养不良发生风险〔3〕。据调查,结肠癌患者的营养不良发生率高达60%,严重影响患者的康复进程,导致预后变差〔4〕。营养支持是改善患者营养状态、提高免疫能力的有效措施〔5〕。肠内营养支持是术后营养支持的公认方式,能够有效纠正、预防营养不良,调节机体免疫能力〔6〕。本研究探讨早期肠内营养干预对结肠癌患者营养指标及预后的影响。
1 资料与方法
1.1 一般资料
选择2019年1月至2019年12月于大连医科大学附属第二医院就诊的结肠癌患者68例,遵循随机原则分为研究组与对照组各34例。纳入标准:①均经肠镜、病理活检检查证实,符合结肠癌的诊断标准〔7〕;②无手术禁忌证,均接受结肠癌根治术治疗;③年龄18~75岁;④签署知情同意书。排除标准:①合并严重肝肾功能障碍者,②合并严重心肺疾病者,③合并内分泌疾病者,④合并自身免疫系统疾病者,⑤合并糖尿病者,⑥术中发现远处转移者,⑦既往行腹部手术者,⑧妊娠期、哺乳期妇女。研究组男20例,女14例;年龄37~72岁,平均(48.95±7.11)岁;体重指数(BMI)为22~25 kg/m2,平均(23.37±1.09)kg/m2;位置:升结肠14例,乙状结肠12例,横结肠5例,降结肠3例;病理类型:低分化癌10例,中分化癌8例,高分化癌16例;TNM分期:Ⅰ期5例,Ⅱ期14例,Ⅲ期15例。对照组男21例,女13例;年龄39~70岁,平均(49.35±8.63)岁;BMI为22~25 kg/m2,平均(23.40±1.15)kg/m2;位置:升结肠13例,乙状结肠11例,横结肠6例,降结肠4例;病理类型:低分化癌11例,中分化癌8例,高分化癌15例;TNM分期:Ⅰ期6例,Ⅱ期14例,Ⅲ期14例。两组患者的一般资料比较差异无统计学意义(P>0.05),具有可行性。本研究已经征得该院医学伦理委员会批准。
1.2 方法
对照组患者术后常规禁食,进行胃肠检验,并实施静脉补钾补液、补充氨基酸、脂肪乳及能量等肠外营养支持措施,待患者肛门排气、排便后,由主治医师评估后可逐渐减少肠外营养支持,恢复经口进食直到完成正常进食。研究组患者术前1 d于胃腔留置鼻空肠营养管,术中将营养管引导到Treitz韧带远端20 cm空肠处,并于此处置入空肠营养管,从左上腹引出体外,于术后12 h予以早期肠内营养干预,通过管道输注0.9% NaCl溶液250 ml,6 h内无异常可通过管道输注5%葡萄糖溶液250 ml,然后根据患者的体重输注免疫增强肠内营养制剂,采取输液泵匀速滴注,滴速为20~30 ml/h,采用体外恒温加热器将免疫增强肠内营养制剂加温到35~40℃,待患者肛门排气、排便后,由主治医师评估可经口进食后,可配合喂食鱼汤、肉汤等流食,并逐渐过渡到半流食。
1.3 观察指标
①于术后1 d、7 d采两组患者的早晨空腹外周静脉血3 ml,3 000 r/min离心15 min,分离血清后置于-80℃冰箱中保持,采用ADVIA 2400全自动生化分析仪检测营养指标:前白蛋白、白蛋白、血红蛋白水平,采用Coulter EPics XL流式细胞仪检测免疫指标:CD3+、CD4+、CD8+水平,计算CD4+/CD8+值,采用酶联免疫吸附试验(ELISA)检测炎症因子:C-反应蛋白(CRP)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)水平。②于术后1 d、7 d采取两组患者的早晨空腹外周静脉血3 ml,3 000 r/min离心15 min,分离血浆后采用改良酶学分光光度法检测肠黏膜通透性指标:血浆二胺氧化酶(DAO)、D-乳酸水平,留取两组患者术后1 d、7 d的晨尿,采用高效液相色谱法测定乳果糖/甘露醇(L/M)比值。③胃肠功能:观察两组患者术后肠鸣音恢复时间、进食时间、首次排气时间、首次排便时间及住院时间。
1.4 统计学方法
2 结果
2.1 两组患者营养指标比较
研究组患者术后7 d的前白蛋白、白蛋白、血红蛋白水平均显著低于对照组(均P<0.05)。见表1。
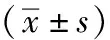
表1 两组患者营养指标比较
2.2 两组患者免疫功能比较
研究组患者术后7d的CD3+、CD4+、CD4+/CD8+水平显著高于对照组,CD8+水平均显著低于对照组(均P<0.05)。见表2。
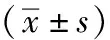
表2 两组患者免疫功能比较
2.3 两组患者炎症因子比较
研究组患者术后7 d的血清CRP、IL-6、TNF-α水平显著低于对照组(P<0.05)。见表3。
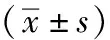
表3 两组患者炎症因子比较
2.4 两组患者肠黏膜通透性比较
研究组患者术后7 d的尿L/M比值、血浆DAO及D-乳酸水平显著低于对照组(P<0.05)。见表4。
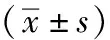
表4 两组患者肠黏膜通透性比较
2.5 两组患者胃肠功能比较
研究组患者的肠鸣音恢复时间、进食时间、首次排气时间、首次排便时间及住院时间均显著短于对照组(P<0.05)。见表5。
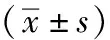
表5 两组患者胃肠功能比较
3 讨论
结肠癌是发生于结肠部位的消化道恶性肿瘤,其病因尚未明确,但存在较多的高危因素,如年龄、生活习惯、饮食习惯、家族病史,随着我国居民生活水平不断提高,生活方式及饮食习惯发生巨大变化,使得结肠癌发病率增高,严重危及居民的身体健康〔8〕。根治性切除术是治疗结肠癌的常见术式,能够有效切除病灶,但由于该术式仍属于有创治疗手段,改变人体生理解剖功能,且手术创伤大,不可避免会造成机体损伤,损伤肠黏膜,导致肠内菌群失调,易发生并发症,加之结肠癌的慢性消耗会增加患者的基础代谢,手术进一步增加机体分解代谢,导致机体免疫功能降低,机体耐受力下降,使得患者术后伴有不同程度的营养不良,延迟患者术后生理机能恢复进程,影响患者预后,是结肠癌患者术后亟待解决的临床护理难题〔9〕。
营养支持是临床上应用较广的营养治疗方法,与肠外营养相比,肠内营养更符合人体生理特点,能够维持肠黏膜细胞的正常结构与功能,且对肝、肾等重要器官功能影响更小〔10〕。近年来,早期肠内营养支持作为胃肠道手术后护理方法被提出,该措施是在胃肠道手术后24 h予以肠内营养支持,这种理念在国内护理界中受到重视,多项研究证实了术后早期肠内营养支持有利于改善胃肠道手术患者的营养状态〔11〕。
本研究显示,术后早期肠内营养干预可满足患者的生理代谢需要,能够有效促进机体合成蛋白质,有效纠正营养失衡状态,降低机体的营养不良风险,改善机体营养状况。早期肠内营养干预能够纠正机体蛋白质、脂肪代谢紊乱,促使血清蛋白和血脂水平维持正常,以增加机体组织修复功能,提高机体免疫功能。
结肠癌根治术会对患者机体造成较大创伤,导致机体免疫功能受到影响,机体出现严重应激反应,引起炎性反应〔12〕。本研究显示,早期肠内营养干预能够纠正肠道菌群失衡,保护肠道黏膜屏障,改善机体营养状态,减轻炎性反应。有研究提示,根治性切除术后结肠癌患者机体内大量谷氨酸被消化,导致自身合成难以满足机体所需,使得机体长时间处于低水平谷氨酰胺状态,致使肠黏膜屏障萎缩、畅通透析增高、肠道细菌异位〔13〕。有研究显示,早期肠内营养支持能够改善肠黏膜细胞结构的稳定性,减轻肠黏膜细胞损伤,保护肠黏膜屏障功能,促进肠黏膜功能恢复〔14-15〕。
综上所述,早期肠内营养干预可改善结肠癌患者术后的营养状况,提高机体免疫功能,减轻炎症状态,可维持肠黏膜通透性,保护肠黏膜屏障功能,促进胃肠功能恢复,缩短患者的住院时间,改善患者的预后。
利益冲突所有作者均声明不存在利益冲突

