高产苯乳酸菌株的筛选及其在豆粕发酵中的应用
谢全喜,侯楠楠,王 梅,王 倩,曹 斌,谷 巍
(山东宝来利来生物工程股份有限公司 山东省动物微生态制剂重点实验室,山东 泰安 271000)
苯乳酸即3-苯基乳酸或β-苯乳酸,是近年来发现的一种新型有机酸,具有广谱的抑菌活性,对革兰氏阳性细菌、革兰氏阴性细菌和真菌均有抑菌作用[1]。目前制备苯乳酸的方法主要有化学合成法和微生物发酵法,其中微生物发酵法因反应条件温和、安全环保等优点成为理想的制备方法[2]。苯乳酸产生菌的筛选研究表明,大部分乳酸菌都能产生苯乳酸[2-3],此外还有白地霉[4]、丙酸菌[5]、片球菌[6]和芽孢杆菌[7]等菌株。其中乳酸菌作为重要的益生菌,应用历史悠久、安全性高,且农业部颁布的饲料添加剂品种目录中明确规定植物乳杆菌(Lactobacillus plantarum)、嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacillus casei)、乳酸片球菌(Pediococcus acidilactici)和戊糖片球菌(Pediococcus pentosaceus)等乳酸菌可以添加进饲料中应用于动物生产。有研究表明,应用干酪乳杆菌和植物乳杆菌[8-9]等乳酸菌菌株发酵,苯乳酸产量多在2.0 g/L以下,无法满足规模化生产要求,因此,筛选苯乳酸高产菌株尤为重要。目前苯乳酸生物合成研究中利用的底物有苯丙氨酸和苯丙酮酸,苯丙酮酸是苯乳酸合成的最直接前体[1],苯丙氨酸主要被氨基转移酶转化成苯丙酮酸后,再被还原为DL-苯乳酸,苯丙氨酸的转氨反应是苯乳酸合成的限速步骤,用苯丙酮酸代替苯丙氨酸作为底物可有效突破这一瓶颈。王立梅等[10]研究发现,在乳酸菌发酵过程中外源添加苯丙酮酸可以显著提高苯乳酸产量。
微生物保鲜技术具有天然、无毒、无抗生素抗性、保鲜效果好等优点[11]。乳酸菌作为一种新型生物保护剂,可以产生拮抗代谢产物(如苯乳酸和乳酸链球菌素等)控制腐败菌滋生[12],且由于苯乳酸抑菌谱广泛、安全稳定,被广泛应用在食品生产、医药、化妆品工业和饲料等行业中,研究发现苯乳酸可作为一种饲料添加剂代替抗生素直接应用到饲料行业中,具有改善机体生产性能、提高其能量消化率及免疫力[13]等功效。但并未发现其作为防腐剂应用在豆粕发酵中。豆粕是制作牲畜与家禽饲料的主要原料,豆粕发酵后可显著降低或钝化其中的抗营养因子,将大分子蛋白质分解为小肽或氨基酸,显著提高粗蛋白、酸溶蛋白和总酸含量,提高其消化率[14]。豆粕一般是生料直接发酵,微生物在豆粕发酵过程中的活动及代谢产物会影响豆粕的发酵品质,其中不良微生物如大肠杆菌(Escherichia coli)和霉菌等大量繁殖会消耗豆粕的营养物质,从而降低发酵品质。将高产苯乳酸的乳酸菌应用在豆粕发酵中,乳酸菌发酵可以改善豆粕品质,同时产生苯乳酸可以抑制不良微生物的生长,减少营养损失。因此,筛选高产苯乳酸的菌株应用在豆粕发酵中就显得尤为重要。
本研究旨在以实验室保存的性能优良的乳酸菌为出发菌株,利用薄层层析(thin-layer chromatography,TLC)及高效液相色谱(high performance liquid chromatography,HPLC)法筛选高产苯乳酸的乳酸菌,并利用该菌株对豆粕进行固体发酵,研究其对发酵豆粕中微生物、酸溶蛋白、总酸和苯乳酸含量等的影响,以期达到提高发酵豆粕中苯乳酸含量,延长发酵饲料保质期的目的。
1 材料与方法
1.1 材料与试剂
1.1.1 原料及菌株
去皮豆粕:市售,黄色、无霉变、无结块和异味,粉碎后过筛。
植物乳杆菌(Lactobacillus plantarum)BLCC2-0410、BLCC2-0126、BLCC2-0111、BLCC2-0092、BLCC2-0069、BLCC2-0001、BLCC2-0015;发酵乳杆菌(Lactobacillus fermentium)BLCC2-0021、BLCC2-0063、BLCC2-0296:由山东宝来利来生物工程股份有限公司生物工程研究院菌种资源保藏中心保存。
1.1.2 培养基
MRS培养基[15]:葡萄糖20 g、蛋白胨10 g、牛肉膏8 g、酵母膏4 g、硫酸镁0.5 g、硫酸锰0.3 g、柠檬酸铵2 g、乙酸钠5 g、吐温-80 1 mL,蒸馏水定容至1 000 mL,调pH值至6.0,121 ℃灭菌20 min。固体培养基中添加琼脂20 g。
1.1.3 试剂
葡萄糖(生化试剂):山东祥瑞药业有限公司;蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;酵母膏、牛肉膏(均为生化试剂):天津市英博生化试剂有限公司;硫酸镁、硫酸锰(均为分析纯):济南汇丰达化工有限公司;柠檬酸铵(分析纯):上海抚生实业有限公司;乙酸钠(分析纯):青岛捷世康生物科技有限公司;吐温-80:天津凯通化学试剂有限公司;三氟乙酸、甲醇(均为色谱纯):天津市永大化学试剂有限公司;微孔滤膜(直径13 mm、孔径0.22 μm):上海安谱有限公司;苯丙酮酸标准品、DL-3苯乳酸标准品(纯度均>99%):美国Sigma公司。
1.2 仪器与设备
PHS-3C雷磁精密pH计:上海仪电科学仪器股份有限公司;DHP-9082数显恒温培养箱:上海一恒科学仪器有限公司;DHG-9140A电热鼓风干燥箱:常州诺基仪器有限公司;KDN-103F自动定氮仪、HYP308消化炉:上海纤检仪器有限公司;HH-4恒温水浴锅:国华电器有限公司;SHB-ⅢS循环水式多用真空泵:郑州长城科工贸有限公司;XW-80A旋涡混合器:上海弛唐电子有限公司;SD120D超声波清洗机:宁波新芝生物科技股份有限公司;SX2-4-10箱式电阻炉:龙口市电炉制造厂;LD5-2A低速离心机:北京京立离心机有限公司;SW-CJ-2F(2)超净工作台:苏州安泰空气技术有限公司;LC-20A HPLC仪:日本岛津公司。
1.3 方法
1.3.1 产苯乳酸菌株的筛选
将被试乳酸菌菌株接种于MRS固体斜面培养基上,37 ℃静置培养24 h。将培养好的斜面在无菌条件下用接种环接种2环于100 mL含5 g/L苯丙酮酸的MRS液体培养基中,在37 ℃条件下静置培养24 h,4 000 r/min离心10 min,弃菌体,取发酵上清液采用薄层层析法[16]检测被试菌株发酵液中是否有苯乳酸产生。
1.3.2 高产苯乳酸菌株的筛选
将薄层层析法筛选得到的可能产生苯乳酸的乳酸菌菌株接种于MRS固体斜面培养基上,37 ℃静置培养24 h。将培养好的斜面在无菌条件下用接种环接种2环于100 mL额外添加3.0 g/L苯丙酮酸的MRS液体培养基中,在37 ℃条件下静置培养24 h和48 h,4 000 r/min离心10 min,弃菌体,取发酵上清液采用高效液相色谱法检测被试菌株发酵液中苯乳酸含量[17]。
1.3.3 发酵底物的选择
将乳酸菌菌株BLCC2-0069接种于MRS固体斜面培养基上,37 ℃静置培养24 h。将培养好的斜面在无菌条件下用接种环接种2环于100 mL额外添加3.0 g/L苯丙酮酸或苯丙氨酸的MRS液体培养基中,在37 ℃条件下静置培养24 h和48 h,4 000 r/min离心10 min,弃菌体,取发酵上清液采用高效液相色谱法检测被试菌株发酵液中苯乳酸含量,以期筛选最优发酵底物。
1.3.4 产苯乳酸菌株对豆粕发酵品质的影响
发酵种子液的制备:将筛选的3株产苯乳酸菌株接种于MRS固体斜面培养基上,37 ℃培养24 h;将培养好的斜面,在无菌条件下用接种环挑取一环接种至15 mL MRS培养基中,于37 ℃静置培养24 h;按照2%(V/V)的接种量接种至250 mL MRS液体培养基中,于37 ℃静置培养24 h。
准确称取一定量的国产去皮豆粕,按照去皮豆粕的0.15%加入苯丙酮酸,料水比为1.00∶0.45(g∶mL),装料量200 g/袋,压实。按2%接种量分别接入培养好的乳酸菌种子液,以不接种任何菌株的豆粕为对照组,每组设3个平行,均置于37 ℃培养箱进行厌氧固态发酵,分别于发酵72 h取样,测定发酵料中微生物、总酸、粗蛋白、酸溶蛋白和苯乳酸含量,以期筛选高产苯乳酸菌株。
1.3.5 高产苯乳酸菌株发酵时间对豆粕发酵品质的影响
按照1.3.4方法采用高产苯乳酸菌株固态发酵豆粕,分别于发酵1 d、2 d、3 d、5 d和7 d取样,测定发酵料pH值、乳酸菌、总酸含量和苯乳酸含量。以只添加菌株的豆粕为对照组;以既不添加苯丙酮酸也不接种任何菌株的豆粕为空白组。
1.3.6 分析检测方法
(1)理化指标
pH值采用pH计测定;水分含量:按GB/T 6435—2014《饲料中水分的测定》测定;粗蛋白含量(以干物质计):按GB/T 6432—2018《饲料中粗蛋白的测定 凯氏定氮法》测定;酸溶蛋白含量(以干物质计):按GB/T 22492—2008《大豆肽粉》酸溶蛋白测定;总酸含量(以乳酸计):参照国标GB/T 12456—2008《食品中总酸的测定》测定。
(2)微生物指标
分别按照国标GB/T 4789.35—2010《食品安全国家标准食品微生物学检验乳酸菌检验》、GB 4789.15—2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》及GB 4789.3—2016《食品安全国家标准食品微生物学检验大肠菌群计数》。
1.3.7 数据分析
试验数据采用Excel2007进行初步处理后,采用SPSS13.0软件进行统计分析,采用单因素方差分析(one-wayANOVA)程序进行方差分析,结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 产苯乳酸菌株的筛选
采用TLC法筛选产苯乳酸菌株,结果见表1。

表1 薄层层析法筛选产苯乳酸乳酸菌菌株结果Table 1 Screening results of lactic acid bacteria strains producing phenyllactic acid by thin layer chromatography method
由表1可知,从10株乳酸菌株共检出3株产苯乳酸的菌株,分别为植物乳杆菌BLCC2-0069、BLCC2-0410和发酵乳杆菌BLCC2-0021。
2.2 高产苯乳酸菌株的筛选
采用HPLC法对3株乳酸菌菌株的苯乳酸产量进行检测,结果见表2。

表2 3株乳酸菌菌株的苯乳酸产量Table 2 Phenylactic acid yield of three lactic acid bacteria strains
由表2可知,发酵24 h时菌株BLCC2-0069发酵液中苯乳酸含量最高,为1.259 g/L,显著高于其余各菌株(P<0.05);发酵48 h时菌株BLCC2-0069发酵液中苯乳酸含量最高为1.435g/L,分别高于菌株BLCC2-0021和BLCC2-0410的58.21%和8.79%,差异显著(P<0.05)。齐世华等[9]研究发现,植物乳杆菌Lp45发酵液中苯乳酸含量达到98.3 mg/L,在发酵乳中接菌量为150 U/T时抑制霉斑产生的能力强于商业保鲜产品。微生物发酵法已成为一种理想的制备苯乳酸的方法,不同微生物菌种产苯乳酸能力不同,筛选优良的微生物菌种是影响苯乳酸产量的首要条件。LAVERMICOCCA P等[18]从酸面团里分离到的植物乳杆菌能够产生苯乳酸,产量为56mg/L。随后研究者发现多种乳酸菌均可产生苯乳酸,杨小院等[19]研究发现,植物乳杆菌发酵生产苯乳酸条件优化后产量为(252.44±2.63)mg/L,与优化前(115.99±4.25)mg/L相比,产量提高了1.17倍;GUIMARAES A等[20]研究发现,Lactobacillus plantarumUM55的发酵上清液可以抑制黄曲霉的生长,并减少黄曲霉毒素的产生,其中一种抑菌物质就是苯乳酸。在本研究中,利用高效液相色谱法筛选到一株高产苯乳酸的植物乳杆菌BLCC2-0069,液体发酵48 h时发酵液中苯乳酸含量为1.435 g/L,高于现有文献中报道的苯乳酸含量。
2.3 发酵底物的选择
不同底物对菌株BLCC2-0069发酵产苯乳酸的影响见表3。
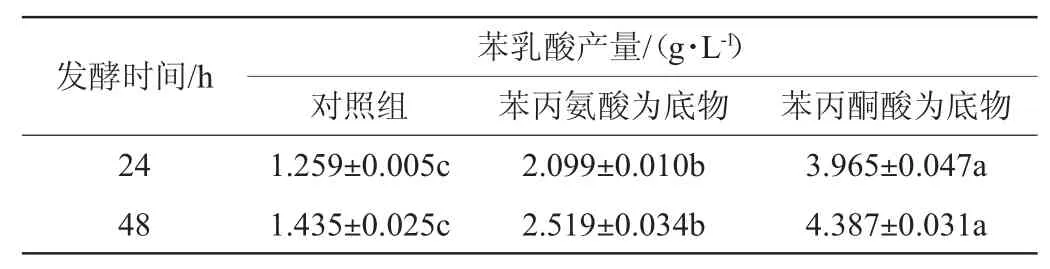
表3 不同底物对菌株BLCC2-0069发酵产苯乳酸的影响Table 3 Effect of different substrates on phenyllactic acid production by strain BLCC2-0069
由表3可知,菌株BLCC2-0069发酵24 h时,以苯丙酮酸为底物的发酵液中苯乳酸含量最高,为3.965 g/L,显著高于对照组和苯丙氨酸组(P<0.05)。以苯丙氨酸为底物的发酵液中苯乳酸含量次之,为2.099 g/L,显著高于对照组66.72%(P<0.05);随发酵时间延长发酵液中苯乳酸含量增加,发酵48 h时,以苯丙酮酸为底物的发酵液中苯乳酸含量最高,为4.387 g/L,其次是苯丙氨酸为底物组,但均显著高于对照组(P<0.05)。结果表明,以3 g/L添加苯丙氨酸或苯丙酮酸均能够提高发酵液中苯乳酸含量,且以苯丙酮酸效果最好,发酵48 h发酵液中苯乳酸含量高达4.387 g/L。
苯丙氨酸和苯丙酮酸是合成苯乳酸的重要前体,通过外源添加前体,利用微生物转化前体合成苯乳酸,可以提高苯乳酸产量[21-22]。RODRIGUEZ N等[23]研究发现,以0.6 g/L苯丙氨酸为底物时,植物乳杆菌(Lactobacillus plantarum)转化苯丙氨酸合成(4.25±0.18)mmol/L苯乳酸;WANG L M等[24]在干酪乳杆菌(Lactobacillus paracasei)W2发酵过程中间歇流加苯丙酮酸,发酵36 h时,苯乳酸产量达到2.121 g/L,转化率为47.2%。在本研究中,乳酸菌BLCC2-0069液体发酵时,以3 g/L添加苯丙氨酸或苯丙酮酸均能够提高发酵液中苯乳酸含量,其中以苯丙酮酸为底物时苯乳酸产量较高,发酵48 h发酵液中苯乳酸含量高达4.387 g/L。
2.4 产苯乳酸菌株对豆粕发酵品质的影响
3株产苯乳酸菌株发酵对豆粕微生物指标的影响见表4,对pH值、总酸、粗蛋白、酸溶蛋白及苯乳酸含量的影响见表5。
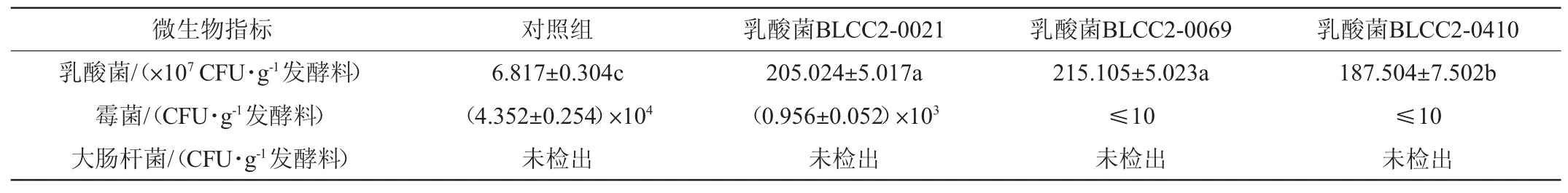
表4 乳酸菌发酵对豆粕微生物指标影响Table 4 Effect of lactic acid bacteria fermentation on microbial indexes of soybean meal
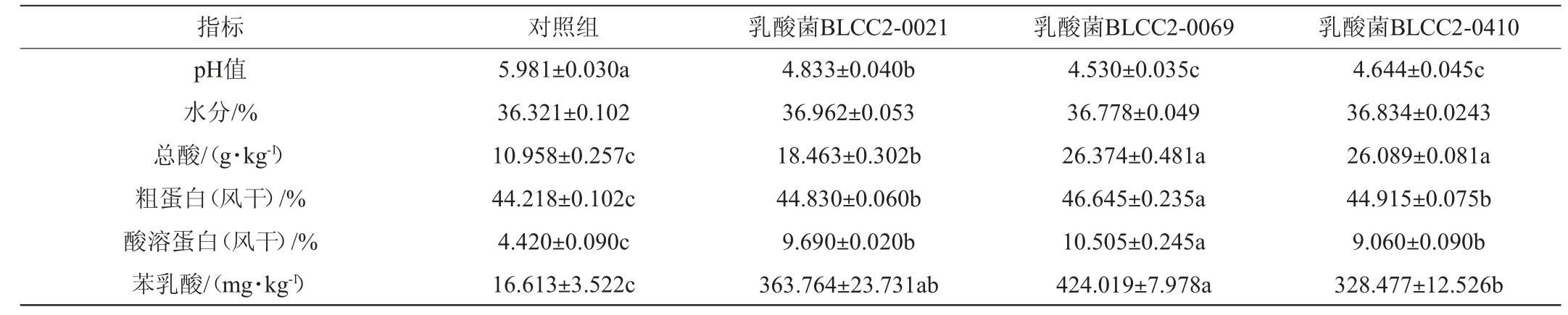
表5 乳酸菌发酵对豆粕理化指标的影响Table 5 Effect of lactic acid bacteria fermentation on physical and chemical indexes of soybean meal
由表4可知,3株乳酸菌发酵72 h后,豆粕中乳酸菌活菌数均>109CFU/g,显著高于对照组(P<0.05);乳酸菌BLCC2-0021发酵豆粕的霉菌活菌数为0.956×103CFU/g,乳酸菌BLCC2-0069和BLCC2-0410两菌株发酵豆粕的霉菌活菌数均≤10 CFU/g,均显著低于对照组(4.352×104CFU/g)(P<0.05),说明乳酸菌BLCC2-0069和BLCC2-0410发酵豆粕具有较好的抑制霉菌生长的作用。大肠杆菌均未检出。
由表5可知,3株乳酸菌发酵72 h后,豆粕的pH值均显著低于对照组(P<0.05),其中乳酸菌BLCC2-0069发酵时pH值最低,为4.530;3株乳酸菌发酵豆粕对水分含量影响无显著性差异(P>0.05);与对照组相比,3株乳酸菌发酵豆粕72 h后均能够显著提高总酸含量、粗蛋白含量和酸溶蛋白含量(P<0.05),且均以乳酸菌BLCC2-0069发酵豆粕时最高,比对照组分别高140.60%、5.489%和137.669%。粗蛋白含量的升高,可能是乳酸菌利用自身氮源代谢产生新的蛋白质;酸溶蛋白的提高则是由于乳酸菌可以产生蛋白酶,将大分子的蛋白分子成小分子的肽。与对照组相比,乳酸菌BLCC2-0021、BLCC2-0069和BLCC2-0410发酵豆粕72 h后均能显著提高苯乳酸含量(P<0.05),分别是对照组的21.90倍、25.52倍和19.77倍,其中以乳酸菌BLCC2-0069发酵时苯乳酸含量最高,为424.019 mg/kg发酵料。结果表明,3株乳酸菌均可以显著提高发酵豆粕中的苯乳酸含量。
豆粕是目前畜牧养殖中使用量很大的一种优质植物性蛋白源,粗蛋白含量高达43%~48%,富含多种氨基酸。利用乳酸菌发酵豆粕,降低发酵豆粕pH值[14],使发酵豆粕具有酸香味,同时富含活性益生菌,乳酸、乙酸和柠檬酸等各种有机酸,增加了饲料的营养性和适口性,促进畜禽采食[25]。在乳酸菌繁殖过程中将豆粕中的非蛋白氮转化成营养价值更高的菌体蛋白,有利于动物的消化吸收,提高豆粕利用率。张佳斌等[26]研究发现,单纯乳酸菌发酵豆粕72 h粗蛋白质量分数为48.6%,有酸香味。王梅等[27]研究发现,复合益生菌发酵剂发酵豆粕能够显著降低pH值,显著提高粗蛋白、酸溶蛋白、总酸和乳酸含量(P<0.05)。
本研究中,植物乳杆菌BLCC2-0069发酵豆粕72 h时pH值为4.530,乳酸菌活菌数>109CFU/g发酵料,且能够显著提高总酸含量、粗蛋白含量和酸溶蛋白(P<0.05),分别比对照组高140.60%、5.489%和137.669%,苯乳酸含量是对照组的25.523倍,改善了发酵豆粕品质。
2.5 植物乳杆菌BLCC2-0069发酵时间对豆粕发酵品质的影响
高产苯乳酸菌株BLCC2-0069发酵时间对豆粕pH值、乳酸菌活菌数、总酸及苯乳酸含量的影响见表6。
由表6可知,pH值方面,发酵1 d和2 d时均以对照组最低,其次是试验组,均显著低于空白组(P<0.05)。发酵至3 d、5 d和7 d时对照组和试验组间pH值差异不显著(P>0.05),降至4.5左右,均显著低于空白组(P<0.05)。

表6 菌株BLCC2-0069发酵对豆粕pH值、乳酸菌、总酸含量和苯乳酸含量的影响Table 6 Effect of strain BLCC2-0069 fermentation on pH value,lactic acid bacteria,total acid content and phenyllactic acid content of soybean meal
乳酸菌活菌数方面,发酵1 d时以对照组最高,乳酸菌活菌数>109CFU/g,试验组活菌数次之,低于对照组一个数量级,但均显著高于空白组(P<0.05),说明菌株BLCC2-0069能够较好地发酵豆粕。发酵2 d时活菌数以对照组最高,试验组活菌数继续增加,和对照组均>109CFU/g。发酵3 d时试验组和对照组活菌数间差异不显著(P>0.05),活菌数均达到最高,均>109CFU/g。之后随发酵时间延长,活菌数均呈现下降趋势,但对照组和试验组间活菌数一致。分析原因可能是试验组由于苯丙酮酸的添加延缓了乳酸菌的发酵,但在3 d时和对照组达到一样的水平。乳酸菌活菌数呈现先升高后降低的趋势,在发酵3 d时活菌数达到最高,这和pH值结果比较一致。发酵5 d后,乳酸菌活菌数出现大量减少,可能是乳酸菌前期生产过程产生氧气、利用了营养物质,在后期造成环境困扰以及营养缺失,抑制其生长。
总酸含量方面,发酵1 d时以对照组最高,显著高于其余两组(P<0.05),试验组总酸含量略高于空白组,差异不显著(P>0.05)。发酵2 d时对照组和试验组总酸含量大幅增加,以对照组最高,显著高于其余两组(P<0.05),试验组总酸含量是发酵1 d时的2.14倍,显著高于空白组(P<0.05)。发酵3 d、4 d和5 d时对照组和试验组总酸含量差异不显著(P>0.05),均显著高于空白组(P<0.05)。总酸含量在发酵前期1~2 d增长较快,其中试验组由于苯丙酮酸的添加延缓了发酵速度,发酵至3 d时总酸含量和对照组处于相同水平。
苯乳酸含量方面,随发酵时间的延长,对照组和试验组苯乳酸含量一直在增加,直至发酵结束(7 d)时达到最高。虽然乳酸菌的活菌数在降低,但是苯乳酸作为一种化学物质不会降低,但会积累。试验组由于添加了苯丙酮酸苯乳酸含量一直显著高于对照组,说明苯丙酮酸的添加有利于苯乳酸的合成,发酵3 d时苯乳酸含量达到429.102 mg/kg发酵料,发酵结束(7 d)时含量为870.903 mg/kg发酵料。
3 结论
利用TLC及HPLC法从10株乳酸菌中筛选到一株高产苯乳酸的植物乳杆菌BLCC2-0069,液体发酵48 h时,苯乳酸含量高达1.435 g/L。其以3 g/L苯丙酮酸为底物发酵48 h时发酵液中苯乳酸含量最高为4.39 g/L。利用该菌株固态发酵豆粕3 d时,乳酸菌活菌数>109CFU/g,霉菌活菌数≤10 CFU/g,大肠杆菌未检出;pH值降至4.5左右,水分、粗蛋白、酸溶蛋白、总酸及苯乳酸含含量分别为36.78%、46.65%、10.51%、26.37 g/kg和424.02 mg/kg,发酵效果显著优于对照组。

