电荷守恒在高中化学解题中的有效应用
黎婷婷
(广西岑溪市第三中学 543200)
众所周知,高中化学习题类型较多.部分习题只有掌握一定的解题技巧,才能进行高效的解答.电荷守恒是一种应用非常广泛的重要解题方法,用于解题中可获得的事半功倍的效果.为使学生更好地掌握这一重要的解题方法,更好地用于解题中,应积极采取措施做好该种方法的应用讲解.
一、在分析化合价中的应用
电荷守恒不仅能够用于配平化学方程式,而且还可计算未知元素的化合价.教学中为使学生学会运用电荷守恒解答相关习题,应注重优选经典例题,在课堂上展示给学生,先要求学生根据自己的理解进行解答,而后与学生一起分析解题过程,使学生对照自身的解题过程,找到解题的不足,把握电荷守恒应用的关键.
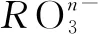
A.+5、5 B.+5、7 C. +4、6 D.+4、7
解答该题需要认真观察离子方程式,运用电荷守恒进行分析,即,-n+6×(-1)+6×1=-1,解得n=1,则R的化合价为+5价.需要注意的是显+5价时R元素并不稳定,显-1价时R的最外层电子数达到稳定结构,因此,R原子的最外层的电子数为7.综上可知,正确选项为B.
二、在求解物质质量中的应用
电荷守恒可用于间接的求解物质的质量.教学中为帮助学生更好地找到解答相关习题的思路,一方面,为学生认真讲解物质的质量与电荷守恒之间的内在联系,结合具体的化学反应,帮助其构建两者之间的关系,在学生头脑中留下深刻的印象,给其解答相关问题带来良好启发.另一方面,为学生讲解代表性较强的习题,尤其详细的板书解题过程,要求学生认真听讲,仔细揣摩,真正的消化吸收.
例2使用稀盐酸溶解铝与过氧化钠的固体混合物.待固体全部溶解后测得溶液中c(Al3+)∶c(H+)∶c(Cl-)=1∶2∶8,则原固体混合物中m(Al)∶m(O)=( ).
A.9∶8 B.9∶16 C.9∶32 D.3∶4
根据已知条件可以判断出稀盐酸的量过量,溶液中的溶质为HCl、AlCl3、NaCl.由电荷守恒可得关系式:3n(Al3+)+n(Na+)+n(H+)=n(Cl-).由已知条件可设Al3+、H+、Cl-的物质的量分别为1mol、2mol、8mol,不难算出Na+的物质的量为8mol-1mol×3-2mol=3mol.则由钠元素守恒可知Na2O2=1.5mol,因此,Al和O元素的质量之比为1mol×27g/mol∶1.5 mol×2×16g/mol=9∶16,正确选项为B.
三、在比较离子浓度大小中的应用
比较离子浓度大小是高中化学学习的重点,是高考必考知识点.为使学生能够正确运用电荷守恒解答比较离子浓度大小习题,既要注重相关例题的讲解,又要注重筛选经典习题,组织学生开展针对性训练活动,使其能够灵活运用电荷守恒构建物质电离、水解等式关系,尤其能够配合使用物料守恒、质子守恒,正确的分析出问题答案.
例3在25℃条件下,向10mL浓度均为0.1mol/L的NH3·H2O和NaOH溶液中添加0.1mol/L的盐酸,则下列关系式正确的是( ).
A.未加盐酸时:
c(OH-)>c(Na+)=c(NH3·H2O)
B.加入10mL盐酸时:
C.加入盐酸至溶液pH=7时:
c(Cl-)=c(Na+)
D.加入20mL盐酸时:
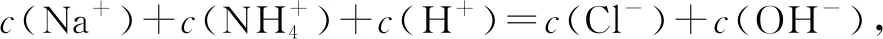
四、在电化学解题中的应用
电化学相关习题对学生分析问题的能力要求较高,既要能够正确判断物质先后放电关系,又要能够灵活运用电荷守恒找到物质放电过程中转移的电子数目,进而顺利地求解出其它参数,因此在学生学习完电化学知识后,应及时为学生讲解相关习题,深化其对电化学知识理解的同时,更好地掌握相关解题思路,不断提高相关习题的解题能力与解题水平.
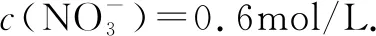
A.原混合溶液中c(K+)为0.2mol/L
B.上述电解过程共转移0.2mol电子
C.电解得到Cu的物质的量为0.05mol
D.电解后溶液中c(H+)为0.2mol/L

电荷守恒是高中化学的重要知识点.为使学生能够灵活应用于解题中,应结合自身教学经验,总结能够运用电荷守恒解题的习题类型,并针对每一种类型选择代表性的习题,为学生进行深入的讲解,使学生吃透电荷守恒的本质,掌握不同题型的解题思路与解题方法,为学生解题能力以及化学成绩的提高奠定坚实基础.

