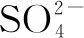离子反应的考点聚焦
张 泉
(浙江省温州中学 325000)
离子反应作为中学化学重要考点之一,有关各类题型出现的频率很高,电解质和非电解质、离子方程式、离子共存都是离子反应的基础知识,在此基础上延伸的考点和题型拓展了离子反应的题型,对这个考点的熟练掌握于学生而言很重要.
一、离子反应的几个重要概念
电解质和非电解质的概念是掌握离子反应的基础,概念中学生容易忽视的点是“化合物”,经常将混合物和单质错当作电解质或者非电解质.
例1 下列物质中,属于电解质的是____,属于非电解质的是____.
①H2SO4②盐酸 ③氯气 ④硫酸钡 ⑤酒精 ⑥铜 ⑦NaHCO3⑧氯化氢 ⑨CO2⑩氨
解析本题目是对电解质和非电解质的考查.学生只要记住酸碱盐、活泼金属氧化物、水这些类别的物质是电解质,绝大多数有机物、非金属氧化物、氨是非电解质,电解质有①④⑦⑧,非电解质有⑤⑨⑩.
例2用下列溶液分别进行小灯泡实验,测定溶液导电性变化,请按照要求选择填空( ).
A.导电性变化不大 B.导电性明显增强
C.导电性明显减弱 D.导电性由强到弱再到强
(1)向AgNO3溶液中通入少量HCl ( ).
(2)向H2SO4溶液中加入Ba(OH)2固体 ( ).
(3)向FeCl2溶液中加入少量NaOH固体 ( ).
解析本题目考查离子反应、电解质溶液导电能力强弱.第(1)题通入少量HCl,银离子换成了氢离子,离子总浓度基本保持不变,溶液导电性变化不大.第(2)题生成了硫酸钡和水,溶液中的离子浓度降低,导电性明显减弱.第(3)题加入少量氢氧化钠,氢氧根离子沉淀了亚铁离子,原来的一个亚铁离子替换成了两个钠离子,电荷的浓度基本保持不变,故导电性变化不大.
二、离子反应和离子方程式的书写
离子反应概念、发生条件和本质意义是理论基础,离子方程式的书写和判断是对离子反应的延伸和题型拓展,离子方程式的判断通常考查的方面有化学式和离子符号的使用、质量守恒和电荷守恒、反应原理、反应物的用量不同反应不同.离子方程式的书写遵循写、拆、删、查,其中强酸、强碱、易溶的盐可拆,学生熟练掌握后可以直接书写.
例3 下列离子方程式不正确的是( ).
A.将Mg3N2溶于足量稀盐酸中:
B.用醋酸除去热水瓶的水垢:

Ca2++2CH3COO-+H2O+CO2↑
C.向NaHCO3溶液中通入少量Cl2:
D.NaHSO4与Ba(OH)2溶液反应至溶液呈中性:
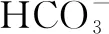
三、常见的离子共存问题

例4 在酸性溶液中,下列各组离子能大量共存且溶液为无色透明的是 ( ).
A.Na+、K+、OH-、Cl-
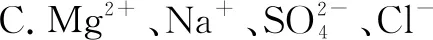
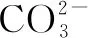
四、离子检验和离子推断
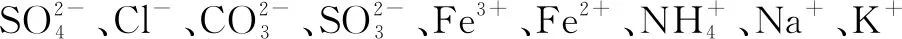
例5下列实验设计能成功的是( ).
A. 用Ba(OH)2溶液鉴别NH4Cl、(NH4)2SO4和K2SO4
B.做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入2滴酚酞溶液,再加入少量水,然后观察并记录实验现象
C. 某溶液中先加过量稀硝酸,再加入AgNO3溶液,有黄色沉淀生成,则证明有I-、无Cl-
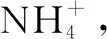
解析选项A用Ba(OH)2溶液鉴别,与NH4Cl反应生成氨,与(NH4)2SO4反应生成氨和白色沉淀硫酸钡,与K2SO4反应生成白色沉淀硫酸钡,故选A.B选项实验顺序错误,应在烧杯中先加水,再加钠块.C选项有黄色沉淀生成表明有I-,但黄色沉淀颜色较深,可能会覆盖白色沉淀,导致Cl-无法判断.D选项采用稀NaOH溶液,产生的氨极易溶,加热也很难逸出.
离子推断时可遵循:
1.根据实验现象推出溶液中肯定存在或不存在的离子,记住常见有色离子.
2.肯定某些离子的同时,结合离子共存的规律,及时否定一些离子的存在,注意题目中的隐含条件,如酸性、碱性、指示剂的变化等.
3.溶液呈电中性,一定既有阳离子又有阴离子,且溶液中正电荷的总数一定等于负电荷总数,这能确定一些隐含的离子.
4.要注意反应生成的离子或引入的离子对后续实验的干扰.
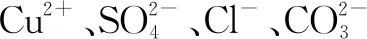
①向溶液中滴加Ba(OH)2溶液,过滤,得到不溶于酸的白色沉淀和绿色滤液B;
②取滤液B,先用HNO3酸化,再滴加0.001 mol·L-1AgNO3溶液,有白色沉淀生成.
下列说法不正确的是( ).
C.第②步生成的白色沉淀中只有AgCl,没有Ag2CO3
D.溶液A中存在Fe2+与Cu2+中的一种或两种,且可以用NaOH溶液判断