Ox-LDL刺激人外周血单个核细胞来源巨噬细胞RvD2的合成
唐 欣, 王修哲, 赵玉武
脂质代谢失衡和动脉壁中富含胆固醇结晶的巨噬细胞聚集是动脉粥样硬化斑块的重要病理过程,动脉粥样硬化是一种慢性炎症性疾病[1]。动脉粥样硬化斑块引起的血管狭窄,或者由于斑块不稳定导致斑块脱落,会导致急性缺血性脑卒中的发生[2]。因此,动脉粥样硬化的发生发展机制研究对于脑梗死的预防具有十分重大的意义。
特化促消退介质(specialized pro-resolving mediators,SPMs),是一类小分子脂质物质,在体内发挥促进炎症消退、组织修复、血管再生等功能[3]。消退素D2(RvD2)是由5-LOX和15-LOX催化DHA所合成的一种SPM,与其受体GPR18结合后激活信号通路,发挥生物学作用[4]。研究发现,RvD2对动脉粥样硬化斑块[5]和脑梗死动物模型均具有保护作用[6]。但是,目前氧化低密度脂蛋白(ox-LDL)对脑梗死患者巨噬细胞RvD2代谢的作用尚不明确。
本研究利用ox-LDL刺激脑梗死患者的巨噬细胞,与健康对照组比较,观察RvD2的合成代谢情况并探索其机制,为进一步探索RvD2在动脉粥样硬化斑块型脑梗死中的作用及机制提供依据。
三十三天为额尔和木·哈日求情之后,又给他出谋划策,告诉他如何战胜哈冉惠,而哈冉惠放过额尔和木·哈日之后,说出了这样的话:
1 材料与方法
1.1 研究人群和人群数据 从上海交通大学附属第六人民医院神经内科住院患者中选取急性缺血性脑卒中患者12例,并选取5例无神经系统疾患的健康志愿者(对照组)。所有入组的患者或志愿者入选前一个月内均无急性系统性炎症,并严格排除包括昏迷、严重心脏、肝肾功能不全、精神疾病、其他内分泌疾病、肿瘤、自身免疫性疾病、纤溶性溶栓等情况。所有急性缺血性脑卒中患者均以《中国急性缺血性脑卒中诊疗指南2014年》作为诊断标准,通过计算机断层扫描(CT)或磁共振成像(MRI)确诊。本研究已获得上海交通大学附属第六人民医院伦理委员会批准。所有参与者均签署知情同意书。本研究收录包括年龄、性别、吸烟、饮酒史、高危病史(高血压、冠状动脉粥样硬化性心脏病、房颤)等基本资料,并采集糖化血红蛋白(HbA1c)、空腹血糖(FBG)、总甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、白细胞计数(WBC)、中性粒细胞计数等常规生化检查数据。
1.2 主要试剂及仪器 RIPA裂解液、BCA 蛋白定量试剂盒(BCA Protein Quantitation Kit,中国)、和超敏ECL化学发光试剂盒(碧云天生物科技有限公司,中国),蛋白酶抑制剂(Roche)。RvD2 ELISA 试剂盒,5-LOX 多克隆抗体(Cayman Chemical Company,美国);GPR18单克隆抗体,15-lox多克隆抗体(abcam,美国);1640培养基,胎牛血清(FBS)(hyclone,美国);Ficoll淋巴细胞分离液(GE health,美国);ox-LDL(thermofisher,美国);M-CSF(Peprotech);凝胶成像系统、多功能酶标仪和Western blot设备(Bio-Rad,美国);荧光定量PCR仪(Prism 7500,美国)。
1.3 巨噬细胞培养和细胞实验分组 抽取人外周血约10 ml,用PBS稀释后加入Ficoll分离液,以600 g,20 min离心分离外周血单个核细胞(PBMC)。1640培养基重悬PBMC后,加入培养板中,待1 h后细胞贴壁,弃去上清,加入新鲜的含10% FBS以及M-CSF(50 ng·ml-1)的1640完全培养基,每2~3 d换液,培养6~7 d后,细胞即分化为成熟的巨噬细胞。将每个健康对照及脑梗死患者的巨噬细胞随机分为空白对照组,ox-LDL(10 μg·ml-1)刺激组,培养24 h后,分别收集细胞培养上清及蛋白。
2.3 ox-LDL对巨噬细胞中RvD2合成酶及受体表达的影响 利用Western blot法检测蛋白表达水平,比较巨噬细胞在ox-LDL刺激前后,RvD2合成关键酶5-LOX、15-LOX及其受体GPR18的表达水平。结果表明,15-LOX在ox-LDL刺激后,表达显著升高(P<0.05),而5-LOX的表达量在刺激前后无明显差异。另一方面,RvD2受体GPR18的表达在ox-LDL刺激后也升高了(P<0.05)(见图2)。
如图2所示,触发脉冲编号表示触发的换流阀编号。在一个周期内,换流阀以锁相环过零点时刻所对应的电角度为基础滞后触发指令角α,每隔60°发出触发脉冲信号,由于不对称情况下锁相环无法跟踪实际的同步初相位,产生触发脉冲时换流阀两极电压可能为负,换流阀滞后导通。以ca换相为例,详细分析换流阀延迟导通及关断的情况,vca和分别表示锁相环输出的同步电压和实际换相线电压,σca为不对称情况下滞后于vca的电角度,φab0、φbc0、φca0为各换相线电压过零时刻对应的电角度。
中国始终奉行独立自主的和平外交政策、防御性国防政策和积极防御军事战略,无论国防费投入多少,国防和军队现代化发展到什么程度,都永远不称霸、永远不扩张、永远不搞军备竞赛,也永远不对任何国家构成威胁。中国军事力量是履行新时代使命任务的坚定力量,是维护地区与世界和平稳定的强大正能量。
2.1 临床基线资料比较 脑梗死组与健康对照组在年龄、性别、抽烟、饮酒史以及高血压、冠状动脉粥样硬化性心脏病、房颤、糖尿病等高危因素中,均无统计学差异(见表1)。生化实验室检查,包括糖化血红蛋白(HbA1c)、空腹血糖、总甘油三酯、总胆固醇、低密度脂蛋白(LDL)、白细胞计数、中性粒细胞计数等在脑梗死组与健康对照组间均不存在统计学差异(见表2)。
1.4.2 Western blot 免疫印迹法 配制SDS-PAGE凝胶,向加样孔内加入10 μl蛋白样品,60V电泳40 min,再120 V 电泳1.5 h 左右,将不同分子量的蛋白分离。用甲醇浸泡活化PVDF膜,300 mA 转膜100 min。再用加入5%脱脂牛奶室温封闭1 h,分别用β-actin(1∶3000)、15-LOX(1∶1000)、5-LOX(1∶1000)和GPR18(1∶1000)稀释后覆盖膜,4 ℃摇床孵育过夜,第2天用TBST洗膜10 min,× 3 次,加入辣根过氧化物酶偶联的相对应的二抗(1∶5000)室温孵育1 h,TBST 洗膜10 min,× 3 次。最后,用Super Signal ECL荧光显示剂显影,凝胶成像仪拍摄,Image J 软件定量分析蛋白表达高低。
1.5 油红染色检测巨噬细胞泡沫化程度 将24孔板中细胞培养基去掉,PBS洗3遍,向细胞加入4%PFA室温固定20 min,再用PBS洗3遍,加入60%异丙醇浸洗5 min,弃去60%异丙醇后加入新配制好的0.5%油红染液(ORO),60 ℃浸染10 min。弃去染色液,再加60%异丙醇分化1 min,弃去异丙醇,PBS洗2~5次,直到无多余染液。将爬有细胞的盖玻片取出,置于载玻片上,用甘油封片,显微镜下拍照。
1.4 Western blot 免疫印迹法检测蛋白表达
2.2 ox-LDL对巨噬细胞RvD2合成代谢的影响 RvD2 ELISA结果表明,与空白对照相比,即ox-LDL刺激前,巨噬细胞经ox-LDL刺激24 h后,细胞培养上清中RvD2的浓度显著升高(P<0.001)(见图1)。

在悬浮控制器内部控制电路中,主要控制信号采用冗余设计。间隙信号采用 3 路并行信号处理和滤波电路,加速度信号采用 2 路并行信号处理和滤波电路,电流信号采用 2 路并行信号处理和滤波电路。当其中的1路信号发生故障或错误时,不会影响其它电路。采用冗余和容错处理后,提高了系统的可靠性,使系统的可靠性指标得到很大改善。
2 结 果
1.4.1 蛋白样品制备 细胞分别经ox-LDL处理及空白处理24 h,每孔加入PBS 1 ml 洗3 次,用细胞刮收取各组细胞至1.5 ml 离心管中,4 ℃,400 g离心5 min后,去掉上清,加入蛋白裂解液100 μl,冰上裂解15 min,4 ℃,12 000 r·min-1离心5 min,留取上清,即为蛋白样品。各蛋白样本均进行BCA 法蛋白定量检测,根据标准曲线计算出各蛋白样品浓度,并将其统一稀释至2 μg·μl-1。向蛋白样品中加入上样缓冲液后,金属浴加热5 min,促使蛋白充分变性。
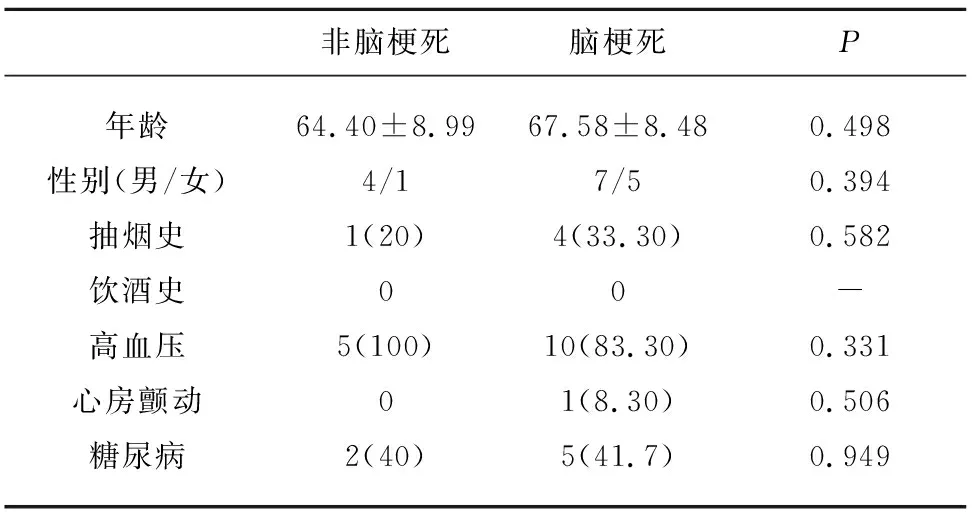
表1 脑梗死患者组与非脑梗死健康对照组患者基本特征
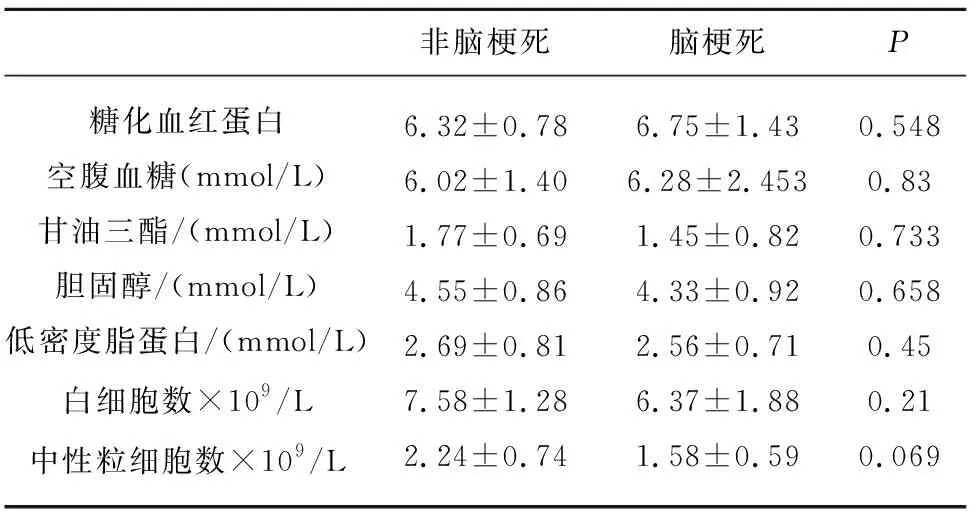
表2 脑梗死患者组与非脑梗死健康对照组实验室检查
1.6 酶联免疫吸附法检测RvD2水平 将收集好的细胞培养上清暂时保存于-80 ℃,待所有样本收集完整。本实验严格按照厂家说明书操作。简单来说,将细胞培养上清从冰箱取出,避免反复冻融。将RvD2 标准品梯度稀释,制备成不同浓度的标准品后,将标准品和样品分别加入对应孔中。再加入各反应试剂,4 ℃孵育18 h。第2天,洗板后,加入反应液孵育90~120 min,读取OD值,根据标准曲线计算出每个样本的RvD2浓度。

注:与control组比,ox-LDL刺激组,巨噬细胞合成RvD2增多***P<0.001
2016年,丹麦环境和食品部部长曾强烈要求欧盟委员会在欧洲范围内禁止塑料微珠用于化妆品中[11]。他认为,必须限制塑料微珠的适用范围以确保其最终不存在于水生环境和食物链中。丹麦环境部称,来源于化妆品并排放到水生环境的塑料微珠全国占0.1%,这些直径微小的颗粒可能会流入污水处理厂,继而流入欧洲水域。还认为在化妆品中不需要使用塑料微粒,尤其是存在可用替代物质(如可生物降解的杏仁)的情况下。
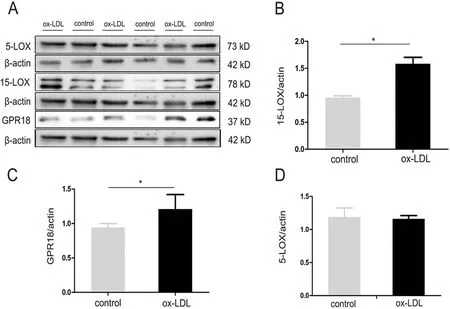
注:A: 5-LOX、15-LOX、GPRR18在control与ox-LDL刺激组间的Western blot 结果;B~D:与control组比,ox-LDL刺激组,巨噬细胞15-LOX及GPR18表达上调,5-LOX表达无差异*P<0.05
2.4 脑梗死患者巨噬细胞合成RvD2的功能异常 RvD2的 ELISA结果表明,将ox-LDL刺激后分泌的RvD2与空白对照组做差值分析,脑梗死组的巨噬细胞分泌的RvD2增高的绝对值较健康对照组低(P<0.05)(见图3)。

注:脑梗死组RvD2升高的绝对值较健康对照组低*P<0.05;H:健康对照组;CI:脑梗死组
2.5 巨噬细胞泡沫化的程度 油红染色显示巨噬细胞泡沫化程度。染色结果显示,在ox-LDL刺激后,无论健康对照组或脑梗死组,含红色脂滴的巨噬细胞均明显增多。此外,脑梗死组相对于健康对照组红色脂滴更多,泡沫化程度更严重(见图4)。
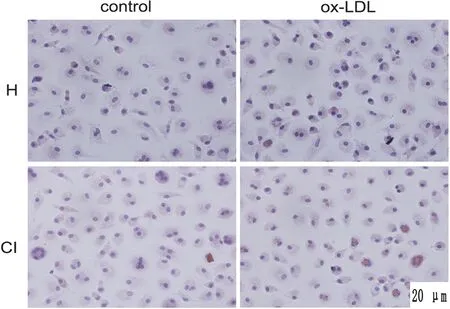
注:与control组相比,ox-LDL组红色空泡性脂滴明显增多;而脑梗死组与健康对照组相比,巨噬细胞胞体内红色脂滴更多。H:健康对照组;CI:脑梗死组
3 讨 论
大量研究发现,炎症反应是动脉粥样硬化斑块的发生发展一个重要机制。本研究从炎症消退的角度,发现了脑梗死患者的巨噬细胞在ox-LDL诱导的炎症反应模型中,RvD2合成障碍。
贵州人爱吃酸汤鱼火锅,贵州的酸汤是用清米汤或糟辣椒发酵而成的,带着浑厚的自然酸香。独特的汤底,酸有酸的突出,辣有辣的讲究,现宰的新鲜活鱼煮在酸汤里,味道真的美极了!再加上糅合了湘西“蘸水”和川渝油碟的风味蘸酱,感觉一碗汤能干掉一锅饭!
研究发现,血液循环中过多的ox-LDL可造成巨噬细胞氧化应激损伤,发生炎症反应,释放如IL-1等炎症因子,导致巨噬细胞泡沫化,形成粥样硬化斑块[1,7]。巨噬细胞是机体产生RvD2的主要细胞之一[8],生成的RvD2也可以与巨噬细胞受体结合,促使巨噬细胞向Ly6Clow的抗炎亚型转化,促进炎症消退。Ly6Clow的巨噬细胞能够产生更多RvD2,这可能是机体在炎症反应过程中的一种主动的保护性反应[9]。RvD2还能够提高人巨噬细胞对凋亡坏死细胞的吞噬清除能力[10]。RvD2能够抑制巨噬细胞炎症因子的释放诱导巨噬细胞向抗炎亚型M2转化[11]。巨噬细胞产生的RvD2还能促进血管内皮细胞的迁移、减少中性粒细胞浸润等,从而保护血管[12]。在本研究中,ox-LDL刺激巨噬细胞24 h后,RvD2的合成水平升高了,这可能是巨噬细胞的主动保护性反应。生成的RvD2可以促进巨噬细胞向抗炎亚型M2转化,增强巨噬细胞的吞噬功能,以提高对ox-LDL的处理转化能力,减轻脂质超载以及巨噬细胞泡沫化,抑制动脉粥样硬化斑块的形成。此外,ox-LDL刺激引起巨噬细胞15-LOX表达上调,促进RvD2的合成,这与其他炎症相关性研究中结果的相一致[13]。本研究还发现,ox-LDL刺激后,巨噬细胞GPR18表达上调。GPR18是RvD2的特异性受体,在RvD2增强巨噬细胞吞噬功能[14]及促进巨噬细胞类型转化的过程当中也是必不可少的[15]。这些结果提示,ox-LDL刺激巨噬细胞合成RvD2,是一种巨噬细胞自身的主动保护性反应。但是,本研究发现,脑梗死患者巨噬细胞在ox-LDL刺激后产生RvD2浓度的绝对值,比健康对照组的巨噬细胞低,并且相对应的,脑梗死组患者巨噬细胞泡沫化程度也更严重。这提示我们,脑梗死患者的巨噬细胞对ox-LDL后刺激保护性合成RvD2的能力存在缺陷。这可能是脑梗死患者动脉粥样硬化斑块不稳定和过度的炎症反应的重要原因之一。
总的来说,本研究发现,ox-LDL促进巨噬细胞保护性合成RvD2增多,可能是通过提高15-LOX的表达水平来促进的RvD2合成。此外,ox-LDL刺激后,脑梗死患者的巨噬细胞合成RvD2的能力是下降的,提示脑梗死患者巨噬细胞的促炎症消退功能可能存在缺陷,这可能是动脉粥样硬化斑块和脑梗死发生发展的重要机制之一。但是,外源性给予RvD2治疗是否能够通过调控巨噬细胞炎症消退功能,从而对动脉粥样硬化斑块或脑梗死产生保护作用仍有待进一步的研究。

