利用GFP标记研究秸秆还田对假单胞菌PW9土壤定殖能力的影响
吴红艳,于 淼,冯 健,冯 敏
(辽宁省微生物科学研究院,辽宁 朝阳 122000)
【研究意义】土壤是农业可持续发展的物质基础,是作物生长的重要营养源泉,磷是植物生长必需的营养元素之一,磷的缺乏会影响植物光合作用、呼吸作用及生物合成过程,导致植物发生形态和生理上的变化。自然界中磷矿资源非常有限,土壤矿物通常对磷素具有强烈的固定和吸附作用,使土壤中95%以上的磷成为无效态,导致土壤磷素的植物有效利用率普遍较低。因此,利用生物技术手段,通过选育溶磷微生物来提高土壤磷的植物有效性成为刻不容缓的一个研究主题[1]。秸秆还田能够增加土壤有机质及养分,提高土壤综合效应,是当今普遍重视的一项培肥地力最终达到增产目的的有效措施。然而在秸秆还田的同时也会将秸秆中携带的多种微生物带入土壤中,同时也可能会使土壤的理化性质等指标发生改变[2]。经过大量研究表明,溶磷微生物施入土壤后在生存过程中会受到土著微生物群系和外来微生物等诸多因素的影响[3]。因此,提高溶磷微生物在土壤中的定殖能力尤为重要。【前人研究进展】外源菌施入土壤后,用传统的方法或抗生素标记法都不易将其与同类的土著微生物区分开,不易对其土壤和环境行为进行直观、快速、高效的检测,对靶标的作用等行为的动态研究成为盲区。因而,标记基因技术的建立与发展,为微生物定殖的微生态学研究提供了有效手段[4-5]。绿色荧光蛋白(Green Fluorescent Protein,GFP)最早于1962年在维多利亚多管水母中被发现,1994年首次在大肠杆菌细胞和线虫中被表达。由于其荧光性能稳定、检测方便、灵敏度高且表达不受种属限制等特性,越来越为人们重视。磷细菌PW9是由辽宁省微生物科学研究自行分离筛选的菌种,初步鉴定为假单胞菌(Pseudomonas),田间试验结果表明施用磷细菌PW9可大幅度增加作物产量。【本研究切入点】本研究利用绿色荧光标记系统与传统的微生物群落分析技术相结合的方法,研究秸秆还田对假单胞菌PW9定殖能力的影响。【拟解决的关键问题】此结果将为解磷菌合理施用及微生物菌肥与秸秆还田协同作用的深入研究奠定了一定的理论基础。
1 材料与方法
1.1 供试材料
菌株与质粒:假单胞菌PW9为短杆菌,革兰氏阴性,由本研究室从番茄植株根系土壤中分离;质粒pBBR1MCS2-Tac-EGFP具有卡那霉素抗性,目的基因片段大小为789 bp,由淼灵质粒平台提供(图1)。
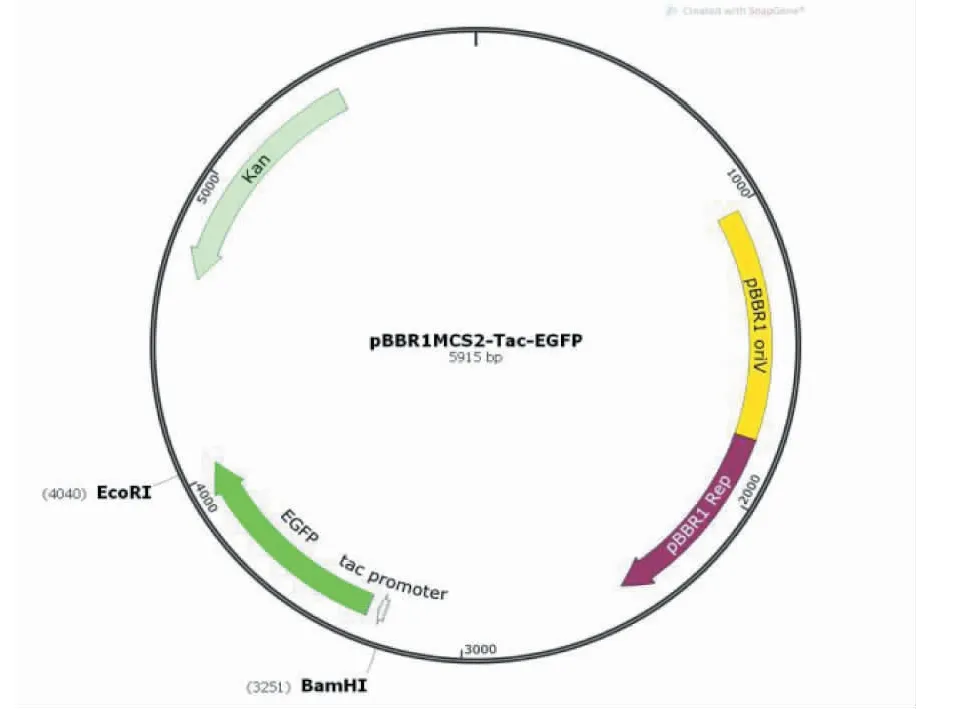
图1 质粒pBBR1MCS2-Tac-EGFP
仪器设备:Eporator电转仪,HZQ-Q全温振荡器(哈尔滨东联电子技术开发有限公司),ZQ中器生化培养箱,SiGMA 3K15高速低温冷冻离心机,ZF1-Ⅱ型紫外透射反射分析仪(上海嘉鹏科技有限公司)。培养基与培养条件:DH5α与假单胞菌PW9菌株均采用LB培养基,分别于37和30 ℃下培养。在对菌株进行解磷能力测试时使用PVK培养基30 ℃下培养。抗生素及使用浓度:卡那霉素(Kan)为50 μg/mL。
1.2 试验方法
1.2.1 质粒pBBR1MCS2-Tac-EGFP提取及检测 参照分子克隆中质粒的小量制备——SDS碱裂解法。
1.2.2 出发菌株WP9感受态细胞的制备 灭菌牙签挑取单菌落于LB中,30 ℃培养至OD600接近于0.4时收集培养液冰浴1 h,10 000 r/min离心5 min,收集菌体加入预冷的ddH2O洗涤菌体,重复此步骤3次,将感受态细胞溶解于10%(V/V)甘油中并分装,-70 ℃保存备用。
1.2.3 电转化 取感受态细胞100 μL 与电击杯一起放在冰上冷却,加入5 μL质粒置于冰上60 s,调节电转仪电压为2.5 KV进行电击转化[6],于转化后细胞加入1 mL LB液体培养基转移至Ep中,37 ℃轻柔振荡1 h,转移至含有浓度为50 μg/mL卡那霉素(Kan)的抗生素平板,30 ℃恒温培养。
1.2.4 转化子的筛选鉴定 将1.2.3获得的抗生素平板上生长的转化子,无菌牙签挑取后接入含有卡那霉素的LB液体培养基中,30 ℃ 200 r/min振荡培养24 h,培养液提取质粒并进行酶切鉴定(表1)。
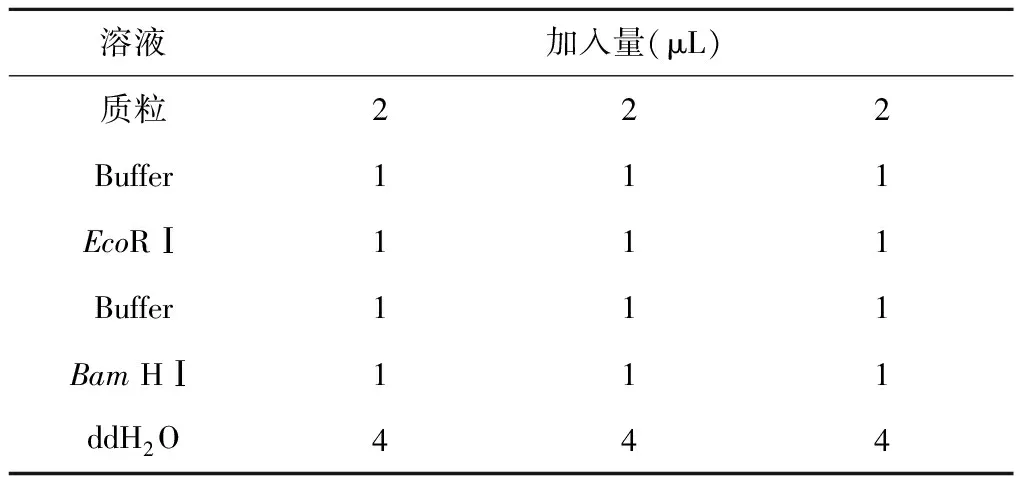
表1 质粒酶切体系
1.2.5 标记菌株解磷能力测试 利用钼锑抗比色法对出发菌株和标记菌株进行解磷能力测试。分别将其活化后按1%接种量接入PVK液体培养基中30 ℃培养7 d,每天取样1次进行解磷能力测试,并比较分析。
1.2.6 质粒荧光检测与稳定性考察 荧光检测:利用紫外分析仪365 nm反射光对菌落绿色荧光进行观察。质粒稳定性考察:挑取标记菌株PW9-gfp单菌落接种于无抗生素(卡那霉素)LB液体培养基中活化过夜,按0.1% 接种量接种于无抗生素的液体LB培养基中,30 ℃ 200 r/min振荡培养5 h,再取样以相同接种量,培养条件相同,如此重复培养50 h,涂布无抗生素LB平板上,30 ℃恒温培养48 h,然后随机选取300个克隆转入含50 μg/mL卡那霉素的LB平板上,30 ℃ 培养72 h,观察菌落生长情况,以抗性菌株所占百分比来计算菌株质粒的遗传稳定性。
1.2.7 标记菌株PW9-gfp在土壤中的定殖能力研究 选择大田土壤,过10目筛,pH7.3,速效P为15 mg/L。试验设计为无秸秆粉只接入PW9-gfp,加入秸秆粉并接入PW9-gfp 2个处理。每个处理称取500 g土壤于小花盆中,栽入番茄苗,浇水100 mL水,定殖1周时按1%接菌量接入PW9-gfp菌悬液,各处理3次重复,每隔10 d取样1次(取样方法:去除表层1 cm土壤及杂质,取植株根际土壤作为试验样品,试验结果取每个处理3次重复的平均值),按照平板稀释涂布法,涂布于含50 μg/mL卡那霉素(Kan)的LB平板上,30 ℃恒温培养72 h后记录绿色荧光菌落数。
2 结果与分析
2.1 标记菌株的构建及质粒酶切检测
由图2可以看出,标记菌株1、2、3号中提取的质粒均与已知质粒pBBR1MCS2-Tac-EGFP的位置相同,6、7号出发菌株在同样位置无质粒存在;3株标记菌株经过双酶切后在大于750 bp小于1 kb的位置出现小片段(图3),即为已知克隆的gfp基因片段,由此可见,质粒pBBR1MCS2-Tac-EGFP已被成功转化至菌株PW9中,即PW9-gfp。
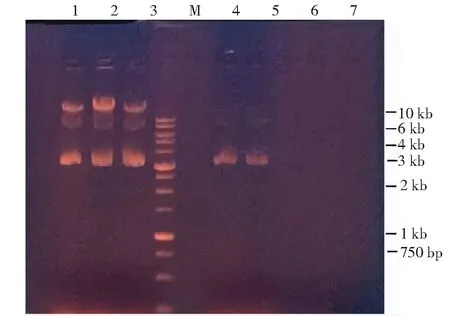
1、2、3号为PW9-gfp;4、5号为pBBR1MCS2-Tac-EGFP;6、7号为PW9;M为标准RealBand 10 kb DNA

1、2、3为PW9-gfp质粒;1-1、2-1、3-1为PW9-gfp质粒酶切样品;M为标准Real Band 10 kb DNA
2.2 标记菌株与出发菌株解磷能力测试
图4可以看出,出发菌株和3株标记菌株培养液中有效磷含量在培养第4,5天 最高,之后平稳下降[7-8],出发菌株在第4天时最高达到352.3 mg/L,标记菌株1号在第4天时达到最高,达到360.9 mg/L,标记菌株2号在第4天达到最高为325.8 mg/L,标记菌株3号在第5天达到最高为332.7 mg/L。因而,由于3株标记菌株中1号有效磷含量相对较高,达到最高点的时间相对较短,说明分解不溶性磷的能力相对较强,因而,选择1号标记菌株作为定殖能力相关研究的试验菌株。

图4 出发菌株与标记菌株培养液中有效磷含量
2.3 标记菌株PW9-gfp菌落荧光检测
由图5可以看出,由于质粒pBBR1MCS2-Tac-EGFP转化至假单胞菌PW9后,在含有50 μg/mL卡那霉素的LB平板上置30 ℃恒温培养72 h时显现强烈的表达效果,可以清楚观察到绿色荧光蛋白的显著特征。
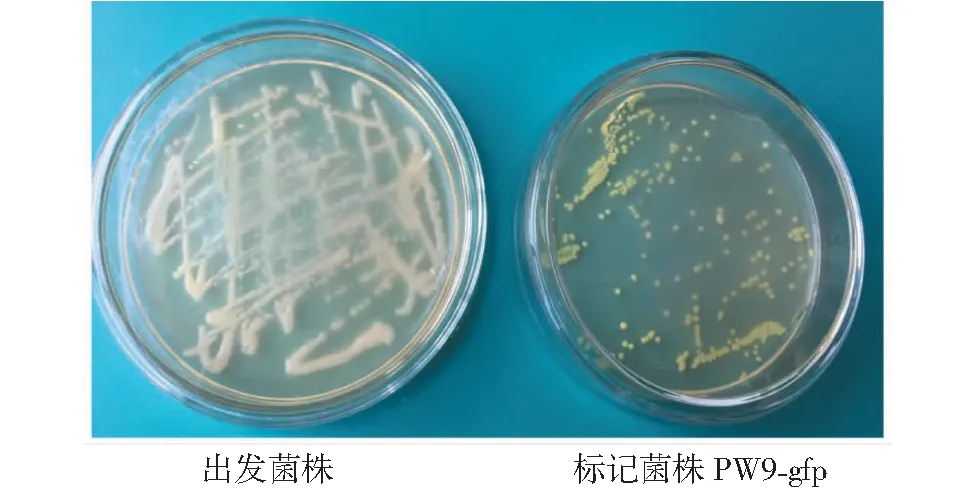
图5 标记菌株PW9-gfp菌落荧光检测
2.4 标记菌株PW9-gfp质粒稳定性研究
由图6可以看出,随着菌落生长代数的增加质粒稳定性下降。在菌株生长5 h时稳定性为100%,10 h时稳定性为99.8%,直到50 h时稳定性仍然高达91.2%。研究表明,一般实验室条件下杆菌分裂一代需要20~30 min,在土壤中分裂一代需要时间为50~100 h[9],以此计算标记菌株PW9-gfp质粒至少在120 d内稳定,完全可以用于后续研究。

图6 标记菌株PW9-gfp质粒稳定性
2.5 标记菌株PW9-gfp在土壤中的定殖能力
由图7可以看出,标记菌株PW9-gfp单独施入和秸秆同时施入的土壤样品中有效菌落数量1 g(cfu/g)随着作物生长时间的增加逐渐减少,两者在10 d到20 d之间下降幅度较小,20 d的时候开始急速下降,在作物生长60 d过程中两者均由初始1.1×109降至十位数,分析减少的的原因,可能是由于试验使用的是大田土壤,土壤中丰富的土著微生物群落定殖和生长更具有优势,所以在一定时间内会影响到外界施入的标记菌株PW9-gfp竞争力。另外,从两个处理的0~60 d之间菌落数量总体趋势看,有秸秆施入的土壤样品有效菌落数量均略高于无秸秆施入的土壤样品。分析原因,秸秆施入后土壤的组成如有机质、菌群等成分有一定的改变,以至于对标记菌株PW9-gfp菌落生长速度会有一定的积极作用。且标记菌株PW9-gfp是施于植物根部的,与植物根系之间具有相互作用的关系,微生物在根际土壤定殖是个十分复杂的过程,会受到很多因素的影响,因而,秸秆还田是否对菌株PW9的土壤定殖能力具有一定的促进作用,其作用机理有待进一步研究。

图7 标记菌株PW9-gfp在土壤中的定殖能力测试
3 讨 论
秸秆还田是当今世界上普遍重视的一项培肥地力的增产措施,不仅杜绝了秸秆焚烧时所造成的空气污染,还可以改善土壤结构和土壤环境,促进微生物活力和作物根系的发育,改良土壤,最终达到增产增收目的,因而受到国内外众多学者的普遍关注。绿色荧光蛋白(green fluorescent protein),简称GFP最早是由下村修等人在1962年在维多利亚多管发光水母(Aequoreavictoria)中发现,其基因所产生的蛋白质,在蓝色波长范围的光线激发下,会发出绿色荧光[10-11],可用长波紫外灯甚至肉眼简单、直接、方便地对标记体进行定性检测,不受环境与基因表达与否的限制,多态性高,具有良好的遗传稳定性,目前成为研究热点。
4 结 论
本研究利用GFP标记系统对解磷菌PW9进行了标记并对其标记后质粒稳定性进行了研究,结果表明质粒在土壤中至少120 d内是稳定的。将标记菌株PW9-gfp与秸秆同时施入土壤,通过测试植株根际土壤有效菌群的数量并分析,结果表明,在施入标记菌株PW9-gfp 10~20 d时有效菌落数量为最高,此时定殖能力为最强,保持一段时间后开始下降,但仍然可以定殖,说明标记菌株PW9-gfp可以作为研究解磷菌PW9定殖能力的材料。而标记菌株PW9-gfp与秸秆粉一起施入的土壤样品,有效菌群数量在不同取样时间均略高于单独施入处理,表明秸秆施入的行为对于解磷菌PW9的定殖能力有一定的促进作用,分析原因,可能是由于秸秆中含有丰富的有机质、纤维素、糖类等营养成分并携带种类繁多的微生物与同时施入的解磷菌PW9-gfp相互协同作用,达到了增强其定殖能力的效果[12],其作用机制还需进一步研究,这一结果为今后解磷菌合理施用及微生物菌肥与秸秆还田协同作用的深入研究奠定了一定的理论基础。
——一道江苏高考题的奥秘解读和拓展

