轻链沉积病合并肾脏损害的临床特点及预后分析
田秀娟,何 娟,柳红昌
(西京医院:1.肾脏内科;2.麻醉科,西安 710032)
轻链沉积病(LCDD)是单克隆免疫球蛋白轻链产生过多并沉积在细胞外引起的系统性疾病。自 RANDALL于1976年报道以来,不断有病例发现,国内也有少数病例报道。其特征为非淀粉样免疫球蛋白轻链颗粒样沉积,单链轻链主要为κ型(92%),大多数属于ⅤκⅣ亚组,通过疏水侧链和糖基化位点,导致轻链沉积及与基质相互作用,刚果红染色为阴性[1-2]。有研究显示,LCDD患者被诊断时中位年龄为58岁,男女比例为2.5∶1.0,约65%与多发性骨髓瘤有关,3%与其他淋巴增生性疾病(慢性淋巴细胞白血病)有关,32%是特发性的[3-4]。
免疫球蛋白轻链(LC)经肾小球滤过,通过受体介导的内吞作用在近端肾小管重吸收;肾脏是LC沉积的主要靶器官,其次为肝脏、心脏、皮肤、神经系统等[5-7]。本病常表现为肾病范围蛋白尿、镜下血尿、高血压和肾功能不全,罕见合并孤立性肾小管间质性肾炎[8]。特征性病理学特点包括光镜下结节性肾小球硬化、免疫荧光下肾小管基底膜(TBM)和肾小球基底膜(GBM)弥漫性单一轻链染色,而电子显微镜下则可检测到TBM和GBM中非纤维丝“粉末状”沉积物[9]。
LCDD患者如果不进行治疗,最终会在数月到数年进展至终末期肾病(ESRD),病死率明显增加。治疗LCDD的主要方法是控制潜在的单克隆血浆细胞克隆,改善肾功能。积极的治疗可以阻止甚至逆转肾功能的恶化,深度的血液学反应与肾脏结果的改善明显相关。本文探讨轻链沉积病合并肾脏损害的临床特点及预后分析,现将结果报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2015-2020年在西京医院诊断为LCDD患者的临床资料。诊断标准:(1)肾组织刚果红染色阴性;(2)免疫荧光显示单克隆轻链沿肾小管基底膜外侧和(或)肾小球内侧沉积;(3)在电子显微镜下出现相应的点状、“粉末状”电子致密沉积物。
1.2 方法
1.2.1临床检查
所有患者在初次登记时进行全血计数、血液化学分析,以及标准的多发性骨髓瘤相关血清学和尿液检测,以确定血清存在的单克隆蛋白的性质。组织活检包括肾穿刺活检术、骨髓穿刺活检术。收集为24 h尿液测量蛋白尿。肾病范围蛋白尿定义为24 h蛋白尿≥3.5 g。肾小球滤过率(GFR)采用改良肾病饮食(MDRD)公式估算。在患者开始治疗前,进行常规心电图、腹部超声及心脏超声检查。
1.2.2治疗方案
BD方案:35 d为1个疗程,用4周,停1周,硼替佐米(1.3 mg/体表面积,皮下注射1次/周)+地塞米松(40 mg/d,第1、8、15、22日,口服)。CTDa方案:28 d为1个疗程,环磷酰胺(500 mg,第1、8、15日静脉滴注)+沙利度胺(200 mg/d,口服)+地塞米松(20 mg/d,第1~4、15~18日口服)。
1.2.3疾病定义
(1)血液学反应:参照原发性轻链型淀粉样变的血液学疗效标准。完全缓解(CR),血清游离轻链水平及比值正常,血清免疫固定电泳阴性;非常好的部分缓解(VGPR);血轻链差值(dFLC)下降到≤40 mg/L;部分缓解(PR),dFLC下降超过50%;无反应(NR),缓解未达以上标准者。(2)肾脏反应:完全缓解(CR),尿蛋白定量下降>50%,且≤0.5 g/24 h,Scr水平稳定或升高≤20%;部分缓解(PR),尿蛋白定量下降>50%且≤2 g/24 h,Scr水平稳定或升高≤20%;无反应(NR),缓解未满足以上标准。
1.3 统计学处理

2 结 果
2.1 患者基本情况及浆细胞克隆特征
2015-2019年共诊断LCDD患者13例。 患者年龄53.77(36.00~68.00)岁,男女比例为3.3∶1.0,69.2%(9/13)合并具有肾脏意义的单克隆免疫球蛋白病(MGRS),30.8%(4/13)合并多发性骨髓瘤(MM)。
2.2 临床特征
12例患者24 h尿蛋白定量均大于0.5 g,其中6例(46.1%)为肾病范围蛋白尿;8例(61.5%)骨髓出现镜下血尿;11例(84.6%)骨髓血压升高;10例(76.9%)骨髓起病时表现为肾功能不全,Scr值为303(88~1 062)μmol/L,eGFR为34.48(4.55~89.36)mL·min-1·1.73 m-2;5例(38.5%)为慢性肾脏病1~3期,8例(61.5%)为慢性肾脏病4~5期,其中1例(7.7%)在诊断时已行肾脏替代治疗。蛋白尿/Scr升高与LCDD诊断之间的间隔时间为6(2~16)个月。
2.3 肾外受累
心脏受累发生率为46.2%。最常见的心电图异常为心房颤动占33.0%,超声心动图检查提示室间隔增厚12~14 mm,舒展功能受损Ⅰ~Ⅱ级,射血分数下降(EF<50%)的患者占15.4%,心脏受累LCDD患者氨基末端脑钠肽前体(NT-proBNP)和肌钙蛋白T的均值分别为9 431.35 pg/mL、0.073 μg/L,与非心脏受累LCDD患者相比明显升高。
2.4 血液学检查
5例(38.5%)血清免疫固定电泳阳性;8例(61.5%)患者骨髓浆细胞比例小于10%,3例(23.1%)骨髓浆细胞比例10%~30%,2例(15.4%)骨髓浆细胞比例大于30%。11例(84.6%)患者血游离轻链比值异常,5例(38.5%)明显异常(>8)。10例(76.9%)患者κ升高,3例(23.1%)患者λ升高。诊断时GFR<30.0 mL·min-1·1.73 m-2或透析依赖的患者轻链浓度高(500.67 mg/L),当GFR>30.0 mL·min-1·1.73 m-2时轻链浓度较低(103.8 mg/L),差异无统计学意义(P=0.087)。12例患者免疫球蛋白IgG下降,6例患者免疫球蛋白IgA下降,8例患者免疫球蛋白IgM下降,9例患者血清补体C3下降,1例患者血清补体C4下降。
2.5 肾脏病理特点
光镜下可见13例(100%)弥漫性TBM增厚、11例(84.6%)结节性肾小球系膜硬化,呈PAS染色强阳性,9例(69.2%)中重度间质纤维化,7例(53.8%)弥漫性肾小管萎缩。12例出现小动脉病变,包括内膜纤维化、小动脉中膜沉积。免疫荧光显示所有患者的TBM均可见线性(κ染色阳性10例,λ染色阳性3例)轻链限制性染色,9例出现肾小球系膜和(或)毛细血管壁沉积。所有患者TBM的外部和(或)GBM的内部均显示出无定形的“粉末状”电子致密物沉积。所有患者均未见铸型肾病及轻链淀粉样变性。
2.6 治疗及随访情况
13例患者中,1例起病时已进入ESRD,行腹膜透析,余12例患者中,其中8例接受以硼替佐米为基础的一线治疗(6例采用硼替佐米+地塞米松,2例采用环磷酰胺+硼替佐米+地塞米松);4例患者接受了其他治疗,其中2例患者接受CTDa方案,1例患者接受雷公藤多甙治疗,1例给予慢性病二级预防治疗,见表1。

表1 治疗方案与随访
2.7 肾脏存活率
平均随访(27.3±17.76)个月,随访截止对所有患者均存活。排除基线水平已透析的1例患者,中位肾脏生存时间为5.5年。1年、3年的肾脏存活率分别为67%、54%。以硼替佐米为基础的治疗,与其他治疗相比,1年肾脏存活率明显升高(87%vs.25%,P=0.04),见图1。
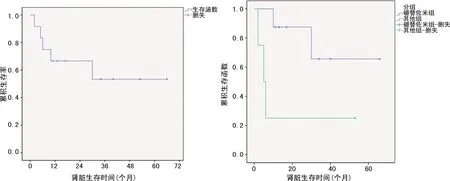
图1 肾脏生存率
3 讨 论
单克隆免疫球蛋白沉积病(MIDD)是一种罕见的与浆细胞或B淋巴细胞异常克隆性增殖有关的疾病。分为LCDD、重链沉积病(HCDD)、轻重链沉积病(LHCDD),其中LCDD最常见[10-11]。LCDD克隆性浆细胞浸润比例较少,多低于10%,单克隆轻链以κ为主,占80%~85%。几乎所有病例均会影响肾脏,其他器官,包括心脏、肝脏、肺和神经系统受累的频率很低[3,5]。如果未治疗,常常会导致肾功能快速下降,高达20%患者起病时需要肾脏替代治疗。
在本研究中,LCDD患病率为0.14%,低于NASR等[12]的报道(0.7%)。临床表现以中年男性为主,中位年龄为53.77岁,既往文献中报道的骨髓瘤管型肾病(MCN)诊断时中位年龄为66.00岁[13],而轻链淀粉样变性病(AL)为62.00岁[14]。所有患者均以肾脏受累为首发症状,表现不同程度的蛋白尿、镜下血尿、高血压及肾功能不全,46.1%有肾病综合征,76.9%出现肾功能不全,其中61.5%的患者GFR<30 mL·min-1·1.73 m-2,符合慢性肾脏病Ⅳ和Ⅴ期,7.7%患者依赖透析,诊断时GFR<30 mL·min-1·1.73 m-2或依赖透析的患者往往血游离轻链浓度较高。MM的发病率为30.8%,低于既往报道的53%~65%。6例患者LCDD病例合并心脏受累,表现为心脏舒张功能受损或限制性心肌病。LCDD可累及中枢及周围神经系统,临床表现格林巴利综合征或末梢神经感觉消退、自主功能丧失。此外,还可累及肝脏、皮肤、肺、脾脏、内分泌腺等,但本报道中未见相关病例出现。
M蛋白检测阳性率在不同研究中有差异。NASR等[12]研究显示,血清免疫固定电泳阳性率为69%,而血κ/λ异常率100%。Mayo诊所报道的88例患者,血清免疫固定电泳阳性率高达64%,尿免疫固定电泳阳性率68%,且99%患者血清游离轻链比值异常[15]。LI等[16]报道的48例患者,仅26.2%出现血清免疫固定电泳阳性,血清游离轻链比值异常患者比例为84.4%。本研究中38.5%出现血清免疫固定电泳阳性,而血清游离轻链比值异常比例为84.6%,其中显著异常比例为38.5%。血清游离轻链水平变化对评估治疗反应最有价值,同时是预测肾功能及总体生存的独立预后因素[10,17]。M蛋白检测阴性,考虑与免疫球蛋白数量和(或)电荷少、疏水性、与特殊基质相互作用的高组织亲和力等因素相关。
在本研究中,10例(76.9%)患者血清C3和(或)C4水平较低,但无肝脏受累,提示血清补体水平低不能归因于肝脏合成不足,可能与循环补体激活和调节失调有关,免疫球蛋白可能干扰补体系统,但不足以引起临床意义重大的补体介导疾病,如C3肾小球疾病或血栓性微血管病(TMA)[18]。
肾脏病理检查是LCDD诊断的金标准。典型病理特征为肾小球系膜结节性硬化,伴有系膜轻度增生,PAS染色呈强阳性,但刚果红阴性。几乎所有患者均有慢性肾小管间质病变,肾小管基底膜增厚、皱缩、分层,肾小动脉病变也较为常见。免疫荧光检测具有决定性诊断意义,轻链κ或λ沿肾小管基底膜、肾小球基底膜及小血管壁呈线性沉积。超微结构改变为无结构的颗粒状电子致密物沿肾小管基底膜外侧、肾小球基底膜内侧、系膜区、Bowman囊壁、小血管壁沉积。本研究中84.6%肾小球呈结节硬化性改变,100.0%肾小管基底膜增厚,69.2%间质中重度纤维化,53.8%弥漫性肾小管萎缩,均为LCDD典型特点。
既往LCDD治疗选择非常有限,通常血液学反应差,生存期(OS)为4.0~7.5年,5年生存率为70%,肾脏存活率仅为37%[19],往往发展为慢性肾功能衰竭,最终需要肾脏替代治疗。SAYED等[2]研究提示约62%的患者需要肾脏替代治疗,36%的患者死于感染、缺血性心肌病、脑血管意外、胃肠道出血、多发性骨髓瘤等。随着抗浆细胞治疗的不断进展,尤其是HDM/SCT和基于蛋白酶体抑制剂的治疗,患者平均生存期和肾脏存活率明显改善,特别是对治疗有良好反应(CR/VGPR)的患者往往可以获得持续血液学反应,无病生存期明显延长,中位OS长达14.0年,中位肾脏生存时间为5.4年,1年、5年和10年患者生存率分别提高了95%、78%和65%[2,20]。治疗反应的深度与速度与肾脏结局相关。
蛋白酶体抑制剂硼替佐米可以降低LC负荷,此外,可通过抑制核因子-κB(NF-κB),降低转化生长因子-β(TGF-β)水平,减少胶原生成,减轻肾小球硬化程度,延续肾功能不全的进展,保护肾脏,目前已成为LCDD的一线治疗药物[21]。治疗的不良反应主要包括周围神经病变和肺炎,可以通过减少剂量或延长剂量间隔进行控制[22]。本研究中,以硼替佐米为基础的治疗可以达到快速深度的血液学反应,75%达到VGPR或者CR,均未进展至ESRD,而PR或者NR患者中33.3%依赖透析。COHEN等[23]的一项回顾性研究提示,在接受以硼替佐米为基础治疗的MIDD患者中,血液学应答率较高(91%),CR/VGPR为70%,深度血液学反应与更好的肾脏预后有关。MAYO诊断研究发现,蛋白酶体抑制剂或者ASCT更容易达到血液学反应CR,肾脏反应更好[15]。与此相同,英国NAC研究认为,与大多数ESRD患者相比,至少获得VGPR的患者的eGFR有显著改善,在达到CR/VGPR的21例患者中,GFR从基线的26.0 mL·min-1·1.73 m-2平均每年改善6.1 mL·min-1·1.73 m-2,而PR/NR患者则从基线34.0 mL·min-1·1.73 m-2每年下降6.5 mL·min-1·1.73 m-2(P=0.005)[2]。
尽管患者存活率有所升高,但由于诊断延迟或初始治疗失败,肾脏存活率不高,多达52%患者需要透析。法国最新一项回顾性研究发现,在166例MIDD患者中,诊断时eGFR>30 mL·min-1·1.73 m-2患者的肾脏存活率明显高于eGFR<30 mL·min-1·1.73 m-2的患者(17.4年vs.7.3年)[17]。诊断时的肾功能损害程度是生存率的重要不良预测指标。有研究发现,GFR>30.0 mL·min-1·1.73 m-2的7年生存率为61.4%,而GFR<30.0 mL·min-1·1.73 m-2的患者7年生存率为44.9%,透析患者的7年生存率最低,为31.2%[24]。本研究显示,LCDD患者诊断时eGFR中位数为34.48 mL·min-1·1.73 m-2,肾脏中位存活时间5.5年,1年、3年肾脏存活率分别为67%、54%,部分由于LCDD诊断延迟,使得轻链在肾实质中的沉积随着时间推移而增加,最终导致肾脏明显纤维化,器官反应差。LCDD应早期诊断和治疗,达到血液学反应CR或VGPR可延长肾脏存活时间,即使出现晚期肾功能损害也要积极进行治疗,延缓肾功能进展至ESRD,同时也可防止肾移植后患者因LCDD复发而导移植肾失功。
本研究存在一定的局限性:(1)作为一项回顾性研究,缺乏标准化的治疗,随访时间相对较短,缺乏统计效应;(2)样本量小,限制了组间差异性比较,部分患者无尿免疫固定电泳及游离轻链检测结果。需要对LCDD患者进行前瞻性、多中心、对照研究,以确定最佳治疗方案。LCDD是一种罕见的MIDD,多见于中年男性,其特征是肾病范围蛋白尿、肾功能不全、高血压、血清游离轻链比值异常。早期诊断及基于硼替佐米的治疗,可以获得持续的血液学反应及更好的肾脏存活率,但仍需要多中心的前瞻性研究建立LCDD的标准化治疗方法。

