DCE-MRI半定量参数联合血清学指标鉴别卵巢交界性肿瘤和上皮性卵巢癌的价值*
张 晖,连 鹏,杨 璐,杨 军△
(西安市人民医院/西安市第四医院:1.医学影像科;2.检验科 710004)
卵巢交界性肿瘤(BOT)是介于良、恶性之间的卵巢上皮性肿瘤,具有低度恶性潜能,上皮组织类型上以浆液性、黏液性最为常见,其他类型均少见[1]。据报道,BOT占卵巢上皮性恶性肿瘤的10%~15%,与上皮性卵巢癌(EOC)不一样,多数BOT患者是处于育龄时期的年轻妇女,往往要求进行保守手术,以达保留生育能力或卵巢内分泌功能目的;其中Ⅰ期BOT患者5年生存率为95%~97%,Ⅱ~Ⅲ期BOT患者5年生存率为65%~87%[2-3]。而既往临床上BOT常被误认为良性肿瘤或卵巢癌,故术前鉴别BOT与EOC具有重要意义。
目前,血清叶酸受体1(FOLR1)及糖类抗原(CA)125、CA19-9已被证实对EOC具有重要的诊断效能,但单独诊断漏诊及误诊率较高[4]。常规磁共振成像(MRI)虽能清晰显示BOT与EOC的形态学特征,但二者存在交叉重叠情况,鉴别难度较大[5]。而动态增强磁共振(DCE-MRI)可有效弥补常规MRI的不足之处,通过血流动力学评估判断肿瘤功能状态,已被证实在鉴别交界性与恶性上皮性卵巢肿瘤中具有重要作用,但尚少有报道分析其联合血清学指标FOLR1、CA125、CA19-9对BOT、EOC的鉴别诊断效能[6]。本研究旨在探讨DCE-MRI半定量参数达峰时间(TTP)、对比剂最大浓度(Cmax)、浓度-时间曲线下面积(AUC)、最大斜率(MS)联合血清学指标FOLR1、CA125、CA19-9对BOT、EOC的鉴别诊断效能,现将结果报道如下。
1 资料与方法
1.1 一般资料
选取2018年7月至2020年7月本院收治的卵巢上皮性肿瘤患者128例,以术后组织病理为金标准,其中43例BOT患者纳为BOT组,年龄18~85岁,平均(46.20±13.40)岁;浆液型28例,黏液型15例。另85例EOC患者纳为EOC组,年龄20~85岁,平均(47.05±13.54)岁;浆液型72例,黏液型4例,透明细胞癌3例,子宫内膜样癌5例,移行细胞癌1例。纳入标准:术后均经病理组织学证实为BOT或EOC;术前未接受任何抗肿瘤治疗(如放化疗等);术前均顺利完成常规MRI及DCE-MRI检查;年龄大于或等于18岁;临床和检查资料完整。排除标准:既往有妇科肿瘤病史;合并其他恶性肿瘤;严重心脑肾肝疾病;对比剂钆喷酸葡胺过敏。本研究经本院伦理委员会批准通过,患者签署知情同意书。
1.2 方法
1.2.1DCE-MRI检查方法
采用美国GE公司3.0T MR扫描仪(腹部相控阵线圈),嘱患者仰卧位,并于采集过程中自由呼吸,行全腹部常规平扫和动态增强扫描(盆腔扫描时,下腹部和线圈之间加用电解质垫,束紧前后片线圈压迫小腹,既可减轻电解质伪影又可减轻呼吸运动的影响)。(1)常规平扫:①横断面脂肪抑制快速自旋回波T2加权扫描(T2WI-FS)。重复时间(TR)3 000 ms,回波时间(TE)68 ms,矩阵512×512,扫描视野(FOV)360 mm×420 mm,层厚4 mm,层间距1 mm。冠状位T2WI:TR 2 700 ms,TE 85 ms,矩阵512×512,FOV 360 mm×420 mm,层厚5 mm,层间距2 mm。矢状位T2WI:TR 2 900 ms,TE 72 ms,矩阵512×512,FOV 280 mm×340 mm,层厚4 mm,层间距1 mm。②横断面快速自旋回波T1加权扫描(T1WI)。TR 550 ms,TEminfullms,矩阵512×512,FOV 380 mm×420 mm,层厚6 mm,层间距2 mm。(2)动态增强扫描:LAVA行LAVA动态扫描采集,翻转角12°,其他参数同前。采用高压注射器静注钆喷酸葡胺注射液(BayerPharmaAG,国药准字J20171008,剂量0.2 mmol/kg,速率3.0 mL/s),持续无间隔扫描前5期,后2期间隔30 s。(3)图像分析:由2名经验丰富的影像诊断医师以双盲法阅片。按照常规MRI图像行形态学特征判断,于病灶最大实性成分层面髂内动脉处进行感兴趣区勾画,动脉输入函数曲线自动获取后计算半定量参数TTP、Cmax、AUC、MS。
1.2.2血清学指标检测方法
采集患者术前空腹静脉血3 mL,离心半径10 cm,3 000 r/min离心15 min,待血清分离后置于-20 ℃条件下备测。采用HD-2001A型生物芯片阅读仪(湖州数康生物科技有限公司),以化学发光酶联免疫方法检测血清CA125、CA19-9水平,试剂盒均由湖州数康生物科技有限公司提供;采用680型酶标仪(美国Bio-Rad公司),以酶联免疫吸附试验检测血清FOLR1水平,试剂盒由武汉博士德生物有限公司提供。
1.3 统计学处理

2 结 果
2.1 两组一般资料比较
两组年龄、吸烟史、饮酒史、活胎生育史、绝经、绝经年龄等一般资料比较,差异无统计学意义(P>0.05),见表1。
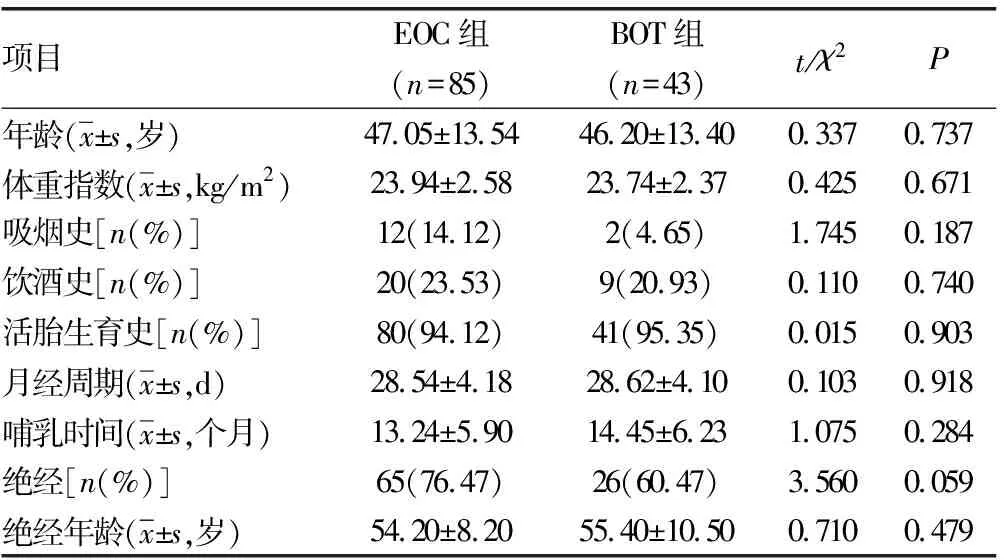
表1 两组一般资料比较
2.2 两组常规MRI形态学特征比较
EOC组肿块类型以囊实性为主,且多见于单侧、中度强化,腹盆腔积液少见;BOT组肿块类型以囊性成分为主,单侧、中度强化较为多见,腹盆腔积液少见。两组常规MRI形态学特征比较差异无统计学意义(P>0.05),见表2。
2.3 两组DCE-MRI半定量参数比较
EOC组TTP显著低于BOT组(P<0.05),Cmax、AUC、MS显著高于BOT组(P<0.05),见表3。
2.4 两组血清学指标比较
EOC组血清FOLR1、CA125水平显著高于BOT组(P<0.05),血清CA19-9水平与BOT组比较差异无统计学意义(P>0.05),见表4。
2.5 DCE-MRI半定量参数、血清学指标单一及联合对BOT、EOC的鉴别诊断效能
DCE-MRI半定量参数TTP、Cmax、AUC、MS及血清学指标FOLR1、CA125对二者均有一定鉴别诊断效能,曲线下面积分别为0.715、0.677、0.733、0.794、0.803、0.755;上述DCE-MRI半定量参数及血清学指标联合鉴别二者的曲线下面积为0.953,见表5及图1~3。
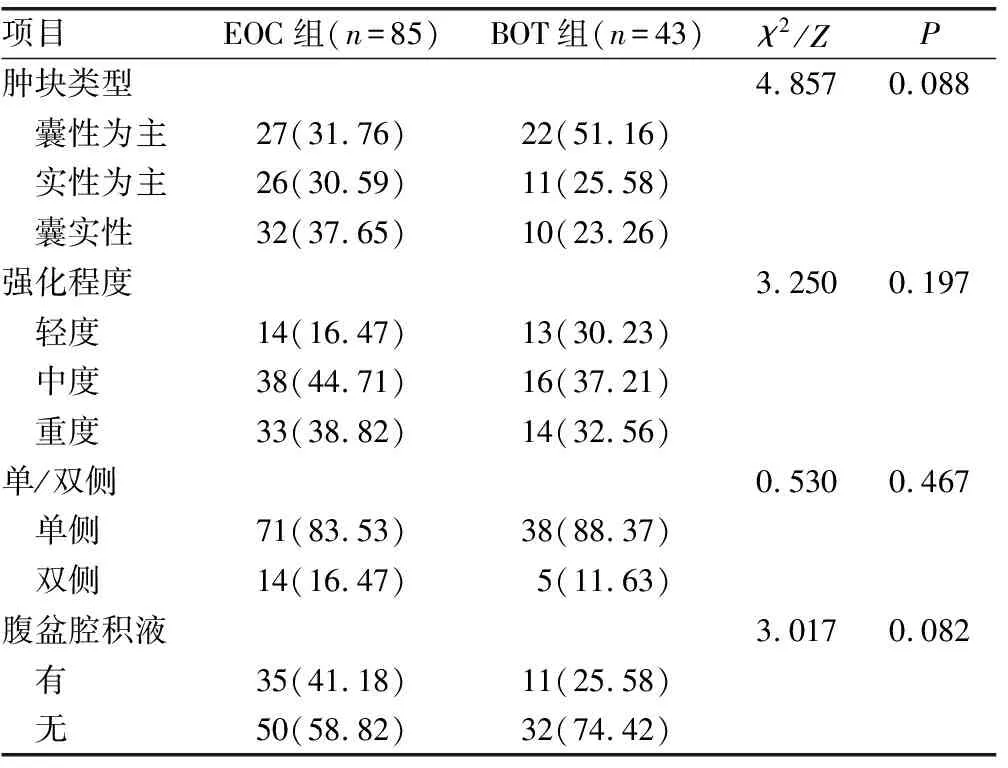
表2 两组常规MRI形态学特征比较[n(%)]

表3 两组DCE-MRI半定量参数比较

表4 两组血清学指标比较
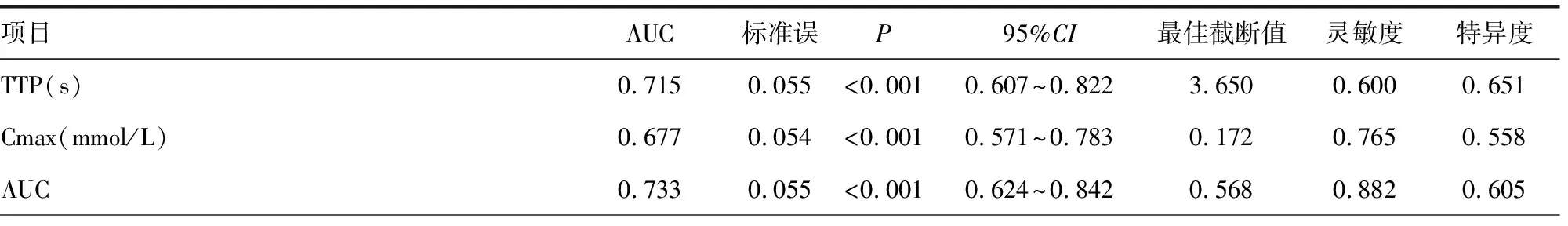
表5 DCE-MRI半定量参数、血清学指标单一及联合对BOT、EOC的鉴别诊断效能
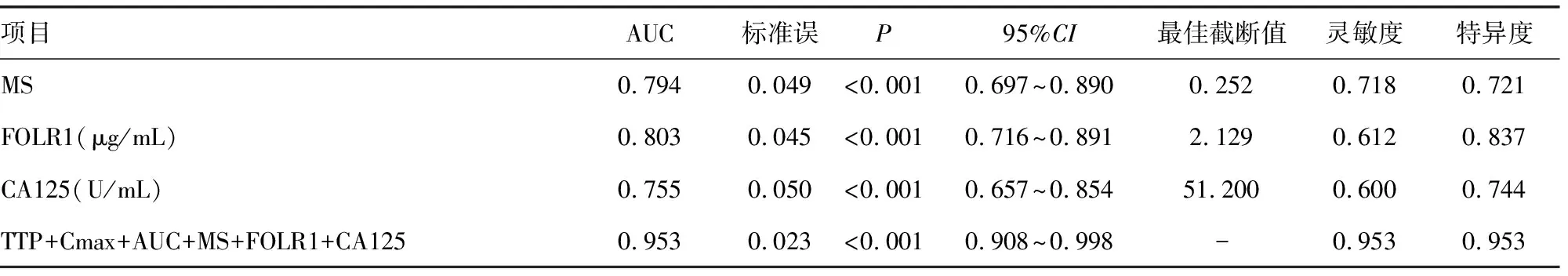
续表5 DCE-MRI半定量参数、血清学指标单一及联合对BOT、EOC的鉴别诊断效能
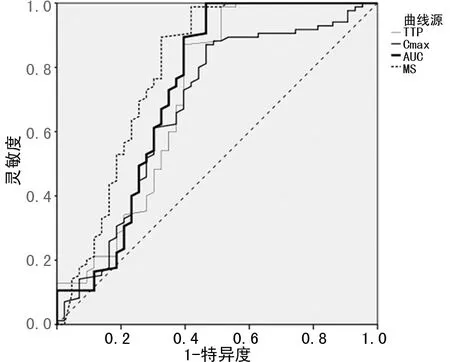
图1 DCE-MRI半定量参数鉴别二者的ROC图
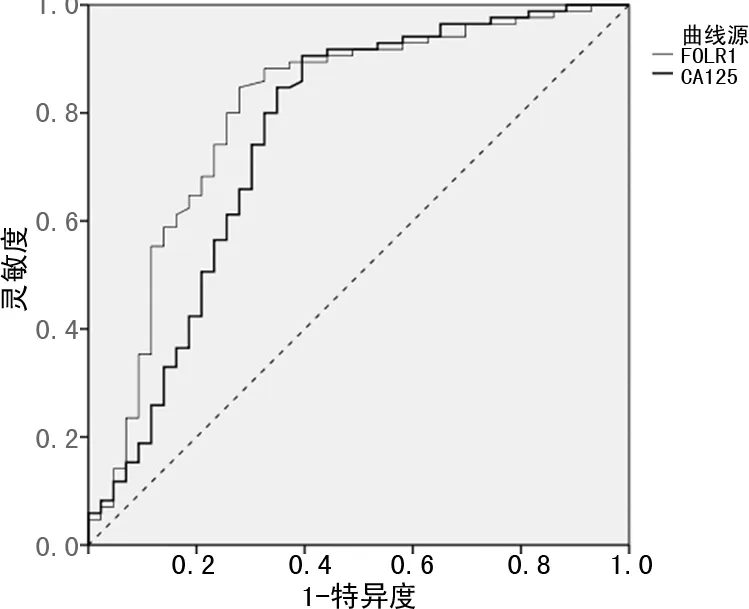
图2 血清学指标鉴别二者的ROC图
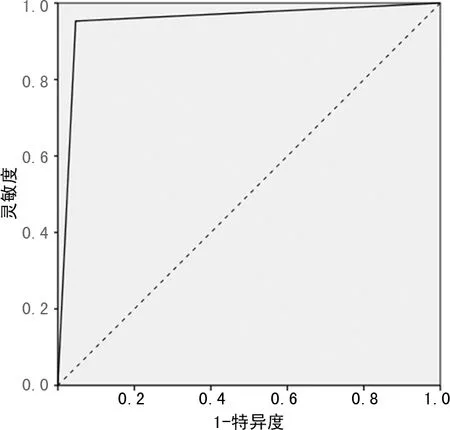
图3 DCE-MRI半定量参数联合血清学指标鉴别二者的ROC图
3 讨 论
BOT具有低度恶性能力,其生长方式和细胞学特征方面介于良性和恶性肿瘤之间,约1/3的患者年龄低于40岁,渴望生育和保留卵巢以维持正常女性内分泌功能,要求保守手术治疗,预后较好[7]。但由于BOT经常被误认为良性肿瘤或卵巢癌,致使治疗不足或过度治疗,影响患者预后,故术前准确诊断尤为重要[8]。目前MRI已被证实对卵巢肿瘤的鉴别诊断价值优于超声及多层螺旋CT,可多方位、多参数、多序列成像,具有良好的软组织对比分辨率,无电离辐射性损伤,且不需要依赖操作者临床经验,在BOT诊断及鉴别诊断中意义重大[9]。而YANG等[10]报道常规MRI虽能准确显示BOT形态学特征(如多见于单侧、中度强化等),但EOC亦可见这些征象。本研究显示,EOC组与BOT组病灶多见于单侧、中度强化,腹盆腔积液少见,证实二者常规MRI征象具有重叠性,与上述报道相符。
DCE-MRI作为建立在流动效应基础上的一项MR成像技术,可量化反映病变组织血供特征,为BOT诊断和鉴别诊断提供额外的血流动力学信息;而DCE-MRI半定量参数(TTP、AUC、Cmax、MS)是基于对比剂浓度-时间曲线上利用药代动力学模型获取,相较于以往基于信号强度-时间曲线半定量分析,更能反映组织内在微循环灌注信息[11]。本研究结果显示,EOC组TTP较BOT组低,与左金等[12]报道相符,表明EOC微血管密度较BOT高,推测可能与卵巢恶性肿瘤生长速度较快、组织结构更为复杂、间质血管更为丰富有关。此外,本研究发现,EOC组Cmax较BOT组高,推测可能与强化范围及速度等因素有关;而EOC组AUC明显高于BOT组,提示肿瘤细胞恶性程度越高,组织内微血管生成越多,血供越丰富,很大程度上会增加肿瘤血管内对比剂浓度,致使细胞密集程度增加;另外,EOC组MS较BOT组高,与YIN等[13]报道相似,推测可能与肿瘤恶性程度不断升高,致使肿瘤微血管生成能力强,引起瘤内微血管肌层缺乏,导致微血管壁更易遭受肿瘤细胞浸润与破坏,促使对比剂分子更易经血管壁向外渗漏,不断增加微血管通透程度,加快血流速度,故最终致使MS升高。另外,本研究结果显示,TTP、Cmax、AUC、MS对BOT、EOC均有一定鉴别诊断效能,与既往报道一致[14-15],提示DCE-MRI半定量参数在BOT与EOC鉴别诊断中具有重要意义。而相较于TTP、Cmax、AUC,MS对二者的鉴别诊断效能最高,其原因考虑是MS可准确反映增强过程中的增加速度。
FOLR1属一种膜蛋白,对叶酸及其衍生物存在高度亲和力,可介导细胞外叶酸进入细胞内,由于叶酸可调控细胞增殖、分裂及组织生长,当叶酸缺乏时往往会影响肿瘤细胞DNA复制、修复与基因表达,故FOLR1表达对细胞分裂及增殖具有重要影响。HUANG等[16]报道FOLR1在卵巢癌患者血清中呈高表达,可反映肿瘤分化程度、淋巴结转移、组织分型情况,推测可能在卵巢癌的发病过程中起重要作用。本研究结果显示,EOC组血清FOLR1水平较BOT组高,提示FOLR1有可能成为EOC早期诊断的一个血清标志物。进一步进行ROC分析,发现FOLR1对BOT、EOC有一定鉴别诊断效能,与鱼志琪等[17]报道结论一致,进一步证实FOLR1是区分BOT与EOC的一个有潜力的生物标志物。
CA125作为一种可结合单克隆抗体CA125的大分子量糖蛋白,是卵巢肿瘤最常用的肿瘤标志物,有研究表明约90%的EOC过表达CA125,既往被广泛用于早期EOC诊断及鉴别诊断、疗效判断及复发监测[18]。本研究中,EOC组血清CA125水平明显高于BOT组,而进一步进行ROC分析,发现CA125对BOT、EOC有一定鉴别诊断效能,与上述报道相似,提示CA125是鉴别BOT与EOC的一个有潜力的生物标志物。张丽敏等[19]也发现EOC组血清CA125水平较BOT组高,且经ROC分析发现CA125对二者具有重要鉴别诊断效能,证实了本结论。但其他病理情况也会导致血清CA125水平升高,如子宫腺肌症、子宫内膜异位症、子宫肌瘤、卵巢良性肿瘤、盆腔炎性疾病等,且早期卵巢癌患者中仅有50%的患者血清CA125异常升高,临床应引起足够重视。而CA19-9属抗人结肠癌单抗隆抗体所识别的一种抗原,在EOC尤其是黏液性癌中有较高的阳性表达率,已被广泛用于诊断妇科肿瘤[20]。本研究结果显示,EOC组血清CA19-9水平较BOT组并无显著改变,推测可能与样本量大小及研究对象的选择等因素有关,有待今后深入探讨。
本研究结果显示,DCE-MRI半定量参数TTP、Cmax、AUC、MS联合血清学指标FOLR1、CA125鉴别BOT、EOC的曲线下面积为0.953,证实上述DCE-MRI半定量参数联合血清学指标对二者具有较高的鉴别诊断效能。相较于单独应用DCE-MRI半定量参数或血清学指标,二者联合更有助于鉴别诊断BOT、EOC,临床应引起足够重视。
综上所述,DCE-MRI半定量参数TTP、Cmax、AUC、MS联合血清学指标FOLR1、CA125对BOT、EOC的鉴别诊断更有价值,但考虑本文选取病例数偏少,结果可能存在偏倚,故今后仍需深入探讨。

