母体暴露环境浓度盐酸四环素对F1代斑马鱼胚胎骨骼发育的影响
齐澈力木格,尹晓宇,李嘉伟,董文静,陈浩,王欢,楚文庆,杨景峰,于建华,董武
内蒙古民族大学动物科学技术学院,内蒙古自治区毒物监控及毒理学重点实验室,通辽 028000
近年来,随着医药行业的迅速发展,抗生素被更广泛地应用,但同时也出现很多安全问题。抗生素的滥用会造成抗药性,给人类健康带来威胁,同时也带来了严重的环境问题[1]。目前,世界上生产的抗生素已达200多种,其中,至少有50%的抗生素用于畜牧业、养蜂业和水产养殖业[2]。在禽畜养殖行业中,为了控制生产成本,部分养殖户会通过过量抗生素的使用来减少禽畜的发病率,或者在饲料中添加抗生素以提高饲料转化率,加快畜禽生长[3]。四环素类抗生素(tetracyclines, TCs)是一类广谱抗菌药物,主要包括金霉素(chlorotetracycline, CTC)、土霉素(oxytetracycline, OTC)、四环素和强力霉素。由于TC的大量使用,人们在农场废水中检测到TC的残留[4-5],其中,金霉素高达3.99~107.14 mg·L-1、四环素也达到0.13~1.78 mg·L-1[6-7]。抗生素并不完全被动物吸收,超过85%以原始状态直接排放到环境中或作为代谢物形式随粪便排入环境中[8]。由于长期使用和持续排放到环境中,造成动物肠道菌群的变化,影响体重[9]。抗生素在环境中的迁移推动了抗性基因的传播[10],这对人类的健康和生态系统的稳定构成了潜在的风险[11-12]。
四环素类抗生素除了抗菌作用外,还被报道可阻止骨吸收。例如,强力霉素和二甲胺四环素已被证明通过阻断基质金属蛋白酶-9(mmp-9)活性来抑制破骨细胞形成[13]。四环素类抗生素及其衍生物对破骨细胞形成抑制作用机制尚不完全清楚[14]。四环素类似物,特别是替加环素通过阻断mmp-9介导的组蛋白H3来抑制破骨细胞的形成,并提示mmp-9的抑制可能为糖皮质激素诱导的骨质疏松症的治疗提供新的策略[15-16]。这对人和动物的正常骨发育势必造成不良影响。
软骨发育是骨骼形成过程中最早的发育形态[17-18]。在胚胎发育过程中,间充质细胞分化产生骨软骨前体和软骨细胞。无论是硬骨鱼还是哺乳动物,软骨细胞的成熟都伴随着软骨细胞形态、生物合成活性和能量代谢的重大变化[19]。随着软骨的成熟,软骨细胞发生肥大,导致细胞直径和体积增大[17]。runx是决定成骨细胞和早期分化的转录因子[20]。当runx2某些功能丧失后,软骨的内骨化进程会被推迟[21]。骨骼发育中sox9家族基因是成骨细胞/软骨细胞关联基因,其表达被认为是转基因小鼠中软骨细胞分化的早期标志物[22]。在软骨早期发育中sox9a的表达被促进,而软骨发育后期sox9a的表达被抑制。sox9a则主要参与早期软骨细胞的增殖分化进程[23-24]。sox9a还作为col2α1的调控因子,具有至关重要的作用[25-26]。目前,在小鼠、兔子和狗等动物上有一些关于氟喹诺酮类抗生素(fluoroquinolones antibiotics, FQs)软骨毒性的报道,但在鱼上还没有关于软骨毒性的研究,更没有关于其遗传毒性的报道[27]。斑马鱼是研究骨骼软骨和脊索形成的极好的遗传模型[28-31]。斑马鱼因其具有发育迅速、胚胎透明、便于操作和观察、对药物极其敏感,及可利用资源极其丰富等诸多的优势,被广泛应用。
本研究使用斑马鱼为动物模型,通过母体的盐酸四环素暴露实验,观察四环素对F1代斑马鱼胚胎软骨发育的影响并探讨其作用机制。
1 材料与方法(Materials and methods)
1.1 实验试剂
盐酸四环素(tetracycline hydrochloride, TCH)购于北京索莱宝科技有限公司,CAS号为64-75-5,分子式为C22H24N2O8·HCl,分子量为480.90,纯度为≥98%标准品;总RNA提取试剂盒和反转录试剂盒等购自美国Sigma公司。
1.2 斑马鱼F0亲代处理
斑马鱼(Daniorerio) (AB系),饲养于斑马鱼养殖系统(北京爱生科技发展公司)中,保持饲养水温(28±1) ℃,并在自然环境下保持光照∶黑暗时间为14 h∶10 h。从繁育群体中挑出数量、条件一致的雌雄成年斑马鱼(4个月),将雄性和雌性分离并观察1周,通过确认可存活的胚胎来确定个体的生殖状态。将选定的鱼转移到实验缸,F0亲代斑马鱼经TCH处理30 d,最终确定为4组,分别为空白对照组、0.1 μg·L-1(低浓度组)、1 μg·L-1(中浓度组)和100 μg·L-1(高浓度组)。5~7 d换水换药,每天喂食2次鱼饲料和丰年虫。在实验前一天傍晚,随机选取1∶1雌雄鱼放在同一斑马鱼专用孵化缸中混养过夜,次日见光产卵。
1.3 斑马鱼F1代胚胎处理
斑马鱼F0亲代经TCH处理30 d后合缸,实施繁育实验。受精后1.5 hpf进行产卵数及受精卵数统计,并将F1代斑马鱼胚胎移入28 ℃ Heratherm IGS180恒温孵化箱(Thermo Fisher Scientific,美国)中培养。分别于受精后8、24、48、72、96和120 hpf取样并观察,记录胚胎均匀性、孵化率、死亡率和畸形率等形态学数据(每组进行3次以上的平行及重复实验)。
1.4 胚胎及幼鱼形态学评估
形态学评估采用Brannen等[32]改进的量表对斑马鱼幼鱼的身体形态进行评分。分别观察8、24、48、72、96和120 hpf的F1代胚胎的形态变化。每组10粒卵,分为正常、轻度、中度和严重异常4组。进一步分析对胚胎各个器官发育的影响。评分结构包括卵黄囊、心囊、心脏血池和脊索弯曲程度等。形态学评估分数在幼鱼形态结构的正常发育情况下为4分,轻度畸形为3分,中度畸形为2分,重度畸形为1分,评分时器官缺失为0分,未发现异常的正常发育幼鱼最高得分为16分。评分时若幼鱼死亡得分为0,最后进行统计分析。
1.5 阿尔新蓝软骨染色方法及测量方法
取受精后72、96和120 hpf的幼鱼10条,用4%的中性缓冲多聚甲醛(PFA)于4 ℃下固定并过夜,样本用1×磷酸盐缓冲溶液(PBS)冲洗2次,在0.1%阿尔新蓝染液(阿利新蓝8GX∶80%乙醇∶20%乙酸)室温染色12 h以上,用体积分数为95%、90%、80%、70%、50%和20%的酒精脱水各30 min,用蒸馏水清洗30 min,用质量分数为1%的氢氧化钾和体积分数为30%的双氧水混合后处理1 h,然后用质量分数为0.05%的胰酶处理1 h,并实时观察,在70%的甘油中观察及保存。然后用ImageJ对幼鱼头部下颌骨长度(A)、角舌骨长度(B)、下颌骨宽度(C)和下颌弓长度(D)进行软骨长度测量(图1)。

图1 斑马鱼胚胎头部软骨染色长度测量示意图注:A下颌骨长度;B角舌骨长度;C下颌骨宽度;D下颌弓长度。Fig. 1 Schematic diagram of measuring the length of cartilage staining on the head of zebrafish embryoNote: A indicates mandibular length; B indicates angular hyoid length; C indicates mandibular width; D indicates mandibular arch length.
1.6 总RNA的提取及实时荧光定量PCR(qRT-PCR)
使用Trizol试剂处理完整的胚胎,从整体斑马鱼胚胎中提取总RNA(Grand Island公司;12183-555)。使用Nano Drop2000c(Thermo Fisher Scientific,美国)测定提取的总RNA浓度。纯化的总RNA使用cDNA反转录试剂盒(Applied Biosystems Inc.)反转录成cDNA,反应方法按照厂家说明书进行,cDNA样本使用前保存在-20 ℃条件下。使用TaqMan进行基因表达测定和基因表达分析(Applied Biosystems Inc.)。反转录加入0.2 ng cDNA后进行反应与TaqMan Universal PCR Master Mix混合,并使用7900HT实时荧光定量PCR仪(Applied Biosystems,美国)进行PCR检测,采用Sequence Detection System 2.0软件分析,实验方法与步骤基本与Dong等[33]描述的相同。内参基因为β-Actin,采用2-ΔΔCT方法计算基因表达的相对变化(表1)。

表1 实时荧光定量PCR引物Table 1 Real-time fluorescence quantitative PCR primers
1.7 数据统计
所有数据均以平均值±SEM表示,使用GraphPad Prism software进行统计分析。差异显著性使用单因素方差分析。P<0.05的情况下被认为是统计学上的差异显著。
2 结果(Results)
2.1 TCH对F1代胚胎的影响
2.1.1 TCH对F1代斑马鱼胚胎均匀性的影响
斑马鱼F0亲代经TCH处理30 d后,引起F1代胚胎外胚层前缘和组织的均匀性出现不均匀现象,发育至8 hpf时观察并统计分析。F1代斑马鱼的胚胎均匀性随着TCH浓度的升高而下降(图2)。胚胎均匀性比例在浓度为1 μg·L-1时与空白对照组相比降低至58.62%(P<0.01)。100 μg·L-1浓度组与空白对照组相比降低至48.27%(P<0.001)。

图2 盐酸四环素(TCH)对F1代斑马鱼胚胎均匀性的影响注:TCH引起F1代斑马鱼胚胎外胚层前缘和组织出现不均匀性;受精卵发育到8 hpf时进行镜下观察,(a) 空白对照组,(b) 0.1 μg·L-1浓度组,(c) 1 μg·L-1浓度组,(d) 100 μg·L-1浓度组;星号表示暴露组与对照组之间的显著差异(*P<0.05、**P<0.01、***P<0.001);数据表示为平均值±SEM;标尺=1 mm。Fig. 2 Effect of tetracycline hydrochloride (TCH) on the uniformity of F1 generation zebrafish embryosNote: TCH causes heterogeneity in the front edge and tissue uniformity of ectoderm in F1 zebrafish embryos; the fertilized egg was observed under the microscope when it reached 8 hpf; (a) blank control group; (b) 0.1 μg·L-1 concentration groups; (c) 1 μg·L-1 concentration groups; (d) 100 μg·L-1 concentration groups; the asterisk indicates the significant difference between the exposed group and the control group (*P<0.05, **P<0.01, ***P<0.001); data are expressed as mean±SEM; bar =1 mm.
2.1.2 TCH对F1代斑马鱼幼鱼发育影响
TCH处理F0亲代斑马鱼30 d后,其F1代幼鱼出现各种形态发育异常,主要包括脊柱弯曲、头部变形、卵黄浮肿、心囊浮肿、尾部弯曲,或缺失等 (图3) 。F1代斑马鱼胚胎卵黄浮肿率、心囊浮肿率、卵黄浮肿面积和心囊浮肿面积随着TCH浓度的升高而增加(P<0.05)。在48 hpf时,卵黄浮肿率在100 μg·L-1浓度组比空白对照组上升了23.33%(P<0.001),卵黄浮肿面积与空白对照相比增加了3.47倍(P<0.01)。心囊浮肿率在100 μg·L-1浓度组比空白对照组上升了33.33%(P<0.01),心囊浮肿面积比空白对照组相比增加了11.76倍(P<0.01)。

图3 TCH引起F1代斑马鱼幼鱼卵黄和心囊浮肿注:TCH处理亲代F0斑马鱼30 d后,实施交配获得F1代,并观察其形态发育异常;bs为脊柱弯曲;ehc为心囊水肿;yse为卵黄囊水肿;sbl为体长缩短;bt为尾部弯曲;星号表示暴露组与对照组之间的显著差异(*P<0.05、**P<0.01、***P<0.001);数据表示为平均值±SEM;标尺=1 mm。Fig. 3 TCH causes yolk and pericardial edema in F1 generation zebrafish larvaeNote: The parent zebrafish (F0) is treated with TCH for 30 d, then mated to obtain F1 generation and the morphological abnormalities in the F1 generation juveniles were observed; after 30 d of parental zebrafish treatment with TCH, bs represents spinal curvature; ehc represents cardiac capsule edema; yse represents yolk sac edema; sbl represents shortened body length; bt represents the tail bends; the asterisk indicates the significant difference between the exposed group and the control group (*P<0.05, **P<0.01, ***P<0.001); data are expressed as mean ±SEM; bar=1 mm.
2.1.3 TCH对F1代的形态学评估
TCH处理亲代F0斑马鱼30 d后,F1代斑马鱼胚胎畸形率随着浓度的升高而增加,中浓度组(1 μg·L-1)相比空白对照组畸形率上升了13.33%(P<0.05),高浓度组(100 μg·L-1)与空白对照组相比畸形率上升了26.67%(P<0.001)(图4(a))。对其形态学进行评估发现,中浓度组(1 μg·L-1)下降至对照组的70.81%(P<0.05),高浓度组(100 μg·L-1)下降至对照组的50%(P<0.001)(图4(b))。
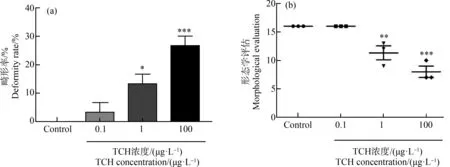
图4 TCH对F1代斑马鱼胚胎发育的影响注:TCH处理亲代F0斑马鱼30 d后交配获得F1代,并实施形态学观察到120 hpf;(a)胚胎畸形率,(b)形态学评估;星号表示暴露组与对照组之间的显著差异(*P<0.05、**P<0.01、***P<0.001);数据表示为平均值±SEM。Fig. 4 Effects of TCH on embryo development of F1 generation of zebrafishNote: The parent zebrafish were treated with TCH for 30 d, then mated to obtain F1 generation, and the morphology was observed until 120 hpf; (a) embryo deformity rate, (b) morphological evaluation; the asterisk indicates the significant difference between the exposed group and the control group (*P<0.05, **P<0.01, ***P<0.001); data are expressed as mean±SEM.
2.2 TCH对F1代幼鱼头部软骨的影响
为检测TCH对斑马鱼F1代胚胎骨骼的影响,经阿尔新蓝软骨染色,观察到头面软骨的变形(图5)。头部软骨的下颌骨长度随着TCH浓度的升高而变长,胚胎发育至72、96和120 hpf时,随着TCH浓度升高有变长趋势,但无显著差异 (P>0.05) (图6(a))。角舌骨长度随着TCH浓度的升高而缩短。在96 hpf时100 μg·L-1浓度组缩短至对照组的87.56%(P<0.05),在72 hpf和120 hpf时虽与对照组相比没有显著差异性,但有明显的缩短趋势(图6(b))。下颌骨宽度随着TCH浓度的升高而缩短,在72 hpf时高浓度组(100 μg·L-1)缩短至对照组的76.91% (P<0.05),胚胎发育至96 hpf和120 hpf时虽与对照组相比没有显著差异性,但有缩短趋势 (P>0.05) (图6(c))。下颌弓长度随着TCH浓度的升高而变长,胚胎发育到72、96和120 hpf时下颌弓长度虽与对照组相比没有显著差异,但整体有明显变长趋势 (P>0.05) (图6(d))。

图5 TCH对斑马鱼F1代幼鱼软骨的影响注:F0亲代斑马鱼在TCH暴露30 d后,收集F1代胚胎,发育至72、96和120 hpf时分别进行阿尔新蓝软骨染色,并在镜下观察;标尺=100 μm。Fig. 5 Effects of TCH on F1 lava cartilage of zebrafishNote: F0 parental zebrafish were treated with TCH for 30 d, and F1 generation embryos were collected; when F1 developed to 72, 96 and 120 hpf, they were stained with Alcian blue and observed under the microscope; bar =100 μm.
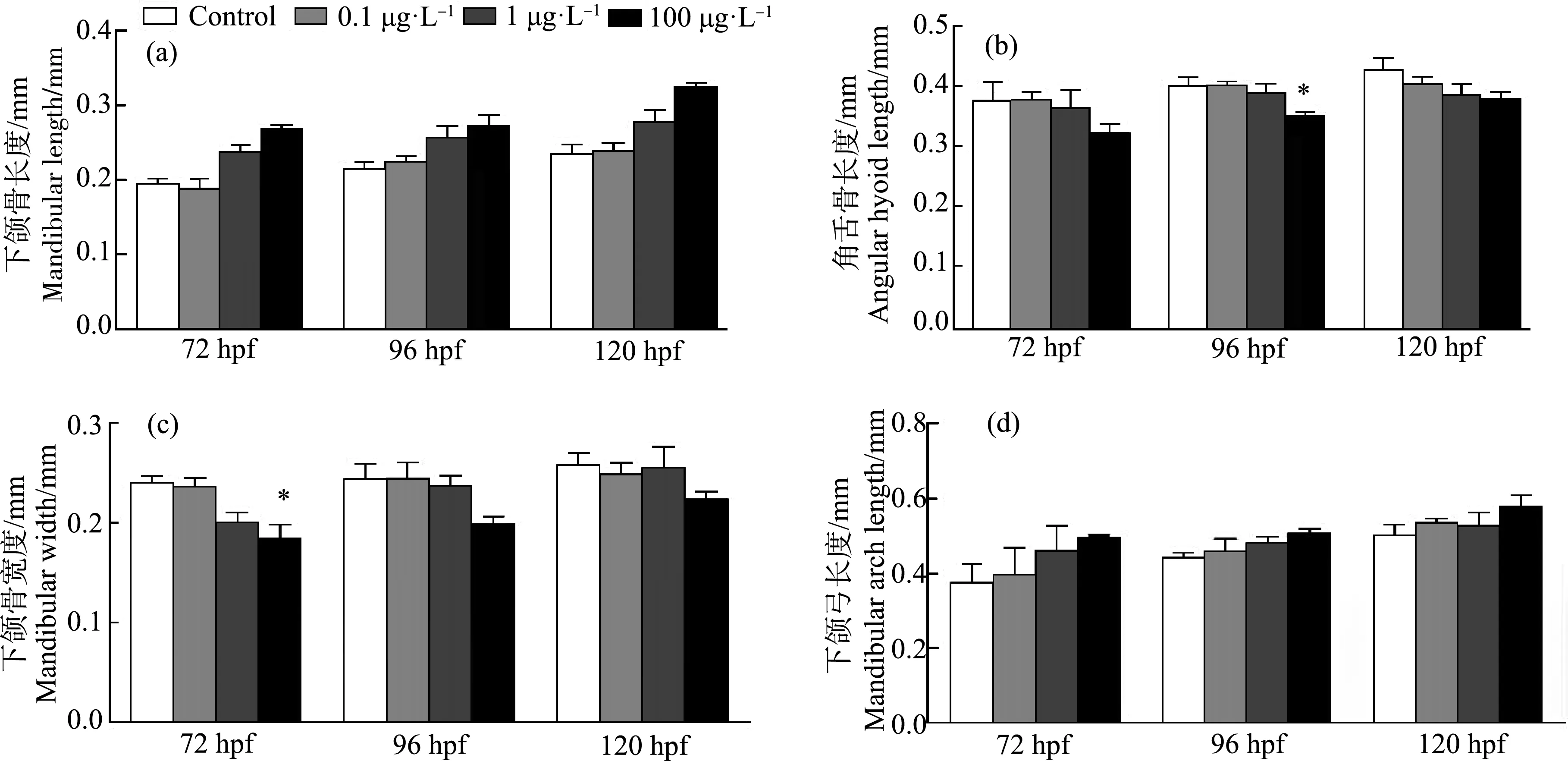
图6 TCH对F1代斑马鱼幼鱼头部软骨的影响注:胚胎发育至72、96和120 hpf时进行阿尔新蓝软骨染色,并镜下观察;用ImageJ对幼鱼颅部软骨测量;(a)下颌骨长度,(b)角舌骨长度,(c)下颌骨宽度,(d)下颌弓长度;星号表示暴露组与对照组之间的显著差异(*P<0.05、**P<0.01、***P<0.001);数据表示为平均值±SEM。Fig. 6 Effects of TCH on the head cartilage of F1 zebrafish larvaeNote: Alcian blue cartilage staining are carried out when the embryo developed to 72, 96 and 120 hpf, and the samples were observed by microscopy; the cranial cartilage of juvenile fish was measured by ImageJ; (a) mandibular length, (b) angular hyoid length, (c) mandibular width, (d) mandibular arch length; the asterisk indicates the significant difference between the exposed group and the control group (*P<0.05, **P<0.01, ***P<0.001); data are expressed as mean±SEM.
2.3 TCH对F1代骨骼相关基因表达的影响
为探究软骨畸形出现的机制,对相关软骨关联基因,如runx1、sox9a、sox10和col2α1a进行了检测。结果表明,runx1基因的表达在72 hpf时,高浓度组(100 μg·L-1)降低至对照组的61.76%(P<0.05)。高浓度组与空白对照组相比,基因表达量有降低趋势(图7(a)~图7(d))。72 hpf和96 hpf时,sox9a基因在100 μg·L-1浓度组分别降低至对照组的84.99%和69.07% (P<0.05)。48 hpf时,sox10基因在中浓度组 (1 μg·L-1)降低至空白对照组的77.45% (P<0.05),高浓度组 (100 μg·L-1)降低至对照组的67.03% (P<0.01),在120 hpf时,1 μg·L-1和100 μg·L-1浓度组分别降低至对照组的76.45%和73.70%(P<0.05)。72 hpf时,col2α1a基因在中浓度组(1 μg·L-1)降低至对照组的40.65% (P<0.05);高浓度组(100 μg·L-1)下降至对照组的39.52% (P<0.01);胚胎发育至120 hpf时,中浓度组(1 μg·L-1) 降低至对照组的79.78% (P<0.05);高浓度组(100 μg·L-1)下降至对照组的72.69%(P<0.01)。

图7 TCH对F1代斑马鱼胚胎骨骼发育相关基因表达的影响注:当胚胎发育到48、72、96和120 hpf,使用RT-PCR检测runx1、sox9a、sox10和col2α1a mRNA表达;每组包含10个胚胎,每组3个重复;星号表示暴露组与对照组之间的显著差异(*P<0.05、**P<0.01、***P<0.001);数据表示为平均值±SEM。Fig. 7 Effect of TCH on the gene expression of skeletal development in F1 zebrafish larvaeNote: mRNA expressions of runx1, sox9a, sox10 and col2α1a were detected by RT-PCR when the embryo developed to 48, 72, 96 and 120 hpf, respectively; each group contained 10 embryos, each with three replicates; the asterisk indicates the significant difference between the exposed group and the control group (*P<0.05, **P<0.01, ***P<0.001); data are expressed as mean±SEM.
3 讨论(Discussion)
研究结果表明,当成年斑马鱼分别经不同浓度TCH暴露30 d后,F1代的胚胎均匀性随着浓度的升高而下降。其孵化率随着TCH浓度的升高而降低,存活率随浓度升高而下降。亲代斑马鱼TCH暴露30 d后,F1代斑马鱼幼鱼在各个TCH暴露组都出现不同程度畸形,如心囊水肿、卵黄囊水肿和脊索弯曲等。统计分析表明,F1代斑马鱼幼鱼经TCH暴露后,总畸形率都显著增高。经软骨染色发现,TCH造成F1代斑马鱼幼鱼下颌骨长度、下颌弓长度、下颌骨宽度和下颌角骨长度的变化,并随着TCH浓度升高而出现不同程度的变长或缩短现象。这可能与TCH能够显著抑制斑马鱼F1代胚胎骨骼相关基因有关。
孵化是斑马鱼胚胎发育的关键时期。延迟孵化可能是由于斑马鱼胚胎发育迟缓或胚胎无法打破绒毛膜而造成[34]。四环素能够影响斑马鱼的胚胎死亡率,且浓度越高死亡率越高[35],卵黄囊是胚胎唯一的营养来源,在胚胎发育早期起着重要的作用。随着胚胎的发育,卵黄囊的体积逐渐缩小[36]。本实验结果显示,TCH处理F0亲代斑马鱼30 d后,其F1代胚胎孵化率降低,死亡率升高,幼鱼卵黄吸收缓慢,心囊浮肿严重,畸形率显著上升,最终影响斑马鱼胚胎发育进程。这与本实验结果一致,表明斑马鱼F0亲代经TCH处理后,对F1代胚胎发育存在显著性影响。
头部软骨长度指示着软骨发育的程度。FQs类抗生素会在幼犬中引起软骨损伤,尤其是在负重滑膜关节软骨中[37]。另外,Goto等[38]给幼年大鼠短期饲喂氧氟沙星,会增加关节软骨中氧氟沙星的最大浓度值。实验研究发现,TCH造成F1代幼鱼下颌骨宽度和角舌骨长度与对空白照组相比均缩短,且下颌骨变长,夹角变小,两侧有缩短的趋势,可能是TCH处理后斑马鱼头部的部分软骨发育受到抑制作用,软骨发育减缓,才导致软骨长度缩短。和亲本经TCH暴露而影响F1代软骨发育相比,F0代胚胎经TCH暴露的实验表明,除了高浓度(100 μg·L-1) 造成严重的骨骼发育延迟和畸形外,低浓度(1 μg·L-1) TCH没有造成软骨发育的显著变化。
有研究表明,sox9a可以参与软骨细胞分化,而当软骨发育到一定时间,sox9a会受到明显抑制作用[39-40]。col2α1是编码胶原蛋白Ⅱ的基因,col2α1a基因在很多器官组织中都有表达,例如大脑、眼睛和心脏等,但它表达量最高的地方是在软骨[41-42]。col2α1a基因在组成细胞外骨架中具有重要作用,col2α1a基因的缺失会导致骨骼发育不良,在小鼠中表现为骨骼发育畸形,在人的症状上表现为内骨骼畸形、骨骼变短和缺失脑骺生长板等软骨成长不全症[43-44]。本实验研究结果表明,TCH处理后的斑马鱼F1代胚胎对骨骼相关基因的转录表达也有影响。由此初步认为由于软骨组织的产生增加或减少,runx1、sox9a、sox10和col2α1amRNA表达水平升高或下降可能是斑马鱼下颌骨、下颌弓长度加长,角舌骨、下颌骨宽度缩短及脊索和尾部弯曲的原因,但还需进一步研究确认。
综上所述,F0亲代斑马鱼经TCH处理30 d后,对F1代胚胎发育产生显著的影响。TCH造成F1代胚胎孵化周期延长,孵化率和死亡率升高。TCH对F1幼鱼软骨的发育造成显著影响,畸形率升高,且骨骼发育相关基因的表达水平显著下降。提示环境中TCH对下一代软骨发育有毒性影响,建议加强四环素类抗生素饲料添加的监管。
◆

