重组人金属硫蛋白-Ⅲα短肽毒性效应的初步研究
甘俊英,秦建新,原海亮,李强,薛玉英,*
1. 环境医学工程教育部重点实验室,东南大学公共卫生学院,苏州纳米科技协同创新中心,江苏省生物材料与器件重点实验室,南京 210009 2. 苏州汇涵医用科技发展有限公司,常熟 215500 3. 常熟市市场监督管理局,常熟 215500
金属硫蛋白(metallothionein, MT)是一类富含半胱氨酸、相对分子质量较低(6~7 kDa)的金属结合蛋白[1],包含2个独立结构域,即α结构域和β结构域。MT由Margoshes和Vallee于1957年首次从马的肾脏中分离出来,至今对MT的研究已走过半个多世纪,大多数研究集中在脊椎动物MT的结构、功能和基因调节等方面,研究成果丰富,涉及生物化学、卫生毒理学、食品科学、医学、农学和环境科学等各个领域[2]。由于MT特有的氨基酸组成与分子结构,其在机体内具有多种生物功能。首先,MT的特殊结构使得它具有和多种金属离子结合的能力,包括镉、锌、铅和铁等[3-4],MT可通过与金属离子的结合,降低重金属对机体的毒害,达到调节机体生理状态的作用[5]。有研究表明,MT还具有清除活性氧(reactive oxygen species, ROS)的功能[6-8],但其作用机理仍不清楚,一般认为其可以清除体内过多的自由基,从而降低氧化损伤程度[9]。癌症仍是当今医学界的一个瓶颈,据《2018年全球癌症统计数据》报道,2018年全球大约有1 810万癌症新发病例和960万癌症死亡病例,新增1 810万癌症病例中,亚洲占据近1/2,960万癌症死亡患者中,亚洲占近70%[10];已有多项研究探索了MT在多种恶性肿瘤中的表达,通过多种作用机制发挥促癌及抑癌的双重功能[11]。鉴于MT的多种生物功能,未来外源性补充MT具有广阔的应用前景,尤其是MT结合金属作用,其在植物中的表达可提高植物抗胁迫能力[12],已被应用到环境重金属污染的治理当中。
MT主要有4种异构体,MT-Ⅰ和MT-Ⅱ在大多数哺乳动物的内脏器官中广泛存在,尤以肝、肾细胞为主,而且参加其功能调节。MT-Ⅲ分布主要限于中枢神经系统,主要分布于星形胶质细胞和神经元中,还有少量分布于生殖细胞、小肠、胃、肾和嗅觉皮质细胞中。MT-Ⅳ存在于皮肤和胃肠道上部。目前,MT的获取途径分为3类,一是从动物组织中提取[13],二是从植物中提取[14],三是采用基因工程技术,将MT基因克隆至大肠杆菌或乳酸菌等宿主中进行发酵提纯[15],相对于前2种方法,第3种方法获取的MT纯度高,产品单一性好,性能更加稳定,特别是对人源MT蛋白的异源表达,使得人源蛋白产品的应用及产业化成为可能,同时人源蛋白机体同源性好,可以避免一些免疫原反应,在医药领域应用前景广阔。王欣卉等[16]利用体外抗氧化试验验证了酵母源金属硫蛋白具有清除自由基及抑制脂质过氧化的功能,表现出良好的抗氧化性。由于其抗氧化功能及低分子量的特性[17],MT将成为化妆品领域最佳的生物添加剂,与目前化妆品中常用的抗氧化添加剂(超氧化物歧化酶(SOD))相比,MT分子量低,更易被皮肤吸收。顾群和杜欣[18]将锌合MT加入到面霜中,利用家兔及豚鼠模型,从整体动物水平评价了锌合MT的皮肤毒性,而在细胞水平上对其皮肤毒性的探讨尚鲜见报道。
本研究针对大肠杆菌基因工程制备的重组人金属硫蛋白Ⅲα短肽(rh-MT-Ⅲα),以人永生化角质形成细胞HaCaT细胞和小鼠成纤维细胞L929细胞为模型,从细胞水平上评价其可能的毒性效应,进而利用秀丽隐杆线虫(Caenorhabditiselegans,C.elegans)为模型,进行了整体模型毒性评价,为rh-MT-Ⅲα的安全应用提供实验基础。
1 材料与方法(Materials and methods)
1.1 主要试剂仪器与细胞来源
1.1.1 材料与试剂
试验样品:重组人MT-Ⅲα短肽,商品名为重组人巯基短肽(rh-MT-Ⅲα),由苏州汇涵医用科技发展有限公司提供,是该公司利用大肠杆菌基因工程高密度发酵并纯化获得的人源金属硫蛋白Ⅲα亚基片段,分子量3.7 kD,每分子蛋白含游离巯基6个,蛋白SDS-PAGE纯度≥98%。
主要试剂:DMEM高糖培养液、胰蛋白酶(美国Gibco公司),胎牛血清(浙江天杭生物科技有限公司),磷酸盐缓冲液(PBS)(博士德生物工程有限公司),噻唑蓝(MTT)(美国Sigma公司),LDH试剂盒(碧云天生物公司),细胞凋亡试剂盒(美国BD公司)。磷酸二氢钾(KH2PO4)、磷酸氢二钠(Na2HPO4)、氯化钠(NaCl)、硫酸镁、蛋白胨、琼脂、磷酸钾、氯化钙、胆固醇、酵母提取物、胰蛋白胨、氢氧化钠、盐酸和次氯酸钠等(南京晚晴化玻仪器有限公司)。
1.1.2 主要仪器
3423型CO2培养箱(美国Thermo Scientific公司);Biobase生物安全柜(中国博科控股集团有限公司)、FSX型图像导航仪(日本Olympus公司)、5424R型离心机(德国Eppendorf公司);Epoch型酶标仪(美国Bio Tek公司);MVS-1型涡旋混合器(中国北京金紫光科技发展有限公司);BS-210S型电子天平(北京赛多利斯天平有限公司);MilliQ Advantage型超纯水系统(美国密理博公司);Olympus SZ61体视显微镜(日本Olympus公司);Eppendorf 5417R台式高速离心机(德国Eppendorf公司);SW-CJ-2F超净工作台(中国苏州净化设备有限公司);SHP150生化培养箱(中国上海精宏试验设备有限公司)
1.1.3 实验细胞及动物
HaCaT细胞是非肿瘤来源的人正常皮肤永生化角质形成细胞株,与正常人角质形成细胞分化特性相似,可以繁殖150代以上。本试验用HaCaT细胞购自上海名劲生物科技有限公司。
L929细胞是非肿瘤来源的小鼠成纤维细胞,购自上海名劲生物科技有限公司。
野生型秀丽隐杆线虫株(N2)取自美国明尼苏达大学线虫遗传中心(CaenorhabditisGenetic Center,CGC),雌雄同体。
1.2 实验方法
1.2.1 染毒溶液的配制
细胞试验:染毒液剂量依据现有研究试验剂量扩大10倍。使用完全培养基,将rh-MT-Ⅲα配制成浓度为2 mg·mL-1的原溶液,涡旋1 min混匀,染毒时利用完全培养基将原液稀释成浓度为25~400 μg·mL-1的rh-MT-Ⅲα溶液。线虫实验:使用超纯水,将rh-MT-Ⅲα配制成浓度为1 mg·mL-1的原溶液,涡旋1 min混匀,染毒时利用纯水将原液稀释成浓度为5、50和500 μg·mL-1的rh-MT-Ⅲα溶液。染毒液均现配现用。
1.2.2 剂量与染毒
(1)噻唑蓝(MTT)细胞活性试验:HaCaT细胞和L929细胞使用DMEM高糖培养基(含10%胎牛血清、100 U·mL-1青霉素和100 μg·mL-1链霉素)于37 ℃、5% CO2常规传代培养。观察细胞状态良好,调整细胞悬浮液密度为1×105个·mL-1,分别接种于96孔板(每孔0.2 mL)和6孔板(每孔2 mL)中,置于37 ℃、5% CO2培养箱中培养24 h。培养结束后,吸出原培养液,加入染毒液,剂量为25、50、100、200和400 μg·mL-1,完全培养基作为空白对照,继续培养24 h后,吸出染毒液,加入MTT,4 h后缓慢吸出MTT,每孔加入150 μL二甲基亚砜(DMSO),摇床10 min后,用酶标仪在490 nm处测OD值,计算细胞存活率。
(2)乳酸脱氢酶(LDH)释放试验:细胞培养同上,种板浓度为1×104个·mL-1。操作按照试剂盒步骤进行。LDH为胞内酶,一般在细胞外不能被检测到,只有在细胞膜损伤时,可释放到胞外而被检测到,是评判细胞膜完整性的一个重要指标。
(3)细胞形态学观察:种板浓度同MTT,种板6孔板,每孔2 mL。染毒剂量选择400 μg·mL-1,染毒时间为24 h。
(4)细胞凋亡:种板浓度及染毒剂量同MTT,种板6孔板,每孔2 mL。染毒24 h后,按照凋亡试剂盒步骤检测细胞凋亡指标。
(5)线虫试验:以剂量为5、50和500 μg·mL-1的rh-MT-Ⅲα溶液进行染毒,以同体积纯水为空白对照,以200 μL体积加入含菌OP50的3 cm培养基均匀覆盖,待其自然晾干后将同步化后L1期线虫转移至培养基上。染毒48 h后进行线虫运动行为(头部摆动和身体弯曲)、线虫生长发育(体长)和咽泵频率评价。
1.2.3 数据处理
采用SPSS Statistics 22.0软件进行数据分析,多组之间比较采用方差齐性检验和单因素方差分析(One-Way ANOVA)。两组之间比较,若符合方差齐性,则采用LSD-t检验方法,若方差不齐,则采用Games-Howell检验方法。实验数据均以mean±SD表示,检测水平为P<0.05,差异有统计学意义。线虫体长测量应用image J软件处理。
2 结果(Results)
2.1 细胞存活率及细胞膜损伤结果
rh-MT-Ⅲα对HaCaT细胞和L929细胞的存活率影响结果如图1所示,在实验剂量下,与空白对照组相比,实验组细胞存活率无明显改变,与对照组基本持平,400 μg·mL-1剂量下,细胞存活率出现了降低,但这些改变均未达到统计学上的显著性。L929细胞存活率总体趋势与HaCaT细胞相同,均为随剂量升高而呈现先升高后降低趋势。
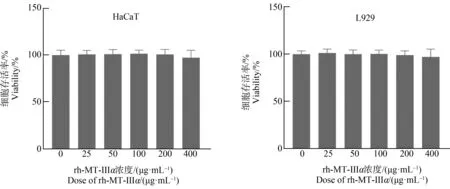
图1 重组人金属硫蛋白Ⅲα短肽(rh-MT-Ⅲα)对HaCaT细胞和L929细胞存活率的影响Fig. 1 Effect of recombinant human metallothionein Ⅲ-α peptide (rh-MT-Ⅲα) on survival rate of HaCaT and L929 cells
LDH检测结果如图2所示,与对照组比较,2种细胞的LDH释放率在400 μg·mL-1时显著升高,25~200 μg·mL-1剂量下,LDH释放率与对照组无明显差异。HaCaT细胞LDH释放率呈现先降低,后增高的趋势,L929细胞的趋势不明显。

图2 rh-MT-Ⅲα对HaCaT细胞和L929细胞乳酸脱氢酶(LDH)释放率的影响注:与对照组相比,* P<0.05,差异具有统计学意义;数据表示为均值±标准差。Fig. 2 Effect of rh-MT-Ⅲα on lactate dehydrogenase (LDH) release of HaCaT and L929 cellsNote: Compared with the negative control group, *indicates significant differences at P<0.05 level; data are expressed as mean±standard deviation.
2.2 细胞形态学观察结果
根据LDH实验结果,400 μg·mL-1时,细胞膜可能开始出现损伤,故选此剂量观察细胞形态学变化。2种细胞经rh-MT-Ⅲα染毒24 h后,光学显微镜观察结果如图3所示,在400 μg·mL-1剂量下,实验组细胞与对照组细胞连接均紧密,HaCaT细胞呈铺路石状,L929细胞呈梭形,2种细胞染毒组与对照组未出现明显差别。

图3 rh-MT-Ⅲα对HaCaT细胞和L929细胞形态的影响注:(a) 阴性对照组(完全培养基);(b) 400 μg·mL-1 rh-MT-Ⅲα溶液组;标尺为20 μm。Fig. 3 Effect of rh-MT-Ⅲα on morphology of HaCaT and L929 cellsNote: (a) Negative control group, complete medium; (b) 400 μg·mL-1 rh-MT-Ⅲα solution; scale is 20 μm.
2.3 细胞凋亡结果
2种细胞经rh-MT-Ⅲα染毒24 h后,细胞存活率及形态学观察与对照组相比均未显示出明显差异,但LDH释放量在400 μg·mL-1剂量下,明显升高,基于前期实验结果,推测可能由于rh-MT-Ⅲα对2种细胞的凋亡(尤其早期凋亡)产生了影响,故考察了rh-MT-Ⅲα对2种细胞凋亡率的影响,结果如图4所示,与对照组相比,2种细胞凋亡率均在400 μg·mL-1剂量下明显上升,尤其是早期凋亡率,为对照组的4倍~5倍。

图4 rh-MT-Ⅲα对HaCaT细胞和L929细胞凋亡的影响注:与对照组相比,* P<0.05,差异具有统计学意义;数据表示为均值±标准差。Fig. 4 Effect of rh-MT-Ⅲα onapoptosis of HaCaT and L929 cellsNote: Compared with the negative control group, * indicates significant differences at P<0.05 level; data are expressed as mean±standard deviation.
2.4 rh-MT-Ⅲα对线虫运动行为的影响
经rh-MT-Ⅲα染毒48 h后,检测线虫运动行为包括头部摆动和身体弯曲频率,结果如图5所示,染毒液以5、50和500 μg·mL-1剂量均匀覆盖含大肠杆菌的NGM线虫培养基后自然风干,加入L1期线虫延长暴露48 h,与对照组相比,实验组中头部摆动频率(20 s)及身体弯曲频率(60 s)无明显差异。

图5 rh-MT-Ⅲα对线虫运动行为的影响Fig. 5 Effect of rh-MT-Ⅲα on movement of C. elegans
2.5 rh-MT-Ⅲα对线虫体长的影响
L1期线虫延长染毒48 h后,用M9溶液清洗3遍,取出线虫,以100 μL 60 μmol·L-1的左旋咪唑溶液麻醉线虫1 min后用移液枪吸取适量线虫于载玻片上,于显微镜下观察每组线虫并捕捉图像,获取图像经由软件Image J处理测量,结果如图6所示,高剂量组(500 μg·mL-1)线虫平均体长为965.53 μm,中剂量组(50 μg·mL-1)线虫平均体长为996.80 μm,低剂量组(5 μg·mL-1)线虫平均体长为972.53 μm,与对照组平均体长((968.35±93.82) μm)相比,染毒组线虫体长未出现明显差异。
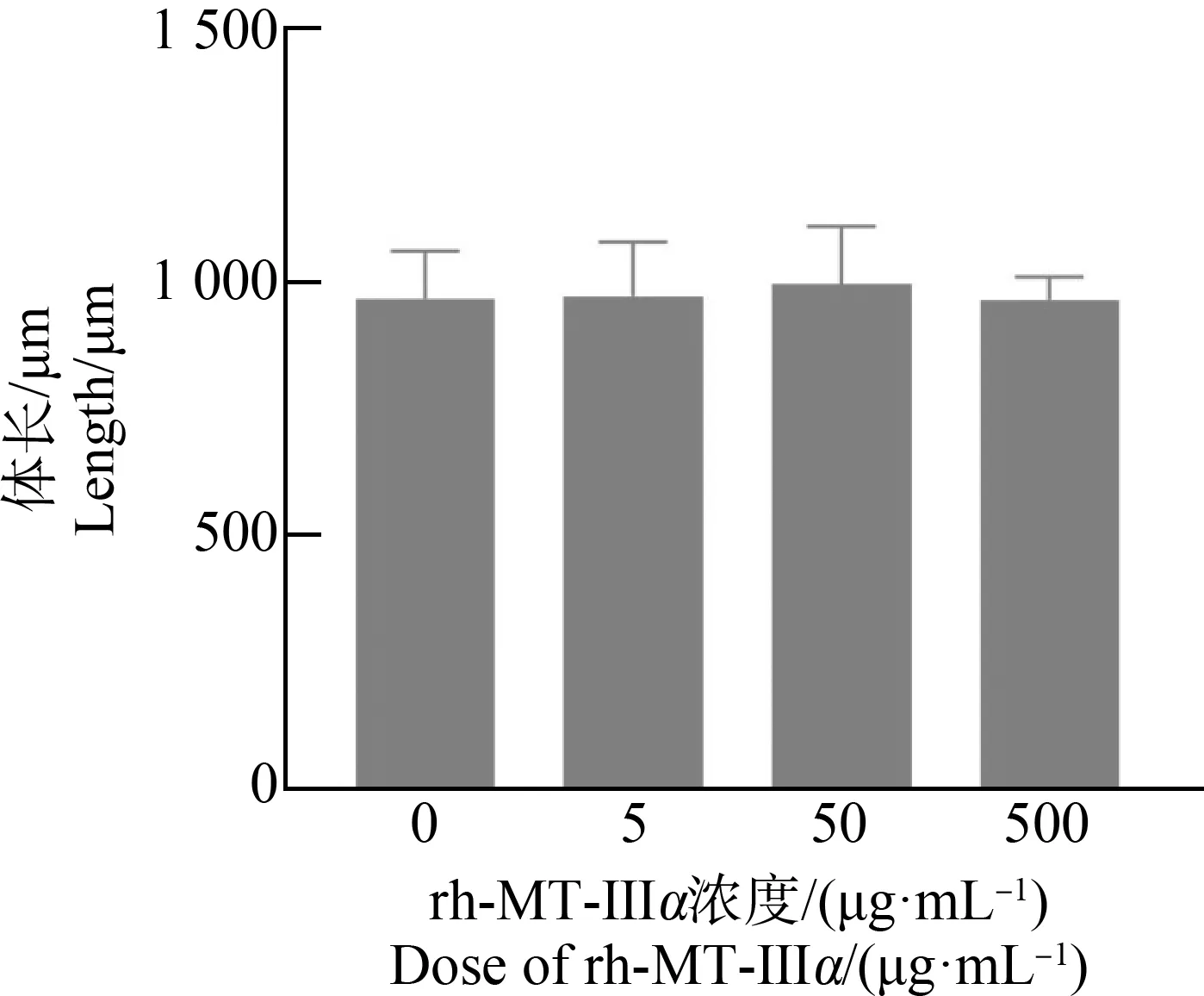
图6 rh-MT-Ⅲα对线虫体长的影响Fig. 6 Effect of rh-MT-Ⅲα on length of C. elegans
2.6 rh-MT-Ⅲα对线虫摄食行为的影响
不同浓度rh-MT-Ⅲα对线虫摄食行为的影响如图7所示,与对照组相比,染毒组线虫咽泵频率的变化无统计学意义。
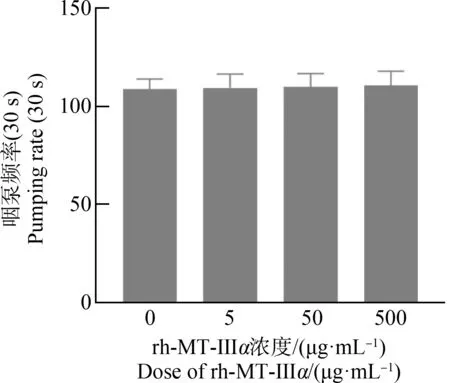
图7 rh-MT-Ⅲα对线虫咽泵频率的影响Fig. 7 Effect of rh-MT-Ⅲα on pumping rate of C. elegans
3 讨论(Discussion)
2种细胞存活率及形态学结果,在研究剂量下与对照组相比未显示出统计学差异,但存活率呈现先增高后降低的趋势。LDH释放率在400 μg·mL-1剂量时明显上升,表明细胞膜出现损伤,结合细胞凋亡结果分析,在凋亡初期,细胞应对外界刺激产生应激反应,早期凋亡细胞增多,可能部分细胞膜结构已经受到损伤。因此,在进行细胞毒性研究时,应结合2种以上试验方法以获得更加全面的细胞毒性效应评价。
MT具有和多种金属离子结合的能力,包括镉、锌、铅和铁等[3-4],利用这一特性可降低重金属对机体的毒害,发挥解毒和调节机体生理状态的作用[5]。线虫是一种自由生活在土壤中的生物,以细菌为食,易于在实验室培养且成本低廉、遗传学背景清晰[19],本研究选用秀丽隐杆线虫N2作为体内毒性评价模型,探讨rh-MT-Ⅲα对线虫的毒性效应。经不同浓度(5、50和500 μg·mL-1)rh-MT-Ⅲα延长暴露48 h后,与对照组相比,线虫运动行为(头部摆动和身体弯曲频率)、发育(体长)及摄食行为(咽泵频率)各生物学终点与对照组相比未显示出明显差异,说明rh-MT-Ⅲα在实验剂量下无明显毒性效应。其结果与细胞毒性中LDH释放率的结果不同,原因可能是由于线虫消化道对于rh-MT-Ⅲα的消耗或因为暴露时间较短,未来需要进行rh-MT-Ⅲα对线虫更长暴露下的毒性评价,以期更加全面地探讨rh-MT-Ⅲα应用的安全性。
本研究初步探讨了rh-MT-Ⅲα的细胞及线虫毒性效应,目前,实验室研究锌合金属硫蛋白作为化妆品添加剂的剂量为25 mg·kg-1[18],本研究选用的剂量范围是其2倍~16倍,更加确保了rh-MT-Ⅲα应用剂量的生物安全性。对于内源性及外源性MT功能的研究很多,主要认为其分子作用机制是可以降低机体氧化损伤水平及Caspase-3表达水平,通过P53通路抑制细胞凋亡[20]以起到保护功能。于立博[21]利用体内加体外实验,验证了外源性给予植物MT具有降低铅毒性作用,并利用酶联免疫法检测了组织中MT含量,结果发现,与阳性对照组比较,高剂量干预组巯基含量显著增加,证明外源性MT可被机体吸收,细胞实验证实了MT对于铅的解毒作用,但未涉及其进入细胞的方式和机体吸收。李晓伟和鲁曼[22]利用含MT制剂对铅中毒儿童进行干预,发现MT制剂能有效降低血铅浓度,但这个试验只是前后对照且干预前后间隔时间长,无法解释其排铅效用是由内源性MT过表达产生,还是外源性MT由胃肠道进入机体产生,对胃肠道对MT功能的影响试验结果也无法解释。徐炳政[23]体外模拟胃肠道环境,研究了胃肠道对外源性MT功能的影响,结果发现,模拟胃肠环境对酵母源MT巯基具有一定程度的破坏作用,但MT-Ⅰ与MT-Ⅱ在模拟胃肠环境中均能显著地螯合铅离子,并在12 h内能较好地抵抗模拟胃肠环境的消化,保持其螯合铅离子能力。在这些外源性MT功能实验中,其发挥作用是在胞外形成抗氧化环境而结合重金属,还是在胞内进行分子调控,尚不明确,未来对于完整MT尤其是基因工程这种新方式制备的MT片段如何进入细胞并被组织吸收的问题,尚需进一步研究。
MT几乎存在于所有哺乳动物中,是一类低分子量的胞内蛋白质,富含半胱氨酸,几乎无毒。MT由于其丰富的生物学功能,应用前景十分广阔,但由于目前动物肝脏提取这种方式获取量极少并且纯度不高,故近些年来,利用基因工程技术,采用大肠杆菌重组发酵的制备方式越来越受到关注,这种方式可大大提高MT产量和纯度,但其工业制备方法残余物可能会成为其产生毒性效应的原因。因此,对rh-MT-Ⅲα进行全面的生物安全性评价,对于确保其安全应用具有十分重要的意义。
◆

