典型环境污染物对肠道菌群的影响及机制研究进展
丁晗,周童,王娟,刘颖,许平,许安,*
1. 中国科学院合肥物质科学研究院,环境毒理与污染控制技术安徽省重点实验室,合肥230031 2. 中国科学技术大学,合肥 230026 3. 合肥市第一人民医院,合肥 230061
肠道,作为生物体宿主免疫和营养物质消化吸收的主要器官,定植有复杂的微生物群落(包括细菌、真菌、病毒和原生动物),被统称为肠道菌群[1]。肠道菌群主要分为3类:(1)生理性菌群,主要为专性厌氧菌和兼性厌氧菌,属优势菌;(2)条件致病菌,以兼性需氧菌为主,属非优势菌;(3)病原菌,极少长期定植,当其数目升高并超过阈值时,便可诱导疾病发生[2-3]。肠道菌群的主要功能如下。(1)营养作用。人体肠道菌群代谢产生的短链脂肪酸是结肠上皮细胞主要能量来源。此外,肠道菌群还能为人体提供蛋白质,合成非必需氨基酸,如天冬氨酸、丙氨酸、缬氨酸和苏氨酸等;(2)参与宿主重要代谢过程。肠道菌群将难溶性蛋白质转化为可溶性物质、多糖转化为单糖供人体吸收,参与酪蛋白水解、胆汁酸和胆固醇代谢等;(3)保护机体微生态平衡。肠道菌群通过定植拮抗作用抑制有害菌的入侵,维护机体与微生物之间的内环境稳定;(4)构建肠道免疫系统。由双歧杆菌、乳杆菌等组成的膜菌群防御致病菌或条件致病菌侵袭肠粘膜而产生非特异性免疫,此外,肠道菌群作为抗原,可激活宿主免疫系统的发育和细胞免疫的发生,发挥特异性免疫功能;(5)调控宿主身心健康。肠道菌群通过肠-脑轴对宿主的应激反应、焦虑、抑郁和认知功能产生重要影响[4-8]。肠道菌群受多种因素的影响,包括物种特异性、宿主基因型、生长发育时期和生存环境等[9-12]。因此,揭示肠道菌群的结构、组成、数量、比例以及代谢等特点,对于全面认识其在提高机体免疫功能、疾病的发生发展以及维持机体代谢稳态等方面具有重要的生理意义。
自2001年人类基因组序列的发表,人体健康与微生物共生作用的重要性已引起各国学者的广泛关注。2012年由美国国家卫生研究院(National Institutes of Health, NIH)资助的人类微生物组计划顺利完成[13];欧盟第七框架计划(7th Framework Programme, FP7)通过探索人类肠道中所有的微生物群落,进而评估人类肠道中细菌的种类,为揭示肠道微生物与人的糖尿病、心血管疾病和肥胖等疾病的关系提供理论依据[14-16]。伴随宏基因组学和高通量测序分析的飞速发展,越来越多临床与研究数据证实肠道菌群与人类健康密切相关。当人类宿主因自身免疫力下降、药物作用或其他内外因素导致肠道菌群失调时,将不同程度地影响肿瘤、代谢性疾病和免疫性疾病等多种疾病的发病率[17]。肠道菌群在消化系统肿瘤发生发展中具有重要作用,如幽门螺杆菌感染能够降低食管癌的发病率,也能够引起胃癌、慢性胃炎、消化性溃疡等疾病[18-20];机体肠道菌群的多样性和丰度的改变与代谢性疾病的发病率升高密切相关,如拟杆菌门和厚壁菌门数量的反向变化可能与肥胖的发生有关[21];肠道菌群可通过免疫调节及改变肠道通透性参与Ⅱ型糖尿病的发病[22]。肠道菌群能够在肠道水平参与病原微生物的防御以及肠道局部免疫系统稳态的建立,而肠道菌群的失调则可能导致宿主的免疫防御和免疫耐受功能失衡,进而影响局部甚至全身免疫系统的功能,最终在系统性炎症性疾病以及自身免疫性疾病的发病过程中起重要作用[23]。
环境污染物不仅影响肠道菌群的丰度和多样性,而且可以改变其代谢与功能[24]。与此同时,肠道菌群对环境污染进入人体后迁移转化、累积及毒性效应的影响也难以忽视[25]。肠道菌群作为间接影响宿主健康的潜在媒介,其对环境污染物的敏感性和特异性,已使其成为环境污染物健康风险及其毒理机制研究的新热点[26-27]。本文以重金属、微纳米颗粒污染物、持久性有机污染物以及抗生素为代表,系统总结了典型环境污染物诱导的肠道菌群紊乱及其对毒性效应的影响,为深入理解和阐释环境污染物毒理学效应及健康风险提供新的研究策略。
1 人体及模式生物中的肠道菌群研究(Research on gut microbiota in humans and model organisms)
1.1 人体
据统计,人体内菌群数目高达1014,约为人类体细胞总数的10倍[28]。人类肠道菌群以细菌为主,其中,拟杆菌门和厚壁菌门约占90%,同时与少量的古生菌、真菌和病毒等微生物共栖[29-30]。研究发现,人肠道菌群中约包含1 000~1 150种常见的细菌,且每个个体至少有160种,此类细菌物种在很大程度上具有共享性[15]。在人类长期的进化过程中,肠道菌群与宿主间,以及菌群、宿主与肠道内环境间保持着复杂的动态平衡,形成互利共生的动态生态系统。最新的研究结果显示,刚出生的婴儿并未携带肠道菌群;新生儿出生后,肠道菌群逐渐建立并随生长发育而不断完善,最终形成稳定的肠道微生物系统,由此婴幼儿与儿童时期被认为是人体肠道微生物形成的关键时期[31-32]。
1.2 小鼠
小鼠模型具有繁殖速度快、相关机制研究透彻、无菌环境建立容易、菌群移植及灌胃操作简单等特点,是目前研究“宿主-菌群”互作关系中最常用的哺乳动物模型。目前绝大多数肠道菌群相关机制研究都在该模型上进行验证,如“脑肠轴”理论便是在老鼠模型上发现并得到验证[33]。无菌小鼠模型较容易获得,大部分检测肠道菌群与某项疾病是否有关联的实验也都采用小鼠进行。以肠道菌群和恐惧消退实验为例,Chu等[34]发现,无菌组的成年小鼠有恐惧消退的学习缺陷,经单细胞测序发现,关键脑区内的兴奋性神经元和胶质细胞等多种细胞的基因表达改变,小胶质细胞不成熟,但在重新定植多样化菌群后,可恢复消退学习能力,实验证明了肠道菌群会影响消退学习。除了无菌模型外,小鼠还有很多成熟的疾病模型。在肠道菌群研究领域中,小鼠疾病模型可以让研究者对肠道菌群和疾病的因果关系有更深入的了解,如自闭症小鼠模型中和胆汁酸、色氨酸代谢相关的肠道菌群会引起肠道功能紊乱[35];毛螺旋菌(Lachnospiraceaebacterium)在小鼠肠道中定殖有助于肥胖小鼠糖尿病的发展[36]。
1.3 斑马鱼
斑马鱼是水生动物中常见的模型生物,它具有生长发育快、世代间隔短、研究机制较为通透、易于饲养等特点,广泛应用于生长发育、免疫和生理病理等研究领域[37]。斑马鱼肠道主要的优势菌有:放线菌(Actinobacteria)、拟杆菌(Bacteroidete)和蓝细菌(Cyanobacteria)等[38]。近年来,斑马鱼在肠道炎症模型中的应用越来越广泛,如Sun等[39]研究发现多环芳香烃类物质破坏斑马鱼肠道菌群组成最终诱导炎症反应;Jin等[40]研究发现微塑料干扰斑马鱼肠道菌群丰度和多样性最终诱导炎症反应。
1.4 蜜蜂
蜜蜂肠道菌群组成简单,具有高度保守和专门的核心肠道菌群。蜜蜂肠道菌群主要包括:艾维尔菌(Snodgrassellaalvi)、乳杆菌(Lactobacillus)等[41]。蜜蜂具有极强的识别和记忆能力,因此在神经生物学和社会生物学等领域具有很高的研究价值,研究发现,蜜蜂具有学习记忆中联想组合和提取信息的能力,通过舞蹈传递信息进行社会交往活动[42-43]。近年来蜜蜂常被用于研究环境污染物与宿主健康的关系,如Motta等[44]将蜜蜂暴露于草甘膦后,结果发现,草甘膦不仅改变了蜜蜂肠道菌群的组成还导致其死亡率升高。
1.5 果蝇
果蝇作为经典模式生物具有生长周期短、易繁殖的特点,在遗传学与基因组学的研究中发挥着重要的作用[45-46]。果蝇肠道微生物主要包括:醋杆菌(Acetobacter)、乳杆菌、肠球菌(Enterococcus)、肠杆菌(Enterobacteriaceae)[47]。近年来果蝇作为新型模式生物应用于免疫防御和肠道菌群关联的研究,如Buchon等[48]研究发现,果蝇摄入革兰氏阴性菌后,肠道免疫信号通路被激活;Nehme等[49]研究发现,果蝇摄入粘质沙雷氏菌后,肠上皮细胞损坏并诱导全身免疫反应。
1.6 秀丽隐杆线虫
秀丽隐杆线虫作为毒理学研究的经典模式生物,其具有生活周期短、身体呈半透明状,表型易于观察、结构简单等特征[50-51]。肠道是线虫重要的免疫器官,其肠道微生物组成主要包括:变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)[52-54]。近年来,线虫作为模式生物广泛应用于疾病感染研究,如Aballay等[55]建立鼠伤寒沙门氏菌在秀丽隐杆线虫肠道中增殖并持续感染模型,探究宿主和病原体之间的相互作用;Irazoqui等[56]探究铜绿假单胞菌和金黄色葡萄球菌引起线虫感染的机制及宿主效应。
2 典型环境污染物对肠道菌群影响(Effects of typical environmental pollutants on gut microbiota)
2.1 重金属
重金属污染指由重金属或其化合物造成的环境污染。我国原环境保护部和国土资源部对全国土壤污染状况进行了调查,发现我国土壤环境状况总体不容乐观,无机污染物超标点位数占全部超标点位的82.8%;从污染物超标情况看,镉、汞、砷、铜、铅、铬、锌和镍8种无机污染物点位超标率分别为7.0%、1.6%、2.7%、2.1%、1.5%、1.1%、0.9%和4.8%;其中,位点超标率最严重的3种重金属分别是镉、砷和镍[57]。资料显示,重金属污染物通过饮水、食物摄入等多种途径进入机体并与肠道菌群发生相互作用,干扰肠道屏障形成以及宿主代谢、免疫功能等[58-59]。
2.1.1 砷
砷(As)是一种类金属元素,国际癌症研究机构(International Agency for Research on Cancer, IARC)将其列为IA类环境致癌物[60]。自然界中As主要以有机砷化合物和无机砷化合物形式存在,无机砷化合物主要存在形式是As(Ⅲ)和As(Ⅴ),As(Ⅴ)进入哺乳动物体内通过还原反应转化为毒性更强的As(Ⅲ)[61]。Dheer等[62]的研究表明,As暴露后小鼠肠道梭状芽孢杆菌(Clostridium)、拟杆菌门(Bacteroidete)丰度升高,而厚壁菌门丰度降低,同时,As还可干扰机体能量代谢及其他新陈代谢过程。Chi等[63]将小鼠暴露于100 μg·L-1含As饮用水后发现,小鼠肠道中厚壁菌门丰度降低,疣微菌门(Verrucomicrobia)丰度升高,肠道菌群结构的改变与丙酮酸代谢异常以及代谢紊乱息息相关。Wang等[64]的研究显示,As暴露后小鼠肠道内粪杆菌(Faecalibaculum)丰度升高,而不动杆菌(Acinetobacter)、拟杆菌丰度显著降低,As和糖代谢相关酶(己糖激酶、丙酮酸脱氢酶)结合导致糖代谢出现异常,脂代谢相关基因(亚油酸、花生四烯酸)表达显著下降,癌症相关信号通路(Wnt、Notch、VEGF)异常激活,因此亚慢性As暴露最终引起小鼠糖脂代谢紊乱并增加小鼠罹患癌症的风险。
2.1.2 铅
铅(Pb)是严重危害人类生活与环境的有害物质之一,进入机体后对神经、造血和生殖等多个系统产生危害[65]。目前,常见的铅中毒大多属于轻度、慢性铅中毒,通过影响体内金属离子浓度和酶活性,引起植物神经功能紊乱、贫血、免疫力低下等[66]。Xia等[67]将小鼠暴露于0.1 mg·L-1PbCl2后,发现小鼠盲肠中厚壁菌和拟杆菌丰度显著下降,肝脏的肝甘油三酯(TG)和总胆固醇(TCH)水平上升,丙氨酸、异亮氨酸和丙二酸酯在内的15种代谢物含量发生了显著变化。Gao等[68]将小鼠暴露于10 mg·L-1PbCl2后,肠道菌群的组成发生了很大变化。与对照组相比,瘤胃球菌(Rumenococcus)、梭状芽孢杆菌丰度下降,肠道菌群结构的改变影响了胆汁酸代谢和胆固醇代谢,最终导致代谢功能紊乱。
2.1.3 镉
镉(Cd)具有致癌性,美国农业委员会把Cd列为当前最危险的一类农业环境污染物[69]。由于食物和饮用水是Cd暴露的主要来源,肠道成为Cd暴露的重要靶器官之一,特别是对肠屏障的破坏,进一步加剧了Cd的毒性作用[70]。Liu等[71]研究发现,Cd暴露可引起小鼠肠道内拟杆菌、双歧杆菌和乳杆菌丰度降低,肠屏障功能受损,肿瘤坏死因子(TNF-α)的表达水平升高。Ba等[72]的研究结果表明,成年雄鼠在生命早期暴露于低浓度Cd(100 ng·L-1)后,肠道中双歧杆菌(Bifidobacterium)和普氏杆菌(Prevotella)丰度明显降低,而鞘氨醇单胞菌(Sphingomonas)丰度增加,同时,机体的肝脂质代谢出现紊乱,增加了肥胖的风险。Ninkov等[73]将大鼠暴露于Cd后发现,大鼠肠道内乳杆菌相对丰度下降,肠道菌群结构的改变导致肠道炎症易感性有所升高。Lee等[54]将秀丽隐杆线虫暴露于Cd(1、2、4和6 mg·L-1)连续10世代,结果显示,线虫肠道内厚壁菌丰度显著升高,Mtl-2基因表达上调,揭示厚壁菌可能对Cd具有较强的抗性(表1)。
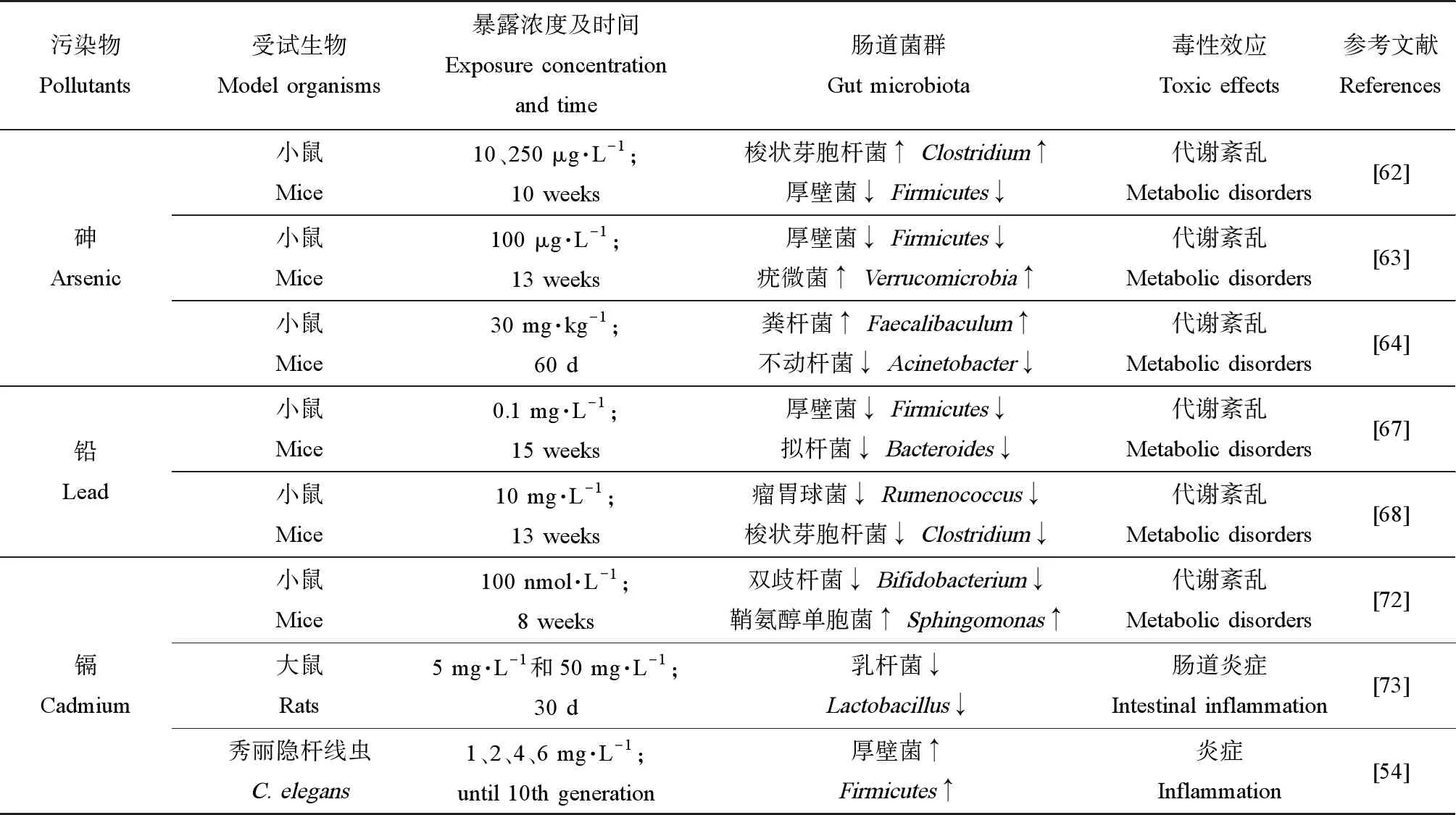
表1 重金属对不同模式生物体内肠道菌群影响及其毒性效应Table 1 Effects of heavy metals on gut microbiota in different model organisms and their toxic effects
2.2 微纳米颗粒污染物
2.2.1 大气颗粒物
大气颗粒物是大气中存在的各种固态和液态颗粒状物质的总称,包括粗颗粒物(PM10,2.5~10 μm)、细颗粒物(PM2.5,0.1~2.5 μm)、超细颗粒物(UFP,≤0.1 μm)[74]。大量流行病学调查表明,大气颗粒物可显著增加人体健康风险,导致心脏病、肺癌等疾病发病率上升[75]。流行病学调查发现,急性大气颗粒物暴露与非特异性急性腹痛入院率明显相关,长期慢性暴露则与炎症性肠病(IBD)发病率增加明显相关,表明大气颗粒物暴露与肠道菌群紊乱有联系[76]。
Li等[77]研究发现,小鼠摄入超细颗粒物(UFPs)后,肠道内疣微菌相对丰度增多,而放线菌、蓝细菌和厚壁菌相对丰度减少,促炎性脂质代谢产物(溶血磷脂酸、溶血磷脂酰胆碱)和胆固醇含量升高,前列腺素水平降低。Salim等[78]将小鼠暴露于PM10后发现,小鼠结肠促炎细胞因子增加,双歧杆菌丰度降低并向肠系膜淋巴结发生转移,肠道菌群结构的改变与小鼠白细胞介素水平降低、血清脂多糖增加以及能量代谢失调紧密相关。Fitch等[79]将小鼠暴露于PM后发现,小鼠肠道中的乳杆菌丰度显著降低,而梭状芽孢杆菌丰度增加,除此之外,小鼠肠道紧密连接蛋白(Occludin、Claudin)表达降低,TNFα、IL1β的转录水平显著升高。Li等[80]将小鼠暴露于UFPs后发现,小鼠在暴露前期肠道中乳杆菌丰度增加,随后乳杆菌丰度持续下降,肠道菌群失调诱导结肠上皮中CA9蛋白表达增强。
2.2.2 纳米颗粒物
纳米材料是一种由基本颗粒组成的粉状、团块状的天然或人工材料,直径在1~100 nm之间[81]。纳米材料由于具有比表面积大和表面缺陷而产生的一系列新的不同于宏观物质的特性,目前已被广泛应用于涂料、电子产品、化妆品、日用品和生物医药等众多领域[82]。纳米材料及相关产品在其生产—储存—运输—消费—处置或回收再生产的生命周期中通过各种途径直接或间接地进入到环境介质(如大气、水体、土壤和沉积物等)中,对生态系统和人类健康产生不可预知的影响[83]。
2.2.2.1 纳米银
纳米银(AgNPs)具有抗菌性和抗氧化性,在食品、化妆品和医疗用品等行业应用广泛[84]。Williams等[85]将SD大鼠暴露于AgNPs(9、18和36 mg·kg-1)中,结果发现,大鼠肠道厚壁菌门、乳杆菌属丰度明显降低,免疫调节基因(muc3、tlr2、tlr4、gpr43和foxp3)表达水平降低,揭示AgNPs在直接诱导肠道免疫反应的同时,也可以通过影响肠道菌群的结构而诱导免疫反应。Ma等[86]研究发现,将斑马鱼暴露于AgNPs(10、33和100 μg·mL-1)后,斑马鱼对AgNPs具有性别依赖性,AgNPs暴露后雄性斑马鱼肠道菌群丰度和多样性显著高于雌性斑马鱼。在雄性斑马鱼暴露组肠道梭杆菌丰度增加,变形菌丰度降低,而雌性斑马鱼暴露组肠道中梭杆菌和变形菌丰度没有明显变化。
2.2.2.2 纳米二氧化钛
2.2.3 微塑料
微塑料(microplastics)是一种新污染物,其广泛分布于海洋和陆地。微塑料分为初生微塑料和次生微塑料两大类,初生微塑料是指直接生产出来的直径<5 mm的塑料颗粒,次生微塑料是由废弃塑料经物理、化学和生物过程分解形成的微型塑料颗粒[92-93]。Lu等[94]研究发现,雄鼠暴露于1 000 μg·L-1的微塑料后,肠道内厚壁菌、α-变形杆菌和拟杆菌的丰度显著降低,肠道菌群结构的改变导致肝甘油三酯(TG)和总胆固醇(TCH)水平降低,与脂肪酸生成和TG合成有关的关键基因ATP-CitrateLyase(Acl)、Acetyl-CoACarboxylase(Acc)表达水平下降,揭示微塑料改变雄鼠肠道菌群的组成,进而影响雄鼠肝脂质代谢。Jin等[40]将斑马鱼暴露于1 000 mg·L-1微塑料后,肠道内拟杆菌和变形杆菌丰度降低,厚壁菌丰度升高,同时,IL1α、IL1β和IFN表达水平显著升高(表2)。

表2 微纳米颗粒污染物对肠道菌群影响及其毒性效应Table 2 Effects of micro-nanoparticle pollutants on gut microbiota and their toxic effects
2.3 持久性有机污染物
持久性有机污染物(persistent organic pollutants)是指大自然环境中很难降解所以持久存在的有机污染物,具有致癌、致畸、致突变效应[95]。有机氯农药、草甘膦是常见的持久性有机农药,多氯联苯作为合成有机物用途广泛,可作为热载体、润滑油等应用于生产生活[96]。
2.3.1 有机氯农药
有机氯农药(organochlorine pesticides)污染是多氯有机合成的杀虫剂所造成的环境污染。由于化学性质稳定、难于分解,1970年以来对大多数发达国家禁止使用有机氯农药。滴滴涕(DDT)是典型有机氯农药之一,在神经发育障碍、神经退行性疾病中具有潜在影响[97]。研究者将小鼠暴露于DDE(1 mg·kg-1)中,结果发现,小鼠肠道中厚壁菌、变形杆菌丰度增加,而拟杆菌、放线菌和疣微菌丰度降低,DDE改变了小鼠胆汁酸组成和其疏水性,胆汁酸代谢发生改变,胆汁酸代谢的改变可能诱导机体代谢紊乱[98-99]。
2.3.2 草甘膦
草甘膦(glyphosate)是农业使用最普遍的除草剂之一,其与人类多种疾病的发病率存在相关性,如肾脏损坏、癌症和神经系统疾病等[100-101]。Motta等[102]将蜜蜂暴露于草甘膦(5 mg·L-1)后,结果显示,肠道菌群的组成发生了很大改变,如双歧杆菌、乳杆菌和艾维尔菌丰度明显降低,蜜蜂长期暴露于草甘膦导致其死亡率增加。在另一项研究中,草甘膦却对蜜蜂没有明显的毒性效应。Blot等[103]将蜜蜂暴露于草甘膦(1.5 mmol·L-1和7.5 mmol·L-1),结果表明,蜜蜂肠道艾维尔菌丰度明显降低,而乳杆菌丰度增加,没有明显的毒性效应。将小鼠暴露于草甘膦(250 mg·kg-1和500 mg·kg-1)中连续12周,结果显示,小鼠肠道中厚壁菌、拟杆菌和乳杆菌丰度显著降低,进一步研究发现,肠道菌群结构与代谢产物的改变影响了色氨酸合成,而色氨酸是参与调控心理活动的重要神经递质,最终导致小鼠焦虑、抑郁的风险提高[104-105]。
2.3.3 多氯联苯
4月13日,宁夏回族自治区食品药品监督管理局印发《宁夏食品药品安全“黑名单”信息共享和联合惩戒办法》。《办法》规定,存在提供虚假证明、文件资料、样品或者采取其他欺骗、贿赂等不正当手段取得许可证或批准证明文件;伪造、涂改、倒卖、出租、出借、转让许可证或批准证明文件;受到吊销许可证行政处罚;一年内累计两次因违反食品药品相关法律法规规定受到责令停产停业处罚;逾期未主动履行行政处罚决定等情形的食品药品生产经营者或责任人员将被纳入黑名单。被纳入黑名单者,将在申请政府性资金支持、取得政府供应土地、申请办理行政审批等多个领域受到限制或惩戒。
多氯联苯(PCBs)具有致癌性,2001年《斯德哥尔摩公约》将多氯联苯列为公约受控物质之一,其主要存在于水体、土壤、大气中[106]。Cheng等[107]的研究表明,小鼠暴露于PCBs后,肠道菌群组成发生了很大改变。与对照组相比,肠道内阿克曼氏菌(Akkermansia)、梭状芽胞杆菌、肠球菌丰度显著增加,多氯联苯通过宿主肠肝轴与肠道细菌之间发生相互作用,导致胆汁酸代谢紊乱。Petriello等[108]研究发现,将小鼠暴露于PCB126(1 μmol·kg-1),肠道厚壁菌丰度显著增加,拟杆菌丰度降低,Cyp1a1基因上调,宿主肠道菌群失调、代谢紊乱而引起肠道和全身性炎症。Choi等[109]的研究表明,小鼠口服PCBs(150 μmol·kg-1)后,肠道变形杆菌的丰度显著降低,拟杆菌、放线菌丰度增加。PCBs不仅影响小鼠肠道菌群的结构,而且诱导肠屏障功能损坏以及免疫功能障碍(表3)。

表3 持久性有机污染物对肠道菌群影响及其毒性效应Table 3 Effects of persistent organic pollutants on gut microbiota and their toxic effects
2.4 抗生素
抗生素(antibiotics)是指用于杀灭或抑制存在于人类和动物宿主内细菌的天然、半合成或合成的化合物,在过去的几十年间,大量的抗生素产品被广泛应用于人类以及动物的临床治疗[110-111]。研究发现,抗生素被机体摄入吸收后,绝大部分通过粪便和尿液排出体外,对土壤和水体等环境介质造成污染,并且环境中积累的抗生素通过生物链对人体和动物健康产生威胁[112]。常见的抗生素根据其化学分子结构主要分为三大类别:β-内酰胺类(β-lactam antibiotics)、氨基糖苷类(aminoglycoside antibiotics)和多肽类(polypeptide antibiotics)。
2.4.1β-内酰胺类
Cox等[113]研究发现,小鼠暴露于低剂量青霉素(penicillin)后,肠道内乳杆菌、念珠菌(Candida)丰度显著降低。青霉素通过影响肠道菌群结构从而改变了宿主能量代谢,最终促进脂质堆积。Jin等[114]用青霉素(1 μg·g-1)处理小鼠后,结果发现,小鼠肠道内厚壁菌丰度显著降低,而拟杆菌和变形菌丰度升高,且肠道内促炎细胞因子IL-17表达水平以及辅助性T细胞17(T helper cell 17, Th17)含量显著下降[114]。在另一项研究中,小鼠摄入青霉素(60 μg·mL-1)后,结果显示,小鼠肠道内拟杆菌与厚壁菌的比例有所降低[114]。万群等[116]研究发现,小鼠暴露于头孢曲松(ceftriaxone)后,肠道菌群结构发生很大改变。与对照组相比,小鼠肠道内拟杆菌丰度显著降低,而肠球菌等肠道潜在病原菌丰度增加,这可能是导致小鼠肠粘膜损伤及肠上皮细胞功能低下的重要原因之一。Guo等[117]的研究表明,小鼠经头孢曲松(400 mg·mL-1)暴露后,肠道内肠球菌、埃希氏杆菌(Escherichia)丰度显著升高。
2.4.2 氨基糖苷类
Russell等[118]将小鼠暴露于链霉素(streptomycin)后,结果发现,小鼠肠道内紫单胞菌(Porphyromonadaceae)及拟杆菌相对丰度显著升高。Bazett等[119]的研究显示,小鼠经链霉素(200 mg·L-1)治疗后,肠道内乳杆菌丰度显著下降,同时,肺及肠系膜淋巴结中免疫细胞水平有所增加。Hammami等[120]研究发现,小鼠暴露于卡那霉素(kanamycin)后,肠道内双歧杆菌相对丰度显著下降。
2.4.3 多肽类
Isaac等[121]研究发现,人体摄入低剂量万古霉素(vancomycin)后,肠道内拟杆菌丰度减少,而变形菌、梭杆菌丰度显著增加,并且该变化在脱离万古霉素暴露后仍可持续很长时间。万古霉素不仅影响人体肠道菌群的组成,且增强了病原菌在肠道内定殖。Cheng等[122]将小鼠暴露于万古霉素(50 mg·kg-1)后,肠道菌群结构发生了显著变化。与对照组相比,肠道内拟杆菌、变形菌以及厚壁菌丰度显著下降。Kuno等[123]的研究显示,将小鼠暴露于万古霉素和多粘菌素B(polymyxin B)后,肠道内革兰氏阳性菌(主要为厚壁菌)和革兰氏阴性菌(主要为变形杆菌)相对丰度显著降低,抗生素暴露改变了肠道菌群的组成,从而导致小鼠能量代谢失调(表4)。

表4 抗生素对肠道菌群影响及其毒性效应Table 4 Effects of antibiotics on gut microbiota and their toxic effects
2.5 复合污染物
我国环境问题呈现从局部到整体、从单一污染到复合污染的特征。随着经济社会的快速发展,农业、工业活动产生的排放物在生态环境中共存,再加上各类降解产物,形成典型的复合污染现状,如农业活动常造成重金属和农药各组分发生相互作用,产生复合污染;工业生产中产生的高炉干渣、含重金属尘泥、生物污泥和各类粉尘,形成重金属复合污染、有机物复合污染、金属-有机物复合污染[124-125]。复合污染物的风险评估目前有2种方式:(1)整体评估,复合物组分及组分之间的相互作用未知;(2)基于混合物成分评估,确定混合物的组分及各个组分之间相互作用(加和/协同/拮抗)[126]。
双酚A(BPA)是世界上应用最广泛的工业化合物之一。BPA无处不在,食品和饮料瓶内侧涂层、医疗器材和牙齿填充密封胶中都有它的“身影”[127]。动物实验研究结果表明,BPA可使动物产生早熟、精子数下降等[128-129]。此外,其他研究表明,BPA具有胚胎毒性和致畸性,可导致动物卵巢癌、前列腺癌等疾病的发生[130]。TiO2NPs独特的理化特性可作为BPA载体,增加生物膜透过性并提高BPA生物体利用度,Chen等[131]研究复合污染物及其组分分别对雄性斑马鱼肠道菌群的影响,与对照组相比,单一TiO2NPs(100 μg·L-1)暴露后,斑马鱼肠道内厚壁菌、拟杆菌丰度升高,而变形菌丰度降低,TJP2蛋白表达水平增加;单一BPA (2 μg·L-1)暴露后,斑马鱼肠道放线菌丰度升高,血清素水平和IL1β蛋白表达量降低;单一BPA(20 μg·L-1)暴露后,斑马鱼放线菌丰度升高,而变形菌丰度降低,肠道血清素水平降低,IL1β表达水平升高;共暴露TiO2NPs(100 μg·L-1)和BPA(2 μg·L-1)后,斑马鱼肠道菌群结构没有显著变化,表明TiO2NPs和BPA在斑马鱼肠道中起拮抗作用;共暴露TiO2NPs(100 μg·L-1)和BPA(20 μg·L-1)后,斑马鱼肠道内厚壁菌显著升高,变形菌丰度降低,TJP2和IL1β蛋白表达水平升高,表明TiO2NPs和BPA在肠道中起协同作用。Chen等[132]研究发现,大鼠暴露于空气污染物(PM2.5、SO2、NO2和CO)中连续90 d后,肠道菌群多样性显著降低。与对照组相比,肠道拟杆菌、变形杆菌丰度降低。
3 环境污染物和肠道菌群的作用机制(Interaction mechanism between environmental pollutants and gut microbiota)
肠道菌群的结构与功能是衡量肠道微生态的重要指标[133]。肠道菌群结构与菌群的数量和种类有关,而肠道菌群的功能则与菌群代谢活动以及终产物有关[134]。环境污染物影响肠道菌群作用机制包括:(1)不可分解的环境污染物进入肠道,直接破坏了肠道稳态,扰动肠道菌群,改变其多样性;(2)可被分解的环境污染物参与了肠道菌群的代谢,改变了肠道菌群代谢活性,从而影响宿主生理功能,并通过新的代谢产物发挥其毒性效应,如图1(a)所示。环境污染物影响肠道菌群的结构和功能,从而对机体产生毒性效应。反之,肠道菌群也可以通过还原、裂解、功能性基因转移、水解以及酶促等化学反应来代谢环境污染物,从而调控环境污染物对机体的毒性效应,因此肠道菌群对环境污染物的影响也是不可忽视的[135]。肠道菌群影响环境污染物作用机制包括:(1)环境污染物进入胃肠道后通过肠道蠕动到达小肠远端和盲肠,最终被胃肠道微生物群直接代谢[136-137];(2)环境污染物进入胃肠道容易被吸收,经门静脉血液运送至肝脏,再通过肝脏氧化后进一步与葡萄糖醛酸、硫酸盐、谷胱甘肽结合形成共轭体,共轭体再和胆汁酸一起进入肠道并和肠道微生物发生相互作形成容易被肠道吸收的小分子代谢物或形成新的有毒代谢物[138-139],如图1(b)所示。
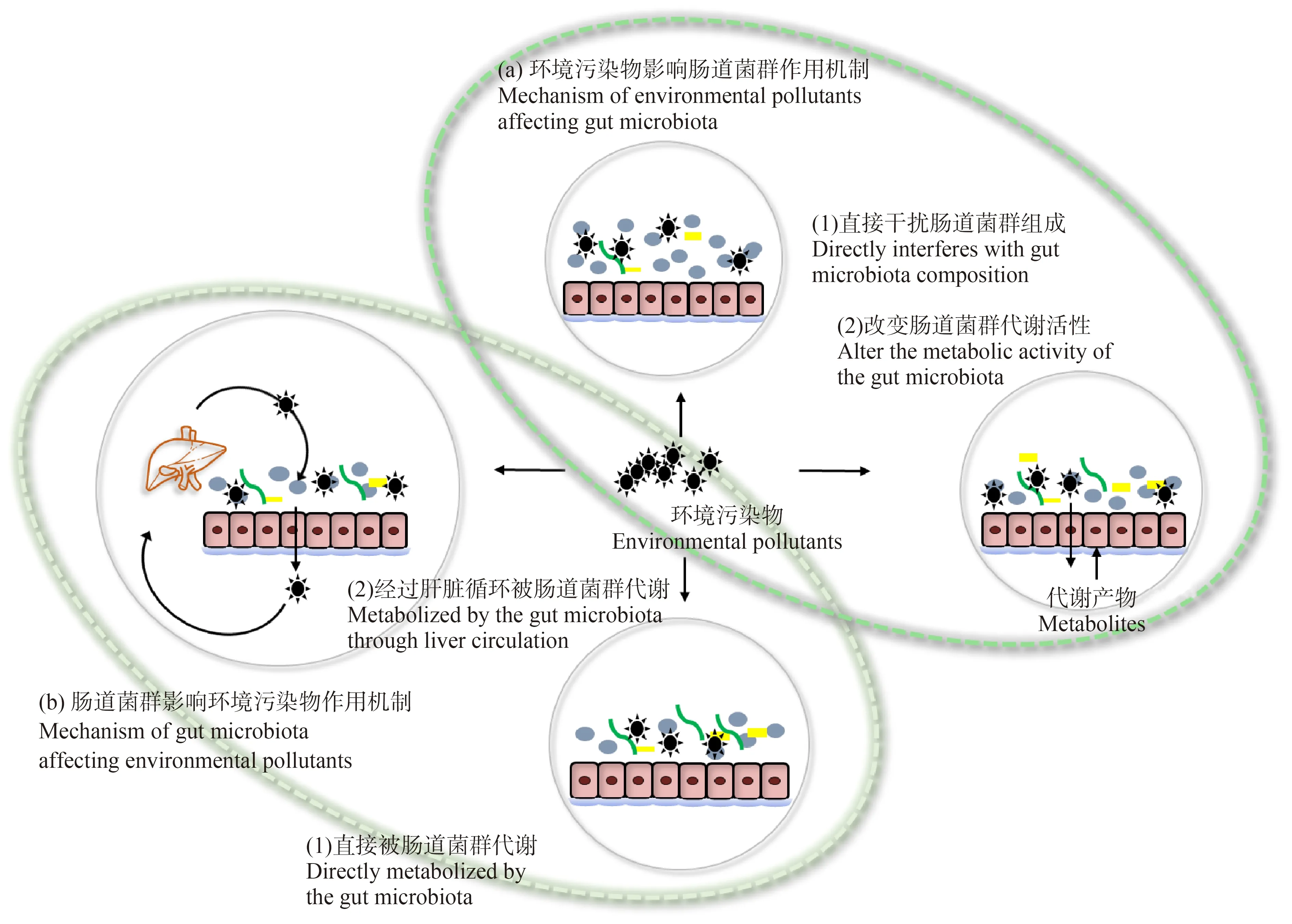
图1 环境污染物与肠道菌群相互作用示意图Fig. 1 Schematic diagram of the interaction between environmental pollutants and gut microbiota
宿主在环境污染物作用下肠道菌群组成和代谢发生变化,不仅诱导肠道菌群失调也改变了小分子代谢物的活性和对异常代谢物的清除能力,增加肠道对有害物的易感性,从而导致各种疾病的发生。
4 研究展望(Research outlook)
肠道菌群是维持机体内环境稳定的重要因素之一。越来越多的研究表明,进入体内的环境污染物可以引发肠道菌群结构、组成、数量、比例和代谢的改变,而菌群失调将会导致一系列的健康问题,包括肠道疾病(如克罗恩病、肠易激综合征、便秘、腹泻、胀气和消化不良等)、代谢综合症(高血脂、高血压、肥胖和糖尿病)、免疫力低下、心脏病、营养不良、过敏、哮喘、癌症和精神疾病(如抑郁症和自闭症)。尽管目前肠道菌群在环境污染物健康效应中的调控作用已引起人们的关注,并希望通过调控肠道菌群作为慢性代谢性疾病、心血管疾病以及恶性肿瘤的潜在治疗新靶点,但是相关机制研究正处起步阶段。现有的研究结果表明,环境污染物的种类和剂量会对肠道菌群的结构、功能及代谢产生影响,然而由于环境污染物的多样性,肠道微生态的复杂性和不稳定性,使得研究结果多基于现象描述,缺乏系统的机制研究。究其原因主要有:(1)肠道菌群不同于生物学表型,它存在可逆的过程,目前受限于技术,无法对肠道菌群进行实时的观测记录;(2)肠道菌群受环境、个体等不确定因素的影响巨大。目前的大部分研究处于起步阶段,并没有一种公认的成熟的方法去探究机制。
因此,在未来的研究中,一方面需要完善实验设计方案,减少操作误差,扩大样本数量,让相同实验条件暴露后的结果趋于一致,增加结果的可信度和说服力;另一方面,需要进一步探究机制关系并建立方法,从深层次的分子机制、代谢通路、污染物和肠道菌群的理化互作关系等物理化学多个角度去探究肠道菌群发挥作用的机制。让环境污染物与肠道菌群的研究更加的标准化,更具有科学依据。此外,如何通过改变肠道菌群来拮抗或者减弱环境污染物的影响,也是未来需要重点关注的方向。通过改变肠道菌群预防污染物带来的毒性效应,有着重要的生物学意义和良好的临床医学应用前景。
◆

