圈养条件下不同年龄孟加拉白虎的肠道菌群研究
苏 凯 雷 英 金修哲 李金邦
(太原动物园,太原,030009)
肠道中的细菌菌群因物种不同而不同,也因饮食、年龄、栖息地、疾病等因素而不同[1-2]。大量研究发现[3-5],肠道微生物区系的动态平衡与宿主的免疫、发育、营养吸收和能量代谢息息相关,在维持宿主健康方面的潜在意义日益凸显。因此,肠道菌群研究在保护濒危动物领域受到越来越多的关注[6-7]。He等[8]研究发现,与母乳喂养的东北虎(Pantheratigrisaltaica)幼崽相比,哺乳山羊奶的幼崽肠道内益菌较少,致病菌较多,微生物多样性较高。Butowski等[9]发现在高蛋白、高脂肪的生红肉日粮中添加植物性膳食纤维,可以改变家猫(Feliscatus)的粪便细菌群丰度和有机酸质量浓度。
孟加拉白虎(Pantheratigristigris,以下简称白虎)是孟加拉虎的白化变种,数量稀少,目前全部为人工饲养,由于其基因突变导致的高度遗传缺陷,使其在饲养管理和繁殖育幼上存在较大难度。
通过16S rDNA测序技术对特定环境样品中所有的细菌进行高通量测序,以研究环境样品中微生物群体的组成,解读微生物群体的多样性、丰富度及群体结构,探究微生物与环境或宿主之间的关系渐成主流[10-11]。本研究通过高通量测序技术分别对圈养条件下亚成年和成年白虎的肠道菌群进行研究,旨在探明其肠道优势菌群,分析对比不同年龄白虎肠道微生物组成的差异,为提高白虎的饲养管理水平和疾病防治能力提供理论基础。
1 材料与方法
1.1 材料
同等饲养条件下的白虎,用灭菌采样管分别挑取10只白虎当日清晨的新鲜粪便,其中2.0—2.5岁的亚成年白虎5只,记为SAWT组;10.0—12.0岁的成年白虎5只,记为AWT组,样品标记清楚后置于干冰上,采样结束后全部-80℃保存。
1.2 微生物组总DNA提取
将2组样品分别混合均匀后,利用E.Z.N.A.®Stool DNA试剂盒(Omega,USA)提取微生物组总DNA,并通过琼脂糖凝胶电泳检测DNA提取质量,同时采用紫外分光光度计对DNA进行定量。
1.3 PCR反应
采用引物341F:5′-CCTACGGGNGGCWGCAG-3′;805R:5′-GACTACHVGGGTATCTAATCC-3′;靶向扩增16S rDNA的V3—V4片段。PCR反应体系(25.0 μL),Phusion®Hot start flex 2×MasterMix 12.5,模版DNA 50 ng,上下游引物(10 μmol/L)各2.5 μL,超纯水加至25.0 μL。反应条件为,95℃预变性30 s;98℃变性10 s,54℃退火30 s,72℃延伸45 s,35个循环:72℃延伸10 min。
1.4 产物纯化和文库构建
PCR产物经过AMPure XT beads(Beckman Coulter Genomics,Danvers,MA,USA)纯化,Qubit(Invitrogen,USA)定量。通过扩增子池进行测序,扩增子文库的大小和数量分别在Agilent 2100生物分析仪(Agilent,USA)和Illumina(Kapa Biosciences,Woburn,MA,USA)的文库定量试剂盒上进行评估。
1.5 高通量测序和数据分析
样品在Illumina NovaSeq平台上按照制造商的建议进行测序,由LC-Bio提供。根据样品独特的条形码,将配对端序列分配给样品,并将建库引入的条形码和引物序列去除。使用FLASH合并匹配端读取。根据fqtrim在特定的过滤条件下对原始读数据进行质量过滤,以获得高质量的clean标签。使用Vsearch软件对嵌合序列进行过滤,利用DADA2进行解调,得到特征表和特征序列。Alpha多样性通过归一化到相同的随机序列来计算。然后根据SILVA分类器,利用每个样本的相对丰度对特征丰度进行归一化。Alpha多样性用于分析样本物种多样性的复杂性,包括Chao1、Observed species、样品文库覆盖率(goods coverage)、香农指数(Shannon)、辛普森指数(Simpson)5个指标,这些指标均由QIIME2计算得出。
2 结果与分析
2.1 白虎肠道菌群样品测序有效数据统计
对原始下机数据进行双端拼接、质量控制、嵌合体过滤后,进行高质量数据统计,10份白虎粪便样得到原始序列共计834 978条;质控后的序列共计694 506条,Q20、Q30和GC比例均属于合理区间(表1),样品质控后的序列长度为400—500 bp(图1)。
2.2 亚成年和成年白虎肠道菌群的Alpha多样性
对2组样品结果进行Alpha多样性分析(表2),利用Chao1指数评估样本中特征序列(OTU)数目多少,Chao1指数越大,特征序列数目越多,说明丰富度越高。结果中Chao1指数为70.00—277.05,表明丰富度不高;香农和辛普森数值越大,说明群落多样性越高,均一性越好。图2和图3为丰富度指数和香农指数的稀释曲线,从图中可以看出,当测序量达到5 000时,各样品的特征序列数目增加基本趋向平缓,说明更多的数据量只会产生少量特征序列数目,表示该试验的测序数据量合理。亚成年和成年白虎所有样品丰富度曲线,均已经达到平缓的走势,这也反映了样品量较为合理。样品文库覆盖率均为1,试验结果能很好地反应微生物群落情况。
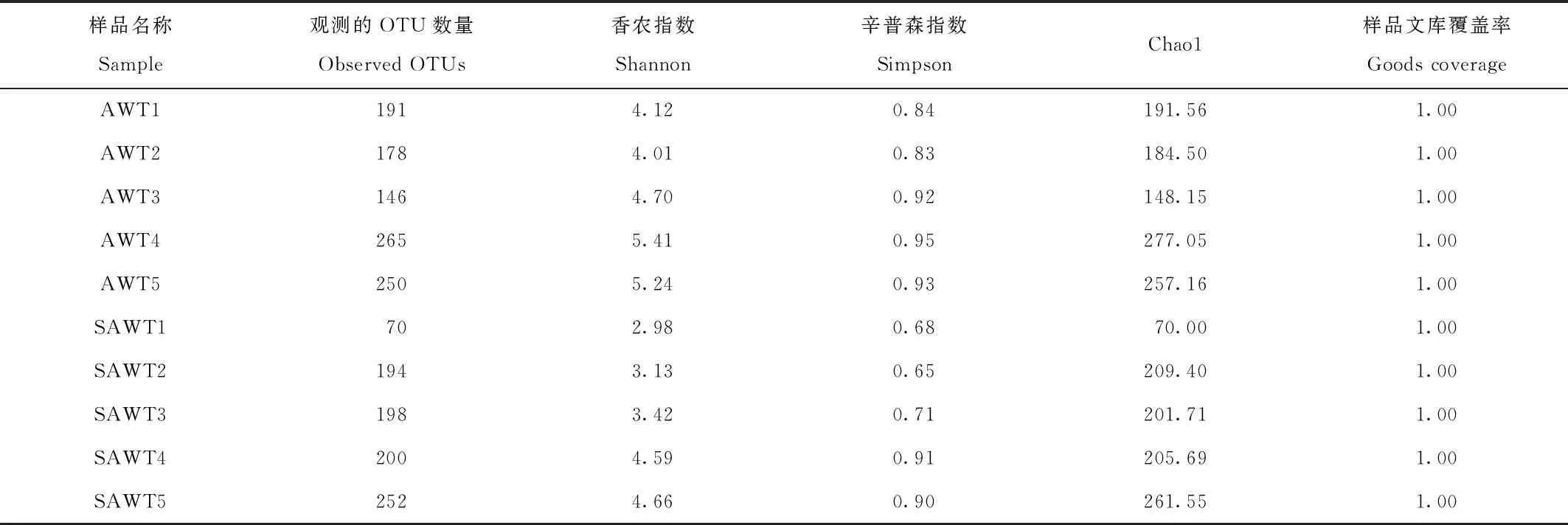
表2 成年和亚成年白虎肠道菌群Alpha多样性
2.3 白虎肠道菌落组成
2.3.1 菌群OUT数目组的相似性及重叠情况
通过QIIME2检测得到亚成年和成年白虎样品中共包含特征序列ID(OTU)877个,其中亚成年白虎特有特征序列299个;成年白虎特有特征序列353个,2组共有的特征序列225个(图4)。
2.3.2 门水平上的菌群组成及其丰富度
图5和图6是根据物种丰度表和物种注释表,默认选取丰度最高的30个物种分类,展示每个样本以及分组的相对丰度的柱状堆叠图。在10组白虎的样本中,丰富度较高的有5个菌门,其中放线菌门(Actinobacteria)在两组样本中所占比例最高,平均含量达45.3%,其次是厚壁菌门(Firmicutes),平均含量为37.3%,另外,梭杆菌门(Fusobacteria)平均含量为7.9%,变形菌门(Proteobacteria)为7.1%,拟杆菌门(Bacteroidetes)仅为2.1%。
2.3.3 属水平上的菌群组成及其丰富度
在10份白虎的粪便样本中,柯林斯菌属(Collinsella)所占比例最高,平均含量达43.8%,梭杆菌属(Fusobacterium)和布劳特氏菌属(Blautia)分别占到7.9%和7.5%,瘤胃球菌类群(Ruminococcusgnavusgroup)为7.0%,其余埃希氏菌属-志贺氏菌属(Escherichia-Shigella)、拟杆菌属、消化链球菌属(Peptostreptococcus)以及狭义梭菌属1(Clostridiumsensustricto1)、Paeniclostridium、链球形菌属(Catenisphaera)平均含量都不足3.0%。图7和图8是将每个样本以及分组的相对丰度进行不同形式的热图。图中色块越靠近红色表示某份样品对应的某一物种比例越高,反之,色块越靠近蓝色表示某份样品对应的某一物种比例越低,图中可以看出,亚成年白虎组的物种丰度变化更加丰富,亚成年和成年白虎组间的物种多样性存在差异。
2.4 亚成年和成年白虎肠道菌群组间物种差异
根据样品物种丰度表,利用LEfSe方法[12]分析并得出样品组间进化分支图(图9)。图9中不同圆圈层从内至外辐射分别代表界、门、纲、目、科、属、种7个分类级别,各个节点代表该水平下的一个物种分类,该物种丰度越高节点越大。其中节点颜色为黄色的表示该物种在比较组中无显著性差异,如果节点颜色为红色则表示该物种在比较组中有显著性差异,且该物种在红色分组中的丰度更高,其他颜色以此类推。
LDA评分直方图(图10)显示各组间具有统计学差异的生物学标志。由图10可见,亚成年和成年白虎组间具有明显的微生物种群差异。亚成年组的微生物种类中梭杆菌门和拟杆菌门明显低于成年组(P<0.05);琥珀酸弧菌属(Succinivibrio),Eggerthellaceae科未分类属(Eggerthellaceae unclassified),巨单胞菌属(Megamonas),梭杆菌属,瘤胃球菌属等显著低于成年组(P<0.05);而肠球菌属(Enterococcus),乳球菌属(Lactococcus),狭义梭菌属2(Clostridiumsensustricto2),乳酸菌属(Lactobacillus),链球菌属(Globicatella),放线菌属(Actinomyces)显著高于成年组(P<0.05);其中亚成年组特有的有狭义梭菌属2、乳球菌属、明串珠菌属(Leuconostoc),成年组特有的为琥珀酸弧菌属、Eggerthellaceae科未分类属、气单胞菌属(Aeromonas),LDA值分布柱状图与进化分支图的结果是一致的。
3 讨论
本研究结果表明,在门水平上,亚成年与成年白虎各样品肠道菌群中的变形菌门、厚壁菌门、放线菌门和梭杆菌门是优势菌群,与和凤平[13]研究基本一致,不同的是,在圈养东北虎肠道微生物组中相对丰度最高的是变形菌门(45.25%),而本研究的孟加拉白虎菌群中,放线菌门丰度最高,为45.30%,变形菌门为7.10%。在属水平上,本研究发现柯林斯菌属最为优势(43.80%),这也与之前的相关研究[8,14]一致。
Karmacharya等[15]在对尼泊尔境内的孟加拉白虎肠道菌群研究分析后得出其丰度最高的是变形菌门(37.1%),在其栖息地的土壤分析后也得出了相似的结果(32.9%),这说明不同的栖息环境对动物肠道菌群有一定影响。
刘广帅[16]在对雪豹(Pantherauncia)肠道菌群分析后也得出,多样性最高的分别是厚壁菌门、放线菌门、拟杆菌门和变形菌门;AN等[17]在对3种圈养的肉食动物豹猫(Prionailurusbengalensis)、水獭(Lutralutra)和貉(Nyctereutesprocyonoides)做肠道微生物分析也得出丰度较高的是拟杆菌门、变形菌门、厚壁菌门和放线菌门。由此可见,对哺乳动物尤其是肉食性动物来说,优势菌群是相对固定的[18-20],比例高低各有不同是由物种基因差异、年龄、动物食性以及栖息环境不同导致的[21],同时也说明本研究的结果是合理的。
组间物种差异分析显示:成年组白虎的梭杆菌门和拟杆菌门明显高于亚成年白虎组(P<0.05);在属水平上,亚成年组的梭杆菌属,巨单胞菌属,Eggerthellaceae科未分类属,琥珀酸弧菌属,活泼瘤胃球菌属等显著低于成年组(P<0.05);而乳杆菌属,肠球菌属,乳球菌属,狭义梭菌属2,放线菌属等显著高于成年组(P<0.05);Deusch等[22]曾经对18、30和42周龄的幼猫(雄性16只,雌性14只)粪便的纵向研究结果发现,18周龄时微生物群落以乳杆菌属和双歧杆菌属(Bifidobacterium)为主(平均丰度分别为35%和20%);42周龄时最丰富的属为类杆菌属(Bacteroides,16%)和普氏杆菌属(Prevotella,14%)。Peng等[23]研究发现不同年龄圈养大熊猫(Ailuropodamelanoleuca)的肠道细菌组成不同,尤其是乳杆菌属的含量老年大熊猫显著地低于成年大熊猫。Vaiserman等[24]也曾指出不同年龄段的人肠道微生物区系在主要微生物门水平上的组成有显著差异,放线菌门和厚壁菌门相对丰度增加,拟杆菌门相对丰度减少。
综上,当饮食和环境受到控制时,孟加拉白虎的粪便微生物群主要是由年龄决定的。随着年龄变化,菌群的种类以及丰度都会发生相应变化,其相关功能的变化有待进一步研究。

