miR-142-5p通过负调控M2型肿瘤相关巨噬细胞中HGF的表达抑制非小细胞肺癌细胞的增殖
杨超, 刘贝,魏微,胡芬, 姚洋,孙志华
(湖北文理学院附属医院, 襄阳市中心医院 肿瘤科,襄阳 441000)
肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)是指浸润于肿瘤间质中的巨噬细胞(macrophage, M)[1]。TAM长期在肿瘤微环境下会逐渐形成独特的表型,同时在功能上也会发生明显改变。根据活化状态和功能,TAM可以分为M1和M2型[2-3]。研究发现,在人类常见的多种肿瘤中,TAM随肿瘤发展而逐渐以M2型为主,M2型巨噬细胞(M2 macrophage,M2-M)更有助于肿瘤的生长、侵袭和转移[4-6]。因此,有效调控肿瘤微环境中的TAM表型有望成为肿瘤治疗的方向之一。肝细胞生长因子(hepatocyte growth factor,HGF)是M2-TAM在肿瘤微环境中分泌的一种重要的细胞因子[7]。为了解在非小细胞肺癌中HGF以及M2-TAM的作用,本研究探讨了HGF及其上游靶基因miR-142-5p在以M2-TAM为主的非小细胞肺癌中的功能,同时验证M2-TAM对非小细胞肺癌的促生长和转移作用。
1 材料与方法
1.1 材料与试剂小鼠RAW264.7巨噬细胞和小鼠肺癌Lewis细胞由襄阳市中心医院医学实验中心保存,10% FBS、青霉素和链霉素购自Invitrogen公司,RPMI 1640和DMEM培养液购自Life Technologies公司,Transwell小室、培养板购自Corning公司,TRIzol RNA提取试剂盒、Thermo反转录试剂盒购自Thermo Fisher Scientific公司,RNA纯化试剂盒和RT-PCR试剂盒购自QIAGEN公司,ELISA试剂盒购自联科生物公司,CCK-8、PBS和RIPA裂解缓冲液购自Beyotime Biotechnology公司,ELISA检测仪购自Thermo公司,IL-4购自Sigma公司,Matrigel购自Bio-Rad公司,荧光素酶活性检测试剂盒以及HGF-Wt和HGF-Mut质粒购自Promega 公司,si-HGF (EMU037921-20UG)购自Sigma-Aldrich公司。抗鼠CD206-PE抗体和CD163-FITC抗体购自BD Pharmingen公司。FACSCallibur流式细胞仪购自BD公司。
1.2 方法
1.2.1 细胞共培养 将1×105个/mL的小鼠M和肺癌Lewis细胞均分别接种到含10%灭活FBS的完全RPMI 1640培养液中,在37 ℃、 5%CO2完全饱和湿度条件下常规培养,每2~3 d传代1次,取处于对数生长期的细胞进行试验。采用100 μg/mL的IL-4在体外将M诱导成为M2-M,通过Transwell系统将M与小鼠肺癌Lewis细胞共培养,得到M2-TAM和普通TAM。
1.2.2miR-142-5p、CD206、CD163和HGFmRNA表达的RT-PCR检测 取上述收集到的细胞,按照TRIzol试剂使用说明书抽提总RNA,采用Thermo NanoDrop 2000分光光度计检测其浓度和纯度,并采用Agilent-2100凝胶电泳系统检测总RNA的完整性。应用Primer 5.0软件设计引物(表1),以GADPH为内参。引物由TaKaRa公司合成。将TRIzol法提取得到的2组细胞总RNA反转录成cDNA。反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,共45个循环。同时扩增各个样本的目的基因和内参基因,每组细胞设计3个重复孔。通过GAPDH基因水平校正,采用2-ΔΔCt分析法检测CD206、CD163、miR-142-5p和HGFmRNA的相对表达量。

表1 试验所用的引物序列
1.2.3 CD206、CD163的FACS检测 分别采用PE标记抗CD206,FITC标记抗CD163单抗处理细胞,FACS检测细胞表面CD206和CD163的表达,试验重复3次,采用Cellquest软件分析结果。
1.2.4 HGF、TGF-β、血管内皮生长因子(vascular endothelial growth factor,VEGF)和IL-10的ELISA检测 将处于对数生长期的各组细胞接种至6孔板,每组重复4个孔,继续培养48 h。收集细胞上清液,以4 ℃ 1 000×g离心10 min。取离心后的上清液,采用ELISA检测HGF、TGF-β、VEGF、IL-10的水平。
1.2.5 miR-142-5p和HGF靶向关系的验证 合成含有荧光素酶基因的HGF野生型质粒(HGF-Wt)和突变型质粒(HGF-Mut)。用dual-luciferase reporter assay system (Promega公司)实施荧光素酶报告基因检测试验。将HGF-Wt或HGF-Mut与miR-142-5p模拟物(miR-142-5p mimic)或阴性对照物(NC mimic)共转染M2-TAM。转染48 h后测定荧光素酶活性。所有试验一式3份,重复3次。
1.2.6 细胞转染 将M2-TAM以1×105个/孔密度接种于12孔板,孵育24 h,待细胞生长稳定后进行转染。将M2-TAM随机分组,采用miR-142-5p模拟物(miR-142-5p mimic)和抑制剂(miR-142-5p inhibitor)构建M2-TAM-miR-142-5p过表达和低表达细胞模型及相应对照组,采用si-HGF和si-NC转染M2-TAM以构建M2-TAM-HGF低表达细胞模型。
1.2.7 M2-TAM对小鼠肺癌Lewis细胞增殖影响的检测 取各组细胞2×103个,接种于96孔板中。贴壁培养24 h后向每孔加入10 μL CCK-8溶液。将培养板在培养箱内孵育4 h,用酶标仪测定光密度[D(450 nm)]值。分别测定细胞在转染后0、12、24、48和72 h细胞增殖能力的变化。
2 结果
2.1 CD206、CD163在各组细胞中的表达RT-PCR和FACS检测结果显示,M2-TAM特异性分子标志物CD206和CD163在M2-M中的表达量明显高于M,在M2-TAM中的表达量明显高于TAM(P<0.001)。(表2、图1和图2)
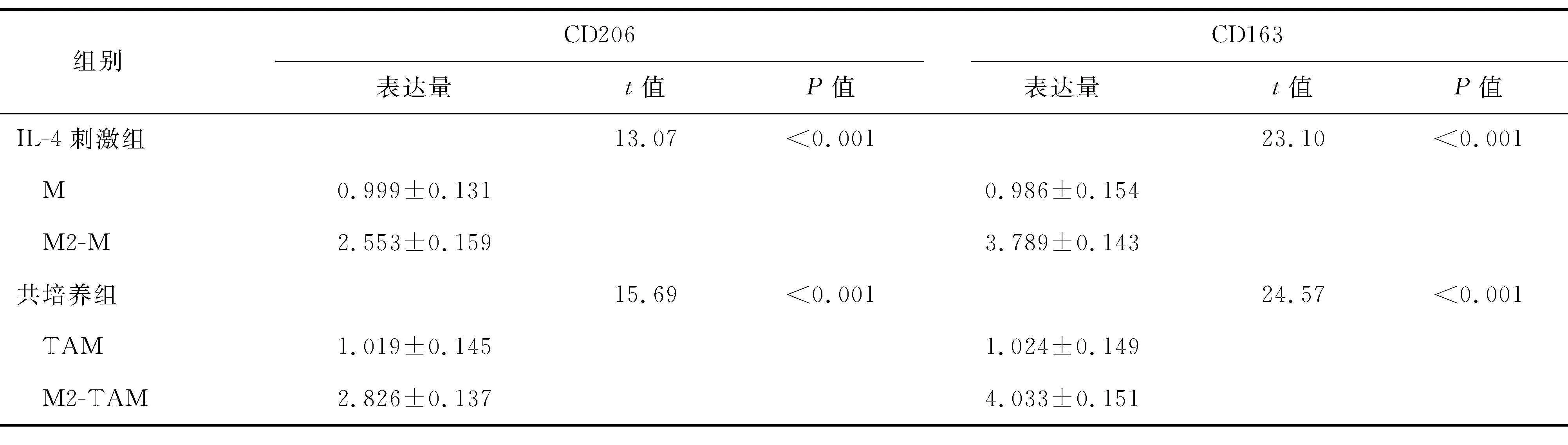
表2 各组细胞CD206和CD163表达量的比较
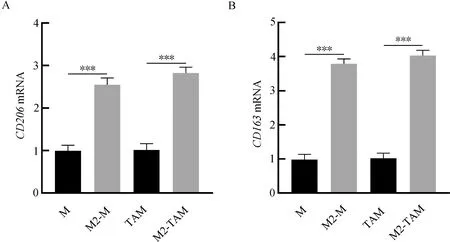
注:A.RT-PCR检测M、M2-M、TAM和M2-TAM中CD206 mRNA的表达;B.RT-PCR检测M、M2-M、TAM和M2-TAM中CD163 mRNA的表达。***P<0.001。
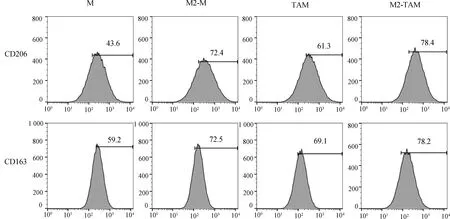
图2 FACS分析各组细胞中CD206和CD163的表达
2.2 miR-142-5p、HGF在各组细胞中的表达RT-PCR和ELISA检测结果显示,与M相比,M2-M中miR-142-5p的表达水平明显降低(P<0.001);与TAM相比,M2-TAM中miR-142-5p的表达水平也明显降低 (P<0.001)。与之相反,HGF的表达水平在M2-M中显著高于M(P<0.001),在M2-TAM中也显著高于TAM (P<0.001)。(图3)

注:A.RT-PCR检测M和M2-M中miR-142-5p的表达;B.RT-PCR检测TAM和M2-TAM中miR-142-5p的表达;C.RT-PCR检测M和M2-M中HGF mRNA的表达;D.RT-PCR检测TAM和M2-TAM中HGF mRNA的表达;E.ELISA检测M和M2-M中HGF蛋白的表达;F.ELISA检测TAM和M2-TAM中HGF蛋白的表达。***P<0.001。
2.3 miR-142-5p和HGF的靶向关系为进一步探究HGF和miR-142-5p之间的调控机制,采用TargetScan进行分析。结果显示,HGF的mRNA中存在与miR-142-5p相互作用的结合位点。为了验证miR-142-5p能否与HGF结合,分别将HGF-Wt、HGF-Mut共转染到M2-TAM中,同时进一步实施了荧光素酶报告基因检测试验。结果显示,与HGF-Mut相比,miR-142-5p模拟物能显著降低HGF-Wt报告基因质粒的荧光素酶活性(P<0.001)。这表明miR-142-5p能与HGF的3'UTR特异性结合。(图4)
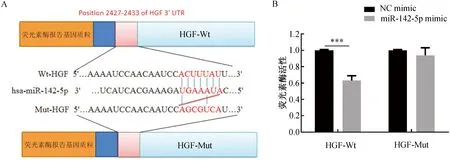
注:A.TargetScan分析miR-142-5p与HGF之间的结合位点;B.荧光素酶报告基因检测试验检测miR-142-5p与HGF的结合关系。***P<0.001。
2.4 miR-142-5p对HGF、TGF-β、VEGF、IL-10表达的影响为进一步探究miR-142-5p与HGF之间的作用关系,采用miR-142-5p mimic和miR-142-5p inhibitor构建M2-TAM-miR-142-5p过表达和低表达细胞模型,同时进一步采用RT-PCR和ELISA检测各组中HGF、TGF-β、VEGF、IL-10的表达水平。结果显示,过表达miR-142-5p 后,HGF、TGF-β、VEGF、IL-10的表达水平均下降(P<0.001),而低表达miR-142-5p后,结果相反(P<0.001)。(图5)
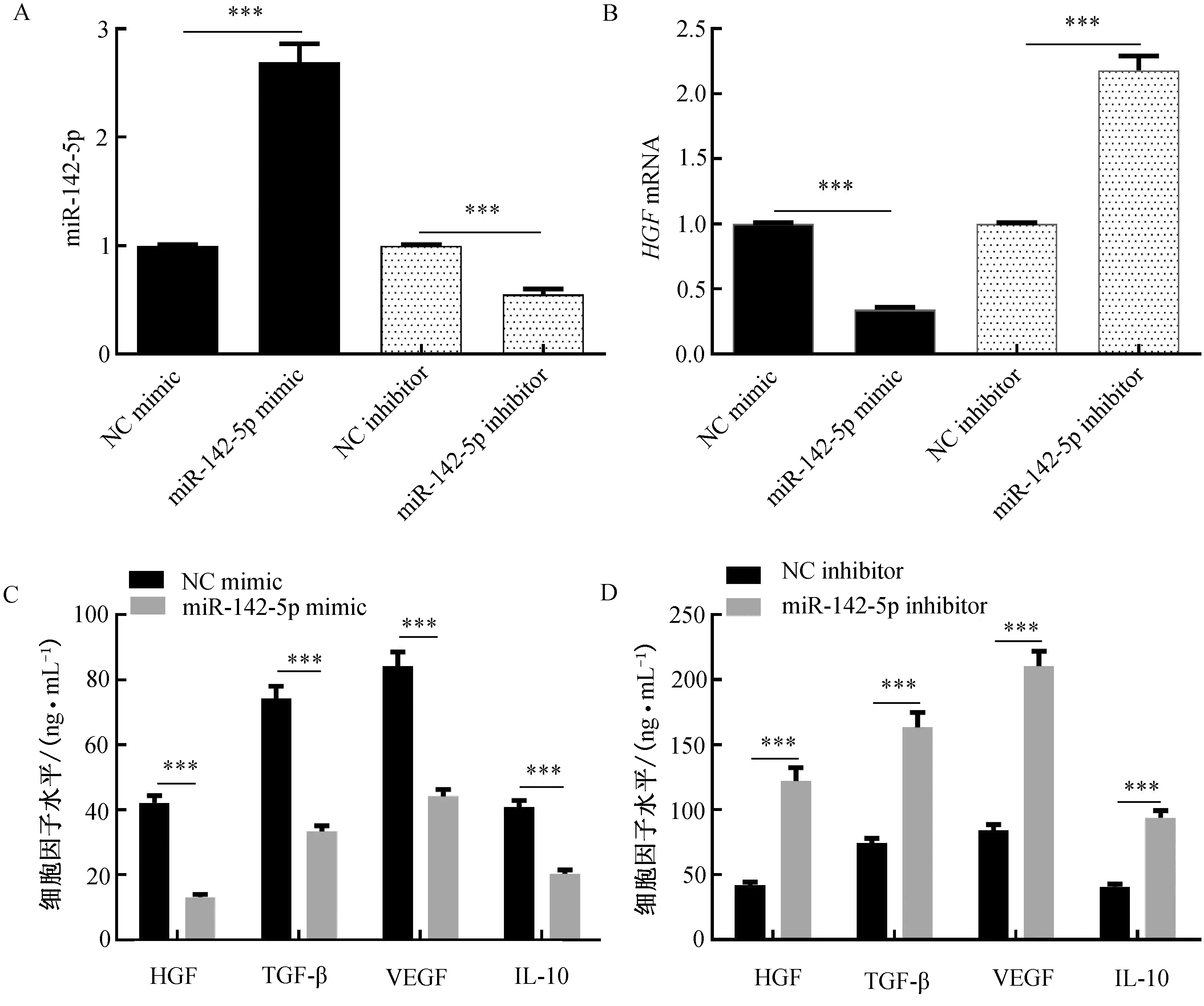
注:A.RT-PCR检测过表达和低表达miR-142-5p后M2-TAM中miR-142-5p的表达;B.RT-PCR检测过表达和低表达miR-142-5p后M2-TAM中HGF mRNA的表达;C.ELISA检测过表达miR-142-5p后M2-TAM中HGF、TGF-β、VEGF、IL-10的表达;D.ELISA检测低表达miR-142-5p后M2-TAM中HGF、TGF-β、VEGF、IL-10的表达。***P<0.001。
2.5 miR-142-5p在M2-TAM调节肺癌细胞增殖中的作用鉴于miR-142-5p对HGF的抑制作用,为进一步探究miR-142-5p对M2-TAM的作用机制,采用Transwell系统构建M2-TAM-肺癌细胞共培养模型,通过CCK-8进一步检测肺癌细胞增殖能力的变化。结果显示,过表达miR-142-5p后,小鼠肺癌Lewis细胞的增殖能力明显下降(P<0.01);而低表达miR-142-5p后,小鼠肺癌Lewis细胞的增殖能力明显上升(P<0.01)。(图6)

注:A.CCK-8检测过表达miR-142-5p后M2-TAM对小鼠肺癌Lewis细胞增殖能力的作用;B.CCK-8检测低表达miR-142-5p后M2-TAM对小鼠肺癌Lewis细胞增殖能力的作用。**P<0.01。
2.6 HGF在M2-TAM调节肺癌细胞增殖中的作用为了研究由M2-TAM释放的HGF对非小细胞肺癌细胞增殖的调控作用,采用HGF拮抗剂构建HGF低表达细胞模型,并通过ELISA验证转染成功(P<0.001)。进一步采用CCK-8检测HGF对小鼠肺癌Lewis细胞增殖能力的影响。结果显示,HGF低表达后,小鼠肺癌Lewis细胞增殖能力下降(P<0.01)。(图7)
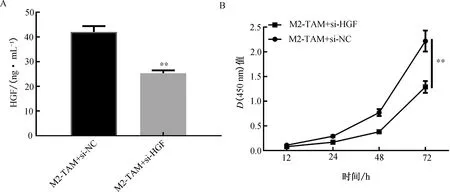
注:A.ELISA检测HGF拮抗剂作用后M2-TAM中HGF的表达;B.CCK-8检测HGF低表达后M2-TAM对小鼠肺癌Lewis细胞增殖能力的作用。**P<0.01。
3 讨论
M是维持机体内稳态和抵御外来病原体的重要固有免疫细胞群。然而,在肿瘤微环境中,TAM通常促进肿瘤细胞增殖、免疫抑制和血管生成,从而支持肿瘤的生长和转移。通常,肿瘤中TAM的丰富与疾病预后不良有关[8]。已有多项研究证实,在胶质瘤、卵巢癌、肝内胆管上皮癌、肺腺癌、胰腺癌和黑色素瘤中,TAM表现出M2活化的表型特征,M2-TAM与肿瘤患者生存时间呈负相关[9]。本研究通过体外试验发现,miR-142-5p在M2-ATM中低表达,miR-142-5p可通过靶向负调控HGF抑制非小细胞肺癌细胞的增殖。
越来越多的研究发现,miRNA在非小细胞肺癌中异常表达,并通过与靶基因相互作用促进或抑制肿瘤的发展。如miR-484在非小细胞肺癌中高表达,可促进癌细胞增殖和迁移[10];miR-661在非小细胞肺癌中高表达,可通过直接靶向RUNX3在非小细胞肺癌中作为致癌基因发挥作用[11];miR-124则通过下调SOX8抑制非小细胞肺癌细胞的增殖[12]。研究发现,miR-142-5p在非小细胞肺癌中表达下调,且miR-142-5p可以靶向PIK3CA并通过抑制PI3K/AKt通路来抑制肿瘤的生长[13]。本研究探讨了miR-142-5p在不同表型M和TAM中的表达,发现在M2-M和M2-TAM中,miR-142-5p的表达均显著下调。
HGF是一种多功能细胞因子,可促进细胞增殖、迁移和细胞外基质入侵。HGF的多种生物学功能是通过与其受体c-MET的结合来介导的[14]。c-MET属于络氨酸激酶受体(receptor tyrosine kinascs,RTK)超家族成员,为原癌基因Met编码的一类具有自主磷酸化活性的跨膜受体[15]。已有研究证明,HGF在非小细胞肺癌中高表达,且HGF/c-MET信号通路可以影响非小细胞肺癌的发展[16]。与miR-142-5p相反,HGF在M2-TAM中高表达,且在干扰HGF的表达后,M2-TAM对非小细胞肺癌细胞增殖能力的促进作用显著减弱,进一步证实HGF在TAM与肺癌细胞增殖调控中发挥关键作用。另一方面,关于miRNA与HGF/c-MET信号通路之间的分子机制及其对肺癌发展的影响,有研究证明,miR-198可以抑制非小细胞肺癌中的HGF/c-MET信号通路来克服放疗耐药性,诱导细胞凋亡[17];miR-34a通过靶向MET可以部分克服HGF介导的表皮生长因子受体(epidermal growth factor receptor,EGFR)突变肺癌细胞对吉非替尼的耐药[15];miR-182通过靶向MET基因抑制肺癌细胞从上皮向间质的转化和转移[18]。本研究通过TargetScan预测和荧光素酶报告基因检测试验也发现miR-142-5p与HGF存在碱基结合位点。过表达miR-142-5p抑制了HGF和其他M2型细胞因子TGF-β、VEGF、IL-10在M2-TAM中的表达,同时负调节了M2-TAM对非小细胞肺癌细胞增殖能力的促进作用;而低表达miR-142-5p所产生的作用恰好相反。此外,下调HGF的表达也负调节了M2-TAM对非小细胞肺癌细胞增殖能力的促进作用。由此可见,在M2-TAM中,miR-142-5p可能通过靶向下调HGF的表达影响HGF作用下的HGF/c-MET信号通路,从而抑制非小细胞肺癌细胞的增殖。
本研究初步探究了miR-142-5p靶向抑制HGF的表达对非小细胞肺癌细胞增殖的影响,为TAM以M2型为主的非小细胞肺癌细胞增殖的分子机制提供了一种新思路。然而,本研究尚存在不足之处,如miR-142-5p的上游机制、体外试验的局限性等,都尚待进一步的探究和完善。

