原发性肝癌TACE对外周血髓源性免疫抑制细胞百分比的影响
邵明亮,张巍,苗同国,闫会敏,吴宗耀
(1.石家庄市第五医院 介入医学科,石家庄 050021;2.石家庄市第五医院 肝病研究所,石家庄 050021;3.西藏藏医药大学 藏医药研究所,西藏 850000)
HBV相关性肝细胞癌(HBV-related hepatocellular carcinoma)的早期诊断困难,病情进展快,易复发,每年导致超过100万人死亡,是致死率非常高的肿瘤之一[1]。目前肝癌的治疗主要以肝脏局部切除、射频消融和肝脏移植等为根治手段,由于大部分患者在接受治疗时已处于肝癌中晚期,只有不到30%的患者有根治性治疗适应症。经导管动脉栓塞化疗(transcatheter arterial chemoembolization, TACE)为非手术治疗适应症患者的首选疗法。髓源性免疫抑制细胞(myeloid-derived suppressor cell, MDSC)是由骨髓祖细胞和未成熟髓系细胞(immature myeloid cell, IMC)组成的异质细胞群,正常生理条件下后者会进一步发育为成熟的单核系、粒系血细胞及DC。MDSC具有强大而广谱的免疫抑制功能,在体外能显著抑制CD4+、CD8+T细胞亚群增殖,促进Treg活化,干扰T细胞的迁移和活性,生成氧化应激产物等[2]。在肿瘤、炎症、创伤、自身免疫性疾病等病理条件下,MDSC通过抑制GM-CSF、IL-17及TNF-α分泌,阻断IMC分化,抑制炎症反应而显著促进小鼠在体肿瘤的生长[3]。本研究旨在分析肝癌细胞增殖、转移、治疗等是否与MDSC百分比有关,及其可能的疾病相关预测作用。
1 资料与方法
1.1 研究对象收集2011年5月—2015年1月于石家庄市第五医院就诊的HBV相关原发性肝细胞癌患者237例,患者年龄(59.36±6.57)岁,年龄范围30~77 岁,经病理诊断确诊为肝细胞肝癌,患者的具体信息如下(表1)。
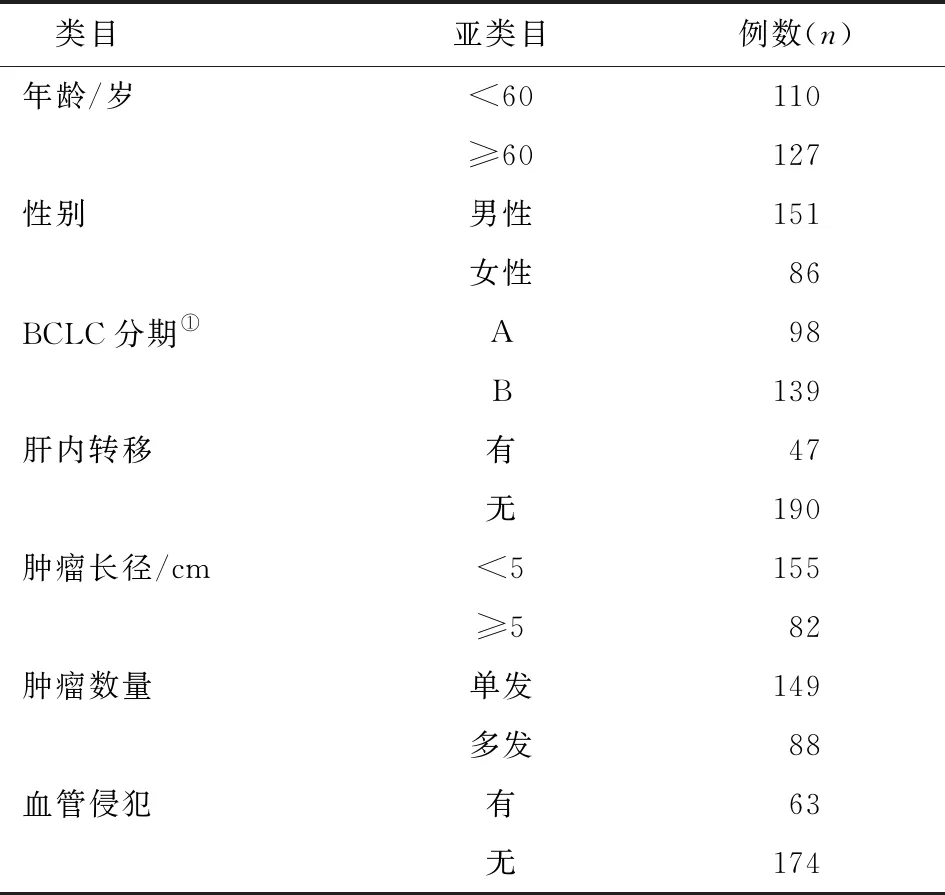
表1 入组对象一般资料
所有患者的诊断均符合原发性肝癌诊疗规范(2011年版)[4],肿瘤分期依据国际抗癌联盟2002年修订的肝癌TNM分期标准。纳入标准:(1)患者有HBV感染史;(2)经2种影像学手段(CT、MRI、超声造影等)证实或有病理检查证实;(3)所有患者6个月内均未接受过任何抗肿瘤治疗,且患者对研究知情并自愿签署知情同意书。排除标准:(1)非原发性肝癌,如肉瘤、恶性淋巴瘤、转移性肝癌等患者;(2)不能配合完成随访者。
1.2 试剂与仪器人淋巴细胞分离液(Ficoll),购自天津市灏洋生物制品科技有限责任公司;FBS,购自Gibco公司;兔抗人单克隆荧光抗体CD33-PE,购自BioLegend公司;兔抗人CD11b/Mac-1-APC、HLA-DR-PE-Cy7、CD15-PerCP-Cy5.5、CD14-FITC、CD3-FITC、CD4-PE-Cy5、CD8-PE-Cy7同型对照抗体,购自BD公司;HBV-DNA实时荧光定量PCR检测试剂盒,购自上海罗氏制药有限公司;HBVe抗原诊断试剂盒(ELISA),购自上海科华生物工程股份有限公司;AFP化学发光法(CMIA)试剂盒,购自罗氏诊断产品(上海)有限公司。Centrifuge 5810R型高速冷冻离心机,来自Eppendorf公司;BD FACSAria Ⅱ流式细胞仪,来自BD公司。
1.3 PBMC的分离及抗体标记分别于TACE术前以及术后6个月采集患者静脉血10 mL于EDTA抗凝管。用PBS稀释细胞沉淀至18 mL,均分为2管。向洁净EP管中加入Ficoll液4.5 mL,按1∶2比例将稀释的血细胞悬液缓慢加至Ficoll液面上方;800×g离心20 min,分离后液面上方第2层白色薄层液体即为粗分PBMC。吸取100 μL细胞悬液于流式管中,分别加入单克隆抗体抗CD33-PE、CD11b/Mac-1-APC、HLA-DR-PE-Cy7、CD14-FITC、CD15-PerCP-Cy5.5 各20 μL;对照管中加入相应的同型对照抗体用于排除非特异性染色干扰。混匀细胞及抗体混悬液,置于冰上避光孵育30 min后250×g离心6 min。弃去上清液,加入300 μL PBS重悬细胞,FACS检测G-MDSC(CD33+/CD15+/HLA-DRlow/CD11b+)占PBMC的百分比。
1.4 肿瘤患者HBV及肝癌相关实验室指标的检测分别进行乙肝e抗原定量(HBeAg、HBeAb)和HBV DNA载量检测,检测灵敏度>500 IU/L,AFP检测下限7 ng/mL,Child-Pugh评分标准如下(表2), 以总分≤6分为A级,7~9分为B级,≥10分为C级。

表2 肝功能的Child-Pugh评分标准
1.5 肝癌患者的CT检查依据影像学特点判断肝癌单发、多发,测量肿瘤长短径及肝内转移情况。CT分为平扫期、动脉期、静脉期和延迟期4期扫描检查。肝癌CT增强图像可见:肝脏占位在动脉期出现快速不均质血管强化,密度高于正常肝组织;而静脉期或延迟期造影剂被快速洗脱,病灶密度低于周围正常肝组织。肿瘤肝内转移CT增强图像可见:门静脉主干、分支的粗细不成比例,血管内可见充盈缺损。
1.6 肝癌患者的TACE治疗TACE治疗患者摆平卧位,消毒后取右侧腹股沟韧带下1.5 cm股动脉搏动最明显处为穿刺点,用2%利多卡因5 mL局部麻醉。分析病灶数字减影血管造影(digital subtraction angiography, DSA)表现,明确肿瘤的部位、大小、数量及供血动脉后,将导管介入至肝固有动脉或肝右、左动脉支进行局部灌注化疗,灌注时间不应少于15~20 min。将碘化油与化疗药物(丝裂霉素10 mg、表柔比星40 mg)充分混合成乳剂,经导管缓慢注入,通常总注射剂量为10 mL。肿瘤呈乏血供时的碘化油用量减少至5 mL。如有肝动脉-门静脉瘘和/或肝动脉-肝静脉瘘,可先用明胶海绵或不锈钢圈堵塞瘘口,再将适量碘化油缓慢注入。注射完成后拔出导管及导管鞘,压迫止血15 min,加压包扎。
2 结果
2.1 肝癌患者的基本情况从患者的基线资料可以看出,男性、农民、有肝癌家族史患者为研究的主要对象;经统计样本中肝癌患者临床特征包括BCLC分期为A、B期,无肝内转移,无门静脉瘤栓等(表3)。
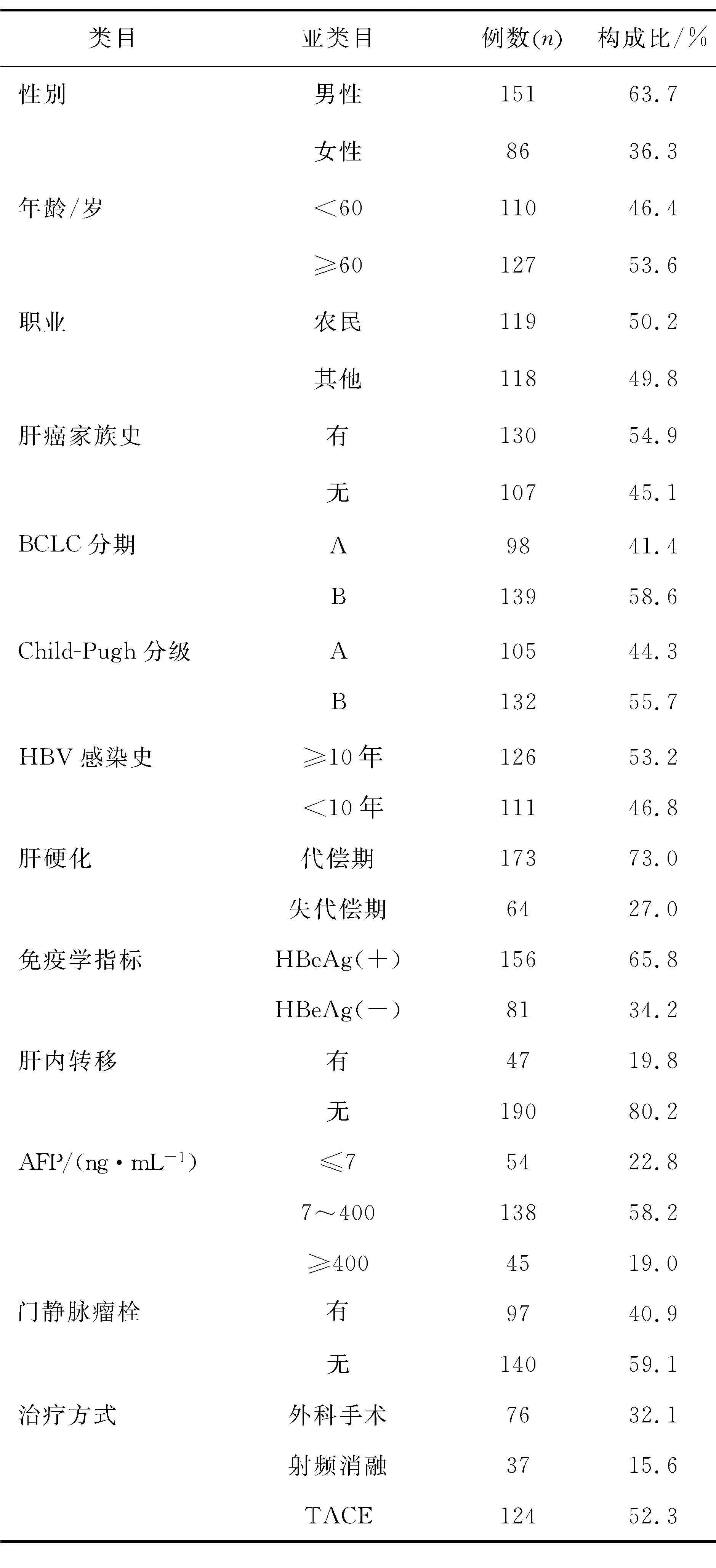
表3 肝癌患者的基本情况
2.2 肝癌患者临床特征与MDSC百分比单因素分析不同性别、年龄、家族史、肿瘤长径、数量、有无门静脉瘤栓患者的MDSC百分比差异无统计学意义(均P>0.05, 表4)。Child-Pugh B组(14.29%)高于 A组(8.16%); 肝硬化失代偿期(16.87%)高于代偿期(9.63%);HBV DNA载量≥103组(14.92%)高于HBV DNA<103组(6.73%);HBeAg(+)组(20.47%)高于HBeAg(-)组(13.63%);BCLC分期B组(22.03%)高于分期A组(14.12%);肝内转移组(21.03%)高于无转移组(5.10%);血管侵犯组(26.15%)高于无血管侵犯组(7.38%); 非TACE治疗组(34.00%)高于TACE治疗组(25.90%)。(均P<0.05, 表4、 图1和图2)

图1 肝癌肝内转移组患者G-MDSC(CD33 +/CD15+/HLA-DRlow/CD11b+)FACS检测结果

图2 不同临床特征肝癌患者MDSC百分比FACS检测结果

表4 237例肝癌患者临床特征的单因素分析
2.3 利用Cox回归模型对影响肝癌患者MDSC百分比因素的多因素分析经单因素分析筛选出8个临床因素,对其进行多因素分析后发现,BCLC分期、治疗方式是显著影响MDSC百分比的因素(均P<0.01,表5)。

表5 Cox回归模型分析肝癌患者主要临床特征对MDSC百分比的影响
2.4 MDSC百分比对肝癌TACE治疗复发诊断的效能分析依据上述MDSC百分比结果的差异,比较不同水平MDSC百分比对肝癌TACE治疗后复发诊断的效能,发现MDSC(24.21%)的诊断灵敏度(81.64%)和特异度(73.56%)最高,准确度(65.70%)较高,适用于下一步研究(表6)。
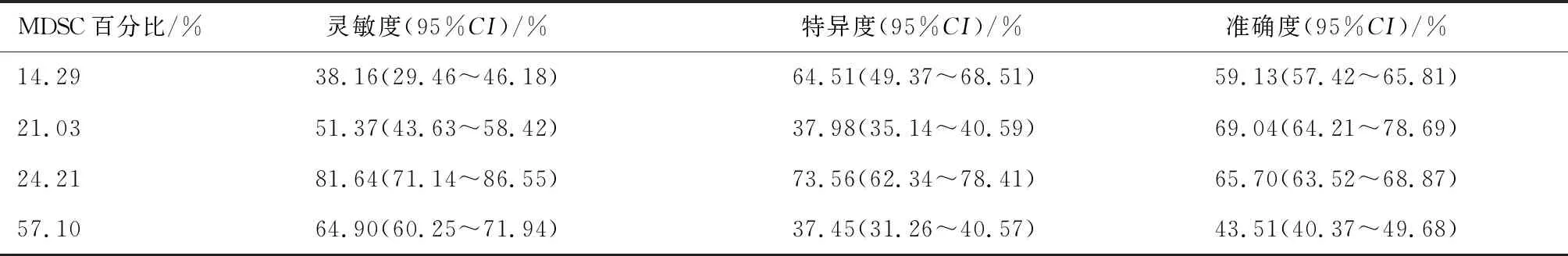
表6 MDSC百分比对肝癌患者TACE治疗后复发诊断的效能
2.5 Kaplan-Meier分析MDSC百分比对肝癌患者TACE后生存率的影响进一步依据MDSC百分比(24.21%)对接受TACE的124例患者生存率进行为期24个月的观察,发现MDSC%≥24.21%组平均无进展生存期(8.31个月)与<24.21%组(16.72个月)相比差异具有统计学意义(P<0.05,表7、 图3)。
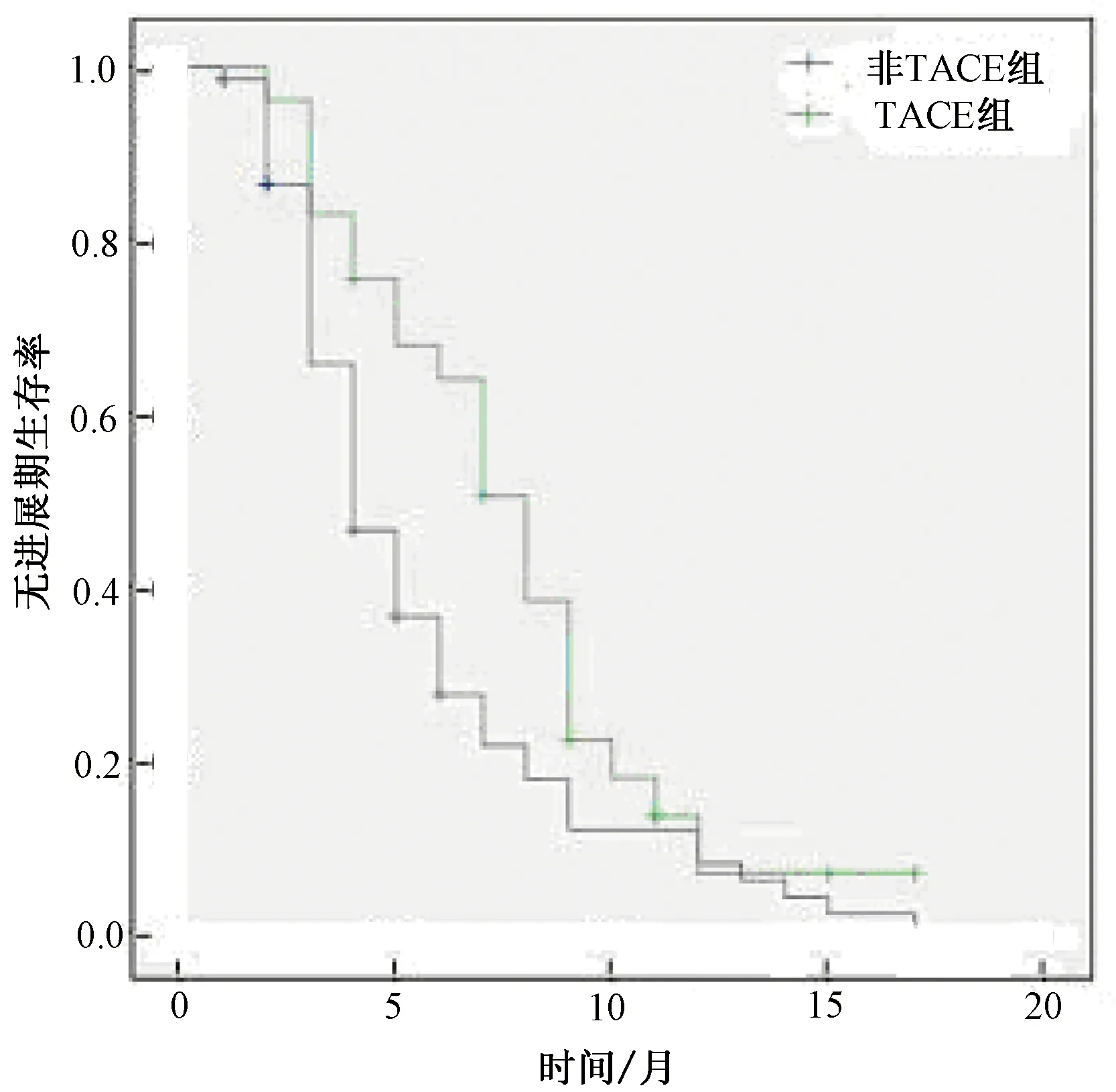
图3 TACE和非TACE组患者的Kaplan-Meier生存曲线分析
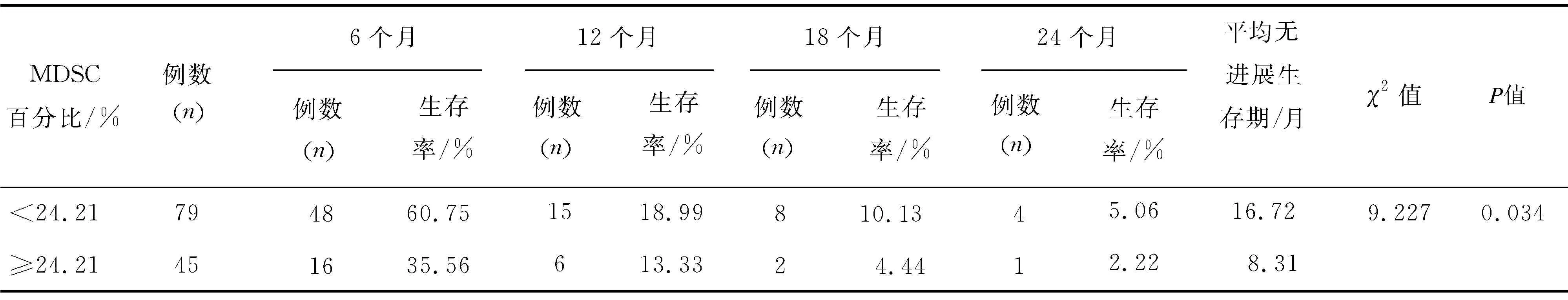
表7 Kaplan-Meier分析MDSC百分比对肝癌患者TACE治疗后生存率的影响
3 讨论
肝炎病毒是诱发肝癌的最重要因素,其中HBV继发肝癌者约占患者总数的90%,HCV相关肝癌占10%;大约70%的肝硬化患者会进一步发展成肝细胞癌[4]。HBV相关性肝细胞癌的发生过程中脾脏功能异常导致机体免疫功能紊乱。患者体内免疫抑制细胞Treg、MDSC、免疫检查点分子(PD-1)及抑制性细胞因子表达水平升高,CD4+、CD8+T细胞、NK、DC、Th17耗竭,IFN-γ、IL-10、TGF-β1及颗粒酶B分泌水平降低[5]。
MDSC的免疫调节功能非常活跃[6-7],有研究显示,肝细胞癌患者中CD14+HLA-DRlowMDSC百分比相比肝硬化患者明显升高[7]。疾病早期MDSC破坏肿瘤细胞增殖微环境,激发机体免疫反应以发挥抗肿瘤作用。而进展期肿瘤微环境则转变为抗肿瘤免疫抑制状态,MDSC分泌大量促进肿瘤细胞增殖的GM-CSF促进肿瘤免疫逃逸过程。MDSC可以通过免疫相关机制导致肿瘤细胞的增殖、转移以及局部浸润[8-10]。
本研究显示,肝癌患者临床分期BCLC B期MDSC百分比高于A期,同时肝内转移组MDSC百分比高于无转移组,血管侵犯时MDSC百分比显著提高,提示患者病情越重,MDSC百分比越高,与临床进展、不良预后、低生存率有关。
本研究发现,非TACE组MDSC百分比显著高于TACE组,而TACE可以显著抑制肝癌细胞增殖,提示MDSC百分比上调与肝癌细胞增殖、病情进展有关。相关研究证实,TACE可以抑制肝癌细胞PI3K/AKT信号通路的激活[11-12],MDSC增殖与PI3K家族信号通路相关[13]。由此推测非TACE治疗导致肝癌细胞PI3K/AKT信号通路过度激活,诱导MDSC增殖。
本研究发现,瘤栓组MDSC百分比高于非瘤栓组,由此推测肿瘤瘤栓通过刺激免疫细胞分泌免疫因子,诱导机体生成并活化MDSC。Hwang等[14]研究证实了MDSC与PI3K/AKT信号通路有关——PI3K/AKT信号通路激活了髓样前体细胞中的转录因子c-Rel, 后者进入细胞核, 并与MDSC的特异标志性基因(Cebpb或Arg1)的启动子或增强子结合,形成启动MDSC分化的特异性增强体(转录复合物),从而诱导MDSC的产生。MDSC促进肿瘤侵袭的作用依赖于基质金属蛋白酶(matrix metalloproteinase, MMP)。MDSC表达MMP家族蛋白酶促进肿瘤微环境血管新生以及髓系造血细胞动员,促进肿瘤细胞的增殖、转移。通过多因素分析初步确定影响MDSC百分比的主要因素为BCLC分期以及治疗方式,提示进一步研究以MDSC功能调节为肿瘤治疗靶点具有重要的临床价值。MDSC通过合成蛋白水解酶,加快细胞外基质水解,使毛细血管通透性增加,从而增强肿瘤细胞的浸润[15]。因此,笔者推测肿瘤细胞和MDSC之间的调控是一个相互反馈的作用过程。
国内研究显示,对肝癌组患者进行短期随访观察后发现,外周血MDSC百分比与患者术后生存率有关,可作为预测该类患者病死率的潜在指标[16]。国内同类研究也表明肝细胞癌患者外周血中MDSC的增殖与其肿瘤临床病理情况有关,肿瘤组织局部MDSC数量高于外周血。本研究证实MDSC能够显著影响患者的TACE术后生存率,MDSC百分比越高,患者生存率越低,提示以MDSC为监测对象初步预测患者术后康复情况具有积极的临床意义。
综上所述,肝癌患者MDSC百分比与BCLC分期以及TACE治疗有关, 其监测有助于预测肝癌的临床进展。

