大电导钙依赖性钾通道对LPS诱导THP-1来源巨噬细胞免疫活性的影响
方均燕,宋阿会,刘英莉
(上海交通大学医学院附属第九人民医院 肾内科,上海 200011)
脓毒症为机体对感染反应失调的临床综合征,临床上缺乏有效的治疗方法[1-2]。研究发现,瀑布式炎症级联反应是脓毒症发展的重要环节[3]。作为机体反应的第1道防线,巨噬细胞可极化为促炎型(M1型)或免疫调节型(M2型)[4]。研究发现,通过抑制巨噬细胞M1型极化,能够提高脓毒症小鼠的生存率[5]。因此,调控巨噬细胞极化有望成为脓毒症治疗的新方向。大电导钙依赖性钾通道(large-conductance calcium-activated potassium channel,BKca)分布于多种类型细胞膜上[6]。研究发现,BKca不仅能够维持钾离子平衡,而且参与调节多种炎症反应的发生、发展[7-8],有望成为炎症治疗的靶点。本研究以BKca为研究对象,探讨其对巨噬细胞的增殖、M2/M1亚型极化及细胞因子分泌水平的影响,以期为脓毒症的免疫治疗提供新靶点。
1 材料与方法
1.1 试剂与耗材人单核细胞系THP-1 (中国科学院细胞库),RPMI 1640培养液(Hyclone公司),FBS(Bioind公司),青霉素、链霉素、0.25%胰蛋白酶(Gibco公司),CCK-8(上海睿安生物科技有限公司),FITC标记的人CD80抗体(FITC-CD80)、别藻蓝蛋白(allophycocyanin,APC)标记的人CD206抗体(APC-CD206)试剂盒(BioLegend公司),PBS溶液(Hyclone公司),Hank's溶液(Gibco公司),蕈青霉素(Alomone公司),佛波酯(phorbol 12-myristate 13-acetate,PMA;Sigma公司),电转液、电泳液[生工生物工程(上海)股份有限公司],BKcα抗体(Alomone公司),GAPDH抗体(Proteintech公司),RIPA(碧云天有限公司),蛋白磷酸酶抑制剂混合物(索莱宝公司),RT reagent Kit(TaKaRa公司)。其他生化试剂均为国产分析纯。所用引物由生工生物工程(上海)股份有限公司设计、合成(表1)。

表1 引物序列
1.2 方法
1.2.1 THP-1 细胞的预处理 将THP-1细胞加入含10% FBS及1%双抗的RPMI 1640培养液中,放入37 °C、5%CO2培养箱培养48 h。取无菌细胞培养6孔板,收集培养的细胞进行细胞计数,调整密度为1×106个/mL,加入含有100 nmol/L PMA的培养液继续培养48 h,用PBS清洗2次,再加入不同处理因素。
1.2.2 细胞活性的CCK-8检测 将THP-1细胞以104个/孔的密度接种至96孔板,待其长至80%融合时加入不同浓度的蕈青霉素(0、0.01、0.1、0.5和1 μmol/L )孵育24 h,各孔加入10 μL CCK-8,37 ℃孵育4 h,用微孔酶标仪检测各孔光密度[D(450 nm)]值,用Graphpad 5软件分析各组差异。
1.2.3 BKca蛋白表达的Western blotting 检测 将细胞预处理后,加入不同浓度LPS(0、10、100、500和1 000 ng/mL)以及蕈青霉素孵育24 h,去除上清液,加入RIPA和蛋白磷酸酶抑制剂混合物配置的裂解液裂解细胞,用BCA法定量各组蛋白浓度后,加入适量5×上样缓冲液,以100 ℃煮10 min。配制8%的SDS-PAGE胶,将不同处理组巨噬细胞所提取的蛋白样品在上样前以100 ℃煮5 min,以80 V恒压电泳至染料前沿达凝胶底部,220 mA恒流转膜2 h,膜在5%脱脂牛奶中室温封闭2 h,加入一抗,4 ℃过夜孵育8~16 h,TBST洗3次,加入二抗,室温孵育1 h,TBST洗3次后显色。用Image J软件分析灰度值。
1.2.4 M1/M2型巨噬细胞的FACS检测 将细胞预处理后分为3组:对照组、LPS组(LPS 100 ng/mL)及LPS+蕈青霉素组(LPS 100 ng/mL、蕈青霉素100 μmol/L)。用0.25%胰蛋白酶消化各孔细胞,取一组空白组作空白对照,其余孔细胞被消化后以208×g离心5 min,弃上清液。以PBS洗涤后用FITC-CD80、APC-CD206荧光一抗进行染色,分别作为巨噬细胞共同表面标志和M1、M2型巨噬细胞特异性标志。以上操作均在冰上完成。使用FACSCalibur流式细胞仪(BD Biosciences公司)进行检测,并用CytExpert软件分析检测结果。
1.2.5 巨噬细胞RNA的提取与qRT-PCR检测 将细胞预处理后分为3组:对照组、LPS组(LPS 100 ng/mL)及LPS+蕈青霉素组(LPS 100 ng/mL、蕈青霉素100 μmol/L)。按照TaKaRa总RNA制备试剂盒说明书所述步骤从洗涤好的上述巨噬细胞中提取总RNA,使用微量核酸仪(NanoDrop Technologies公司)检测波长在260及280 nm处的吸收峰并测定浓度,将100 ng RNA按照反转录试剂盒说明书方法反转录得到cDNA,并保存在-80 ℃中。
用SYBR Green Master Mix扩增上述cDNA并分析其对应的mRNA表达,以GAPDHRNA为内参,GAPDH引物为商品化的人内参基因GAPDH引物。所有样品均设3个复孔。
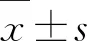
2 结果
2.1 不同浓度蕈青霉素对THP-1细胞来源的巨噬细胞活性的影响用不同浓度BKca抑制剂蕈青霉素(0、0.01、0.1、0.5和1 μmol/L)处理THP-1细胞 24 h,用CCK-8检测各组D(450 nm)值。结果显示,低浓度的BKca抑制剂蕈青霉素对细胞活性没有明显影响,而高浓度蕈青霉素(1 μmol/L)能够显著降低细胞活性(P<0.05)。(图1)
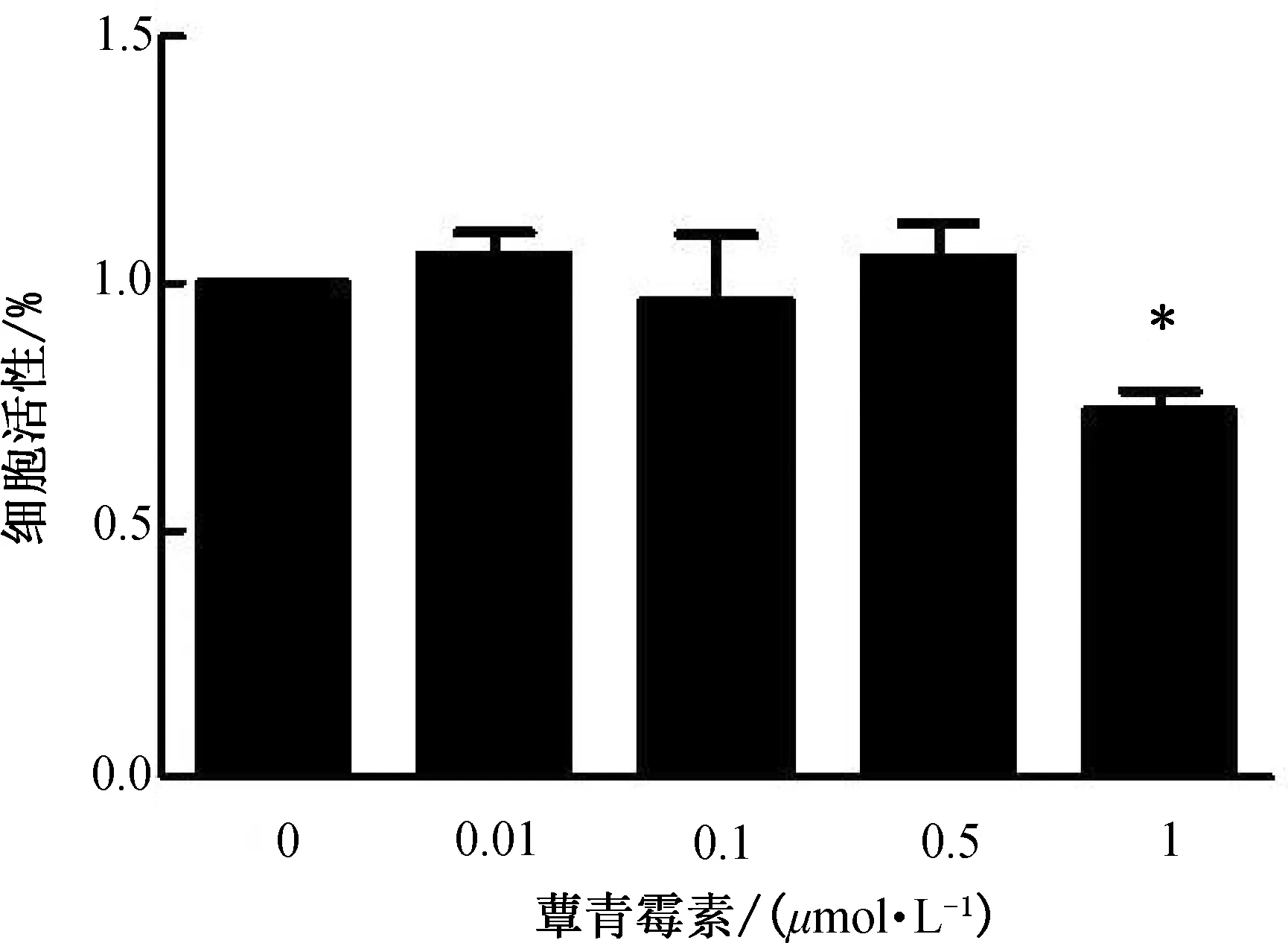
注:与蕈青霉素0 μmol/L组比较,*P<0.05。
2.2 不同浓度LPS对THP-1细胞来源巨噬细胞BKca蛋白表达的影响用不同浓度LPS(0、10、100、500和1 000 ng/mL)处理THP-1细胞来源的巨噬细胞24 h,提取蛋白质进行Western blotting检测,以GAPDH为内参,可检测到BKca蛋白的表达;且随着LPS浓度的增加,巨噬细胞的BKca蛋白表达量也相应增加(P<0.01)。(图2)
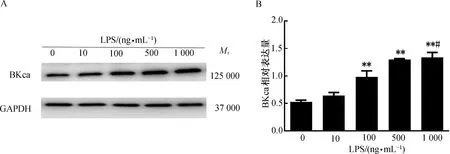
注:与LPS 0 ng/mL组比较,**P<0.01;与LPS 100 ng/mL组比较,#P<0.05。
2.3 蕈青霉素对LPS刺激THP-1细胞来源巨噬细胞BKca蛋白表达的影响将细胞预处理后分为4组:对照组、LPS组(LPS 100 ng/mL)、蕈青霉素组(蕈青霉素100 μmol/L)及LPS+蕈青霉素组(LPS 100 ng/mL、蕈青霉素100 μmol/L),提取蛋白质进行Western blotting检测,以GAPDH为内参,可检测到BKca蛋白的表达。与对照组比较,LPS刺激后巨噬细胞上BKca蛋白表达量增加(P<0.05),加入蕈青霉素后,其表达量有所降低(P<0.01)。(图3)
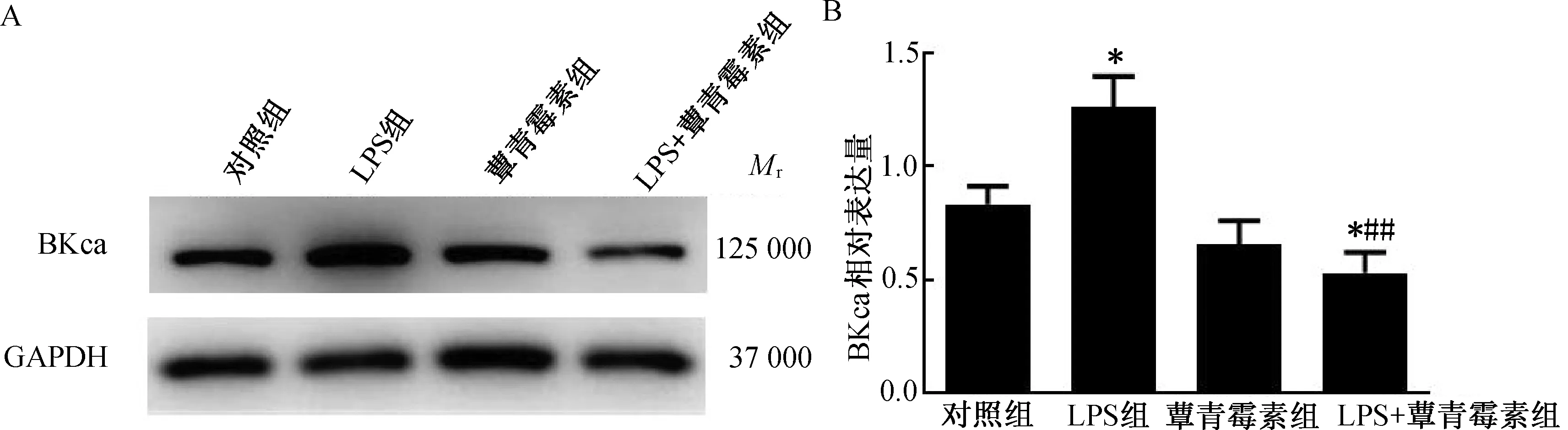
注:与对照组比较,*P<0.05;与LPS组比较,##P<0.01。
2.4 蕈青霉素对LPS诱导THP-1细胞来源巨噬细胞极化的影响FACS结果显示,相对于对照组,LPS刺激诱导巨噬细胞后,M2/M1比例降低,以M1型细胞为主(P<0.01);而加入蕈青霉素后,M2/M1比例增加,以M2型细胞为主(P<0.01)。(图4)
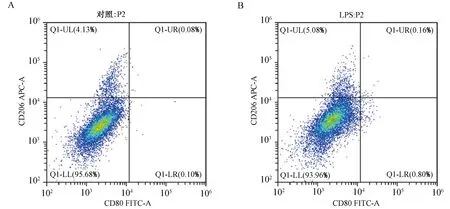
注:A~C.分别为FACS检测对照组、LPS组、LPS+蕈青霉素组THP-1细胞中巨噬细胞亚型分化;D.上述A、B、C图各组巨噬细胞M2/M1比例的统计分析。与对照组比较,**P<0.01;与LPS组比较,##P<0.01。
2.5 蕈青霉素 对LPS刺激THP-1细胞来源巨噬细胞分泌炎性因子的影响qRT-PCR结果显示,LPS刺激巨噬细胞后,细胞因子IL-6、TNF-α、IL-1β、IL-10 mRNA水平明显高于对照组(P<0.05)。在蕈青霉素干预后,巨噬细胞表达的促炎因子IL-6、TNF-α、IL-1βmRNA水平明显低于LPS组,而抑炎因子IL-10 mRNA水平明显高于LPS组(P<0.05)。(图5)。

注:与对照组比较,*P<0.05;与LPS组比较,#P<0.05。
3 讨论
在生理状态下,BKca作为一种钾离子通道,参与调节体内钾离子平衡、神经递质释放及维持血压等[6]。研究发现,抑制BKca活性能够抑制神经母细胞瘤细胞、前列腺癌细胞、骨髓间充质干细胞等的增殖。本研究也证实了BKca特异性抑制剂对THP-1细胞增殖具有抑制作用。
BKca在炎症性疾病的发生、发展中起到至关重要的作用。BKca与TLR2相结合,可促进炎性因子的释放,应用BKca抑制剂能有效阻止炎性因子的释放[9]。在类风湿关节炎的动物模型中,应用BKca抑制剂可通过影响T细胞和关节滑膜细胞的相互作用减轻关节炎症的程度[10]。Ren等[11]研究发现,在胰腺炎小鼠模型中抑制BKca能够减轻巨噬细胞的炎症反应。本研究在人单核细胞上也证实了LPS能够激活BKca蛋白的表达,提示BKca可能参与了LPS介导的THP-1细胞的炎症反应。而Martin等[12]研究证实,Th2相关的细胞因子IL-4可以激活气道平滑肌细胞上的BKca,在实验性的哮喘小鼠模型中发现应用BKca激动剂可以通过激活BKca减轻哮喘症状。以上研究表明,BKca在不同炎症反应中的作用并不一致。
在脓毒症小鼠模型中,异橙皮内酯通过下调NF-κB胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路来抑制M1型极化,提高小鼠的存活率,缓解炎症反应[5]。Tang等[13]研究发现,日本血吸虫(schistosoma japonicum,SJ)感染可触发巨噬细胞向M2型极化,上调抑炎因子IL-10水平,逆转LPS诱导M1型巨噬细胞的极化,降低促炎因子TNF-α水平,进一步将M2型巨噬细胞转移至脓毒症小鼠体内,可提高小鼠的存活率。以上研究表明,在脓毒症的发生、发展中,LPS介导的巨噬细胞分泌的炎性因子可导致组织细胞的损伤,M2/M1比例能够影响炎症反应的结局。Papavlassopoulos等[14]研究发现,BKca参与了巨噬细胞识别LPS的早期过程。本研究采用LPS体外刺激模拟脓毒症早期的急性炎症,诱导THP-1细胞来源巨噬细胞向M1型极化,可见炎性因子TNF-α、IL-1β及IL-6大量释放;应用BKca特异性抑制剂诱导巨噬细胞向M2型极化,减轻了瀑布样炎性因子的释放。
既往研究和本研究均发现,BKca可能参与了巨噬细胞活化的起始阶段,具体机制尚不明确。BKca抑制剂逆转LPS刺激下巨噬细胞分泌的炎性因子水平,其可能是通过抑制IκB-α/NF-κB信号通路来实现的[14]。另外,钾离子的外流是NOD样受体家族含pyrin结构域蛋白3(NOD-like receptor family pyrin domain-containing protein 3, NLRP3)炎症小体激活的必要条件[15],炎症小体激活后使pro-Caspase-1转化为活化的Caspase-1,可裂解pro-IL-1β,最终导致促炎因子IL-1β的成熟和释放。BKca作为一种钾离子通道,被阻断后可抑制Caspase-1活性[14]。然而,这一机制是否通过影响NLRP3炎症小体激活来介导,尚需进一步研究阐明。
本研究证实,BKca参与了LPS诱导下巨噬细胞的早期活化,调控M2/M1巨噬细胞亚型平衡以及炎性因子的释放,抑制BKca能够减轻LPS诱导的巨噬细胞炎症反应。以BKca为靶点,从上游调控这种瀑布样的炎症效应,可为脓毒症免疫治疗提供一种新的策略和重要的理论依据,这有望降低脓毒症患者的病死率。然而,本研究尚存在一定的局限性:首先,本研究未检测细胞内外钾离子和钙离子的水平,不能验证其离子转运功能在此过程中发挥何种作用;其次,BKca参与巨噬细胞极化的具体调控机制及相关信号转导通路仍需研究明确;最后,BKca在脓毒症小鼠中的作用及分子机制需要进一步研究阐明。

