骆驼奶对TNBS诱导的小鼠急性肠炎的保护作用
崔畅婉,于淼,吴思,王爽,孙峥嵘
(中国医科大学附属盛京医院 生物样本库,沈阳 110001)
骆驼奶中含有丰富的维生素C、不饱和脂肪酸、维生素B以及牛奶中没有的乳铁传递蛋白和溶菌酶等,营养成分含量极高[1]。骆驼奶中含有丰富的与牛奶不同的蛋白质,不会诱发蛋白质过敏症状,对于食用牛奶过敏的人群更为安全[2]。研究表明,骆驼奶能够通过调节Th1型和Th2型细胞比例及细胞因子分泌,纠正失衡的细胞因子网络,在免疫性糖尿病和肝炎等疾病治疗过程中起重要的辅助治疗作用[3-4]。肠黏膜免疫失衡是引起肠道损伤的重要原因之一,在炎症性肠病(inflammatory bowel disease, IBD)患者肠黏膜组织中有大量Th17浸润,它分泌的IL-17是重要的促炎因素。CTL可直接杀伤靶细胞,在炎症和肿瘤免疫过程中具有重要作用。中性粒细胞(CD11b+Gr1+)、Th以及NK细胞均能合成IL-10,后者抑制单核巨噬细胞的抗原提呈作用,减少巨噬细胞分泌IL-23,进而抑制Th17免疫应答,抑制炎症发生。目前骆驼奶对肠道黏膜免疫细胞分群及其功能是否具有调节作用,能否抑制肠道炎症发生尚不明确。本研究使用2,4,6-三硝基苯磺酸(trinitro-benzene-sulfonic acid,TNBS)诱导小鼠急性肠炎模型,使用骆驼奶灌胃治疗,检测小鼠肠道淋巴细胞亚群、中性粒细胞百分比及细胞因子分泌情况,探讨骆驼奶对小鼠肠炎的保护作用。
1 材料与方法
1.1 实验动物与试剂SPF级BALB/c小鼠24只,6~8周龄,雄性,体质量16~18 g,购自北京华阜康生物科技股份有限公司,饲养于中国医科大学动物部。骆驼奶粉,购自新疆旺源驼奶实业有限公司;TNBS溶液(2 mg粉末+50%乙醇),购自Sigma-Aldrich公司;RPMI 1640培养液,购自Gibco公司;Percoll细胞分离液,购自Sigma-Aldrich公司;抗小鼠Gr-1-PE、CD11b-PerCP、F4/80-APC、CD3-PE、CD8α-APC、CD4-FITC、CD44-PE抗体,购自BD公司;IL-10和IL-17 ELISA检测试剂盒,购自R&D公司。
1.2 实验方法
1.2.1 IBD诱导及H-E染色 实验组和对照组采取随机分组方法,每组6只,实验结果由数次实验总结归纳得出。实验组小鼠骆驼奶灌胃0.2 g/(次·只)(奶粉溶于200 μL双蒸水),对照组小鼠双蒸水灌胃200 μL /(次·只),灌胃操作持续14 d。第15天对实验组与对照组小鼠施行禁食12 h后,用5 μL/g水合氯醛注射麻醉,保证小鼠不窒息死亡。用灌肠注射器经小鼠肛门给药,TNBS溶液按100 μL/只缓慢注入小鼠直肠,倒挂小鼠5 min,以免漏液。操作持续5 d,第7天处死小鼠,进行后续实验。对小鼠结肠组织切片进行 H-E 染色, 在 400 倍光学显微镜下进行病理学评分并观察炎症细胞浸润情况。
1.2.2 肠黏膜固有层淋巴细胞的分离提取 处死小鼠并剪开小鼠皮肤和黏膜,暴露小鼠腹腔,用镊子轻轻取出小鼠结(直)肠并用生理盐水洗净,之后剪碎并转移至离心管,加RPMI 1640培养液至35 mL,37℃ 培养20 min;用纱布过滤后转移至原来的离心管并离心,弃上清液, 用8 mL 45% 密度梯度分离液重悬,之后缓慢加到装有5 ml 66.6%Percoll离心管并离心;回收上清液并用RPMI 1640培养液稀释。
1.2.3 FACS检测 在提取的小鼠肠黏膜固有层淋巴细胞混悬液中分别加入抗Gr-1-PE、CD11b-PerCP、F4/80-APC、CD3-PE、CD8α-APC和CD4-FITC抗体进行FACS表面染色检测中性粒细胞(CD11b+Gr1+)、巨噬细胞(CD11b+F4/80+)、CD4+和CD8+T细胞百分比。进行胞内染色时,向细胞中加入十四烷酸乙酸大戟二萜醇酯(phorbol myristate acetate, PMA)(25 ng/mL)、离子霉素(1 μg/mL)以及布雷菲德菌素A(10 μg/mL),在37 ℃条件下刺激培养5 h后回收细胞进行表面染色,随后破膜固定细胞,再加入胞内抗体染色,4 ℃孵育30min,离心洗涤,重悬沉淀物。进行FACS检测,使用FlowJo 7.6软件分析。
1.2.4 ELISA检测 将浓度为2.0×105个/mL的小鼠肠黏膜固有层淋巴细胞接种于包被抗CD3单克隆抗体的细胞培养板中,并加入稀释好的抗CD28单克隆抗体;培养48 h后回收细胞上清液,加入捕获抗体,室温孵育过夜;第2天用封闭液封闭;洗涤并分别加入标准品和样品,室温避光孵育2 h;洗涤后加入检测抗体,室温避光孵育;加入辣根过氧化物酶标记物,最后加入底物,室温避光反应20 min;加入终止液终止反应,上机检测样品光密度D(450 nm)及D(630 nm)。

2 结果
2.1 小鼠肠组织及H-E染色实验组和对照组小鼠体质量均下降,但实验组小鼠下降缓慢,小鼠肠管缩窄减轻,与对照组相比,差异有统计学意义(P<0.05)。取小鼠结(直)肠组织切片行H-E染色,镜下观察均显示上皮结构不完整,隐窝消失及炎症细胞浸润,但实验组小鼠在组织学评分方面比对照组低,且差异有统计学意义(P<0.05)。(图1)

注:与双蒸水对照组相比,*P<0.05。
2.2 小鼠肠黏膜固有层淋巴细胞亚群百分比和细胞绝对数分析T细胞亚群时,在原始FSC-SSC图中圈门淋巴细胞,以CD3为横坐标,圈门CD3+细胞,并以CD4为横轴、CD8α为纵轴分析CD4+、CD8+T细胞亚群百分比。分析中性粒细胞时,圈门CD11b+细胞,并以F4/80为横轴、Gr-1为纵轴分析中性粒细胞(CD11b+Gr-1+)和巨噬细胞亚群(CD11b+F4/80+)百分比。分析Th17亚群时,圈门淋巴细胞后,圈出CD4+淋巴细胞,并以IL-17为横轴、CD44为纵轴分析Th17亚群百分比。FACS胞外染色结果显示,与对照组小鼠比较,实验组小鼠的肠道黏膜细胞中CD11b+Gr1+细胞百分比升高(P<0.05),CD8+T细胞百分比下降(P<0.05)。FACS胞内染色结果显示,与对照组相比,实验组小鼠肠道黏膜免疫细胞中IL-17+CD4+T细胞即Th17百分比降低(P<0.05),表明骆驼奶能够调节小鼠肠道黏膜免疫细胞的百分比,诱导T细胞分化,抑制CD8+T细胞增殖(图2)。骆驼奶对小鼠TNBS诱导的急性肠炎保护作用可能与免疫调节有关。

注:与双蒸水对照组相比,*P<0.05。
2.3 小鼠肠上皮细胞培养上清液中细胞因子水平ELISA检测结果表明,与对照组相比,实验组小鼠肠道黏膜固有层淋巴细胞培养上清液中IL-17水平下降,IL-10水平升高(P<0.05),提示骆驼奶对TNBS诱导的小鼠肠道炎症细胞的作用可能是通过抑制IL-17和促进IL-10的分泌完成的(图3)。
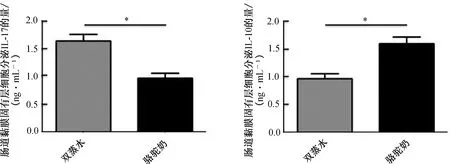
注:与双蒸水对照组相比,*P<0.05。
3 讨论
近年来,IBD的发病呈升高和年轻化趋势,其发病机制涉及饮食、吸烟、遗传、环境、免疫等多种因素。IBD典型发病症状包括腹痛、腹泻、血便等,严重损害患者生活质量。IBD的发病机制与Th1/Th2细胞比例失衡和细胞因子分泌异常密不可分,Th17在肠炎发展中的作用也至关重要。Th17可释放多种细胞因子如IL-17A、IL-17F、IL-21等,加重组织炎症反应,并促进IBD的发生与发展[5]。骆驼奶具有潜在的医用价值,其所含有的类胰岛素不易被胃酸破坏,并可增加患者血清中超氧化物歧化酶和谷胱甘肽过氧化物酶的活性。骆驼奶中的不饱和脂肪酸尤其是亚麻酸含量明显高于牛奶,1型糖尿病患者规律饮用骆驼奶后,需要胰岛素的注射剂量明显减低[4, 6]。骆驼奶中含有抗肿瘤活性成分,对乳腺癌、结直肠癌等肿瘤细胞增殖具有抑制作用[7-8]。IBD发病机制的研究基于小鼠、大鼠等动物模型,构建适宜的动物模型对研究其发病机制及病程进展十分重要。目前,建立IBD动物模型应用最广泛的方法是通过外源化学物质诱导,包括恶唑酮、TNBS及葡聚糖硫酸钠[9-10]。本研究以TNBS诱导的BALB/c小鼠肠炎模型为研究对象,模拟人肠道环境,探究骆驼奶对肠道黏膜免疫细胞增殖和细胞因子分泌的影响,进一步探究骆驼奶对TNBS诱导小鼠肠炎的保护作用。
研究发现,与双蒸水对照组相比,骆驼奶实验组小鼠体质量下降缓慢,组织学评分低,表明骆驼奶对TNBS诱导的小鼠急性肠炎有保护作用。FACS结果显示骆驼奶能有效抑制肠炎模型中小鼠CD8+T细胞亚群百分比,抑制IL-17的分泌。CD8+T细胞是CTL亚群,具有杀伤功能,有促进肠炎进展的作用。IBD患者的结肠组织中Th17比例升高,而Th17分泌IL-17参与结肠黏膜病理损伤,诱导上皮细胞分泌IL-6、IL-8、前列腺素E2等炎性因子,募集中性粒细胞。在炎症后期,IL-17促进Th分化和趋化因子生成,加重组织损伤[11-12]。骆驼奶灌胃后,CD8+T细胞亚群百分比下降,IL-17浓度降低,说明骆驼奶对小鼠急性肠炎具有保护作用。目前已知并非只有特定的T细胞亚群才能合成IL-10,几乎所有淋巴细胞均能合成IL-10。CD11b+Gr1+中性粒细胞也能合成IL-10,骆驼奶灌胃后中性粒细胞百分比增加,而ELISA结果显示小鼠肠黏膜固有层细胞分泌IL-17水平降低,而IL-10升高。IL-10作为潜在的抑炎因子,在人胃肠道稳态维持过程中起重要作用。有研究表明, 小鼠体内IL-10缺乏会诱发自发性IBD,其发病机制与Th介导的炎症反应有关[13]。骆驼奶灌胃后,小鼠体内IL-10水平增高而IL-17下降说明骆驼奶能够调节小鼠肠道细胞因子分泌,这为骆驼奶辅助临床治疗IBD提供新的可能性。
综上所述,骆驼奶对TNBS诱导的小鼠急性肠炎具有保护作用,该作用可能与免疫调节有关。骆驼奶可以抑制CD8+T细胞增殖,减少IL-17的分泌,同时促进IL-10的分泌。进一步探究骆驼奶在IBD中的保护作用是接下来的研究方向。

