唐栀子提取物对脑出血大鼠认知及运动功能的影响
迟 栋,陈永祥
(1.南阳医学高等专科学校,河南 南阳473000;2.河南中医药大学第三附属医院,河南 郑州450008)
唐栀子环烯醚萜苷是从河南省唐河县特产唐栀子中提取出的有效成分,包括山栀子苷、异栀子苷、去羟栀子苷等。研究[1-2]证实,栀子环烯醚萜苷可抑制脑出血后脑损伤,减轻脑水肿症状,降低脑出血病死率,但其治疗脑出血的具体机制尚未阐明。本研究通过建立脑出血大鼠模型,观察唐栀子环烯醚萜苷对脑出血大鼠认知及运动功能的影响,并分析其可能的作用机制,为进一步研究提供参考借鉴。
1 材料与方法
1.1 实验动物
60只健康SPF级雄性SD大鼠,3月龄,体质量(200±20)g,购自安徽医科大学实验动物中心,合格证号:0001507。在室温22~24 ℃,相对湿度45%~55%环境中适应性饲养1周,自由进食饮水,12 h交替光照,处理方法遵守动物伦理原则。
1.2 药品与主要仪器
唐栀子环烯醚萜苷购自西安佰斯特生物科技有限公司,含量98%(HPLC法),批号:20190311;Ⅳ型胶原酶(Sigma);鼠抗Caspase-3、Bax、Bcl-2单克隆抗体(Novus);鼠抗GADPH单克隆抗体(LSBio);辣根过氧化物酶HRP标记亲和纯化山羊抗鼠IgG二抗(上海一基生物有限公司);垂直电泳仪(Bio-Rad);凝胶成像仪(UVP)。
1.3 分组与建模
60只SD雄性大鼠通过双盲法分为假手术组、模型组、唐栀子环烯醚萜苷低、中、高剂量组,每组12只。采用Ⅳ型胶原酶制备脑出血大鼠模型[3-5],术前大鼠禁食12 h,腹腔注射3%戊巴比妥(300 mg·kg-1),将大鼠麻醉后固定。常规皮肤消毒并将前卤充分暴露,采用牙科钻在中线右3 cm处磨取1 mm骨窗,微型注射器进针5 mm注入0.1 mLⅣ型胶原酶(0.3 U·μL-1),1 min内注射完毕。留针5 min,退针至硬脑膜后留针2 min,之后完全退针,并缝合切口。大鼠苏醒后须单笼饲养。模型组与唐栀子环烯醚萜苷低、中、高剂量组通过上述方法建模,假手术组同上述操作但不注射Ⅳ型胶原酶。术后参考Longa评分法[6]筛选动物模型,无神经功能缺损记为0分;前爪无法完全伸展,表现出轻度神经功能缺损记为1分;行走时向瘫痪侧转圈,表现出中度神经缺损记为2分;行走时向瘫痪侧倾倒,表现出重度神经功能缺损记为3分;无法行走,丧失意识记为4分。评分1~3分表示建模成功,剔除建模失败与死亡大鼠,最终各组均保留10只大鼠进行后续实验。
1.4 给药治疗
建模1 d后,唐栀子环烯醚萜苷低、中、高剂量组大鼠分别腹腔注射7.5、15、30 mg·kg-1剂量的唐栀子环烯醚萜苷,假手术组与对照组则注射等量生理盐水,连续治疗1周。治疗期间通过Morris水迷宫实验观察大鼠认知功能变化,通过平衡木行走实验观察大鼠运动功能变化。治疗1周后,将大鼠麻醉取出脑组织检测脑组织含水量,采用Western blot法检测病灶组织Caspase-3、Bax、Bcl-2蛋白表达水平。
1.5 Morris水迷宫实验
准备内径约160 cm的Morris水迷宫圆形池,水池内水深30 cm,水温23~25 ℃,水池内壁涂黑,将其划分为面积相同的4个象限,并随机选取任一象限设置水下隐蔽平台(水面下1 cm)。给药1 d后各组大鼠进行定位巡航实验,将大鼠面向池壁从随机象限入水点放入池中,记录大鼠找到水下隐蔽平台并站立(停留至少3 s)所需时间(逃避潜伏期)。若大鼠入水后2 min内未能找到隐藏平台,则用长棍将大鼠诱导至平台,令其在平台上站立30 s,此时,逃避潜伏期记为2 min。连续测量5 d,第6天将水下隐蔽平台撤除,进行空间探索实验,记录2 min内大鼠穿越平台位置的次数。
1.6 平衡木行走实验
准备一长80 cm,宽2.5 cm的平衡木,放置于距水平面10 cm处,将大鼠放置于平衡木上,根据大鼠表现记录评分。大鼠在平衡木上站稳持续2 min记为1分;大鼠在平衡木上站立并左右摇晃但未跌落持续2 min记为2分;大鼠在平衡木站立时间超过30 s但不足2 min即跌落记为3分;大鼠在平衡木站立不足30 s即跌落记为4分;大鼠无法站立,立即从平衡木跌落记为5分。
1.7 脑组织含水量检测
麻醉处死大鼠后将其脑组织分离,剥去小脑、脑干、嗅球等部分后称取湿重(W),称重后放入恒温干烤箱内,110 ℃烘烤24 h后称取干重(D),脑含水量=(W-D)/W×100%。
1.8 Western blot法蛋白表达水平检测
取适量病灶组织研磨制备成匀浆,加入蛋白抽提试剂置于冰上裂解30 min。离心取上清液,调整蛋白浓度后加入Buffer变性后上样进行电泳。孵育、转膜、显色、成像并进行结果分析。
1.9 统计学分析
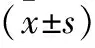
2 结果
2.1 各组大鼠认知功能比较
各组大鼠逃避潜伏期均表现出随时间变化而不断缩短的趋势,模型组大鼠3 d起逃避潜伏期均明显长于假手术组(P<0.05),穿越平台次数明显少于假手术组(P<0.05),提示脑出血会影响大鼠的认知功能。与模型组比较,唐栀子环烯醚萜苷中、高剂量组大鼠3 d起逃避潜伏期明显缩短(P<0.05),穿越平台次数明显增多(P<0.05),提示唐栀子环烯醚萜苷可改善脑出血大鼠认知功能。见表1、表2。

表1 各组大鼠逃避潜伏期时间比较
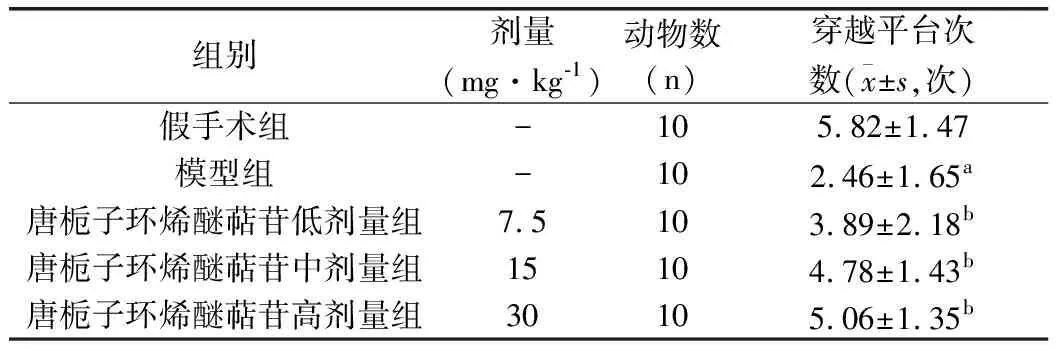
表 2 各组大鼠穿越平台次数比较
2.2 各组大鼠运动功能比较
模型组大鼠平衡木行走实验评分持续升高,2 d起明显高于假手术组(P<0.05),提示脑出血会影响大鼠的运动功能。唐栀子环烯醚萜苷各剂量组大鼠平衡木行走实验评分持续升高,在3 d达到峰值并逐渐下降,3 d起唐栀子环烯醚萜苷中、高剂量组大鼠平衡木行走实验评分均明显低于模型组(P<0.05),提示唐栀子环烯醚萜苷可改善脑出血大鼠运动功能。见表3。

表3 组大鼠平衡木行走实验评分比较
2.3 各组大鼠脑组织含水量比较
与假手术组比较,模型组大鼠脑组织含水量明显升高(P<0.05);与模型组比较,唐栀子环烯醚萜苷各剂量组大鼠脑组织含水量明显下降(P<0.05),提示唐栀子环烯醚萜苷可有效改善脑出血脑水肿症状。见表4。
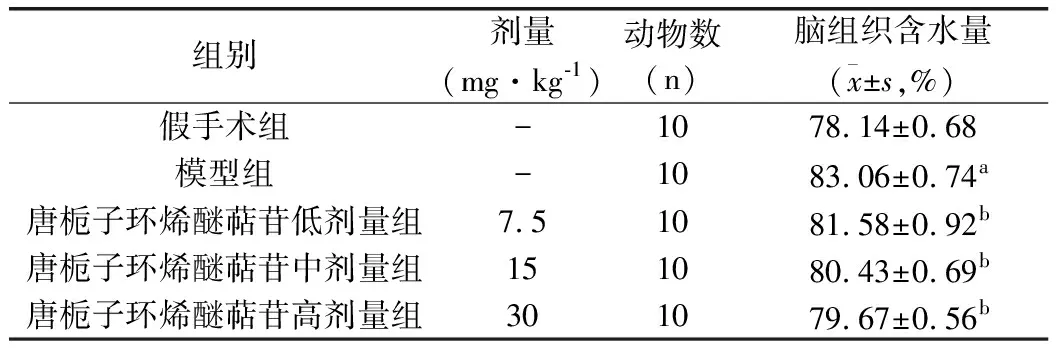
表4 各组大鼠脑组织含水量比较
2.4 各组大鼠Caspase-3、Bax、Bcl-2蛋白表达水平比较
与假手术组比较,模型组Caspase-3、Bax蛋白表达水平明显上调(P<0.05),Bcl-2表达水平明显降低(P<0.05);与模型组比较,唐栀子环烯醚萜苷各剂量组Caspase-3、Bax蛋白表达水平明显下降(P<0.05),Bcl-2表达水平明显升高,差异有统计学意义(P<0.05)。见表5、图1。
表5 各组大鼠Caspase-3、Bax、Bcl-2蛋白表达水平比较
3 讨论
脑出血发生时病灶部位由于炎性浸润会产生大量炎性因子、氧自由基等毒性代谢产物,从而损害神经元细胞并诱导细胞发生凋亡[7]。细胞凋亡是不同于程序性死亡的另一种形式,主要受相关基因调控[8]。Caspase家族介导并执行细胞凋亡,Caspase-3则参与细胞凋亡通路的核心环节。
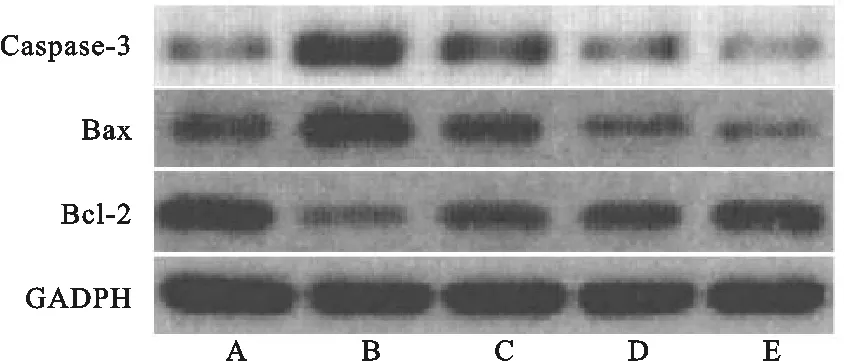
注:A假手术组;B模型组;C唐栀子环烯醚萜苷低剂量组;D唐栀子环烯醚萜苷中剂量组;E唐栀子环烯醚萜苷高剂量组
Caspase-3被激活后可对不同底物进行切割并促使细胞核固缩,导致神经元DNA发生断裂并抑制细胞增殖[9]。Caspase-3蛋白表达水平上调不仅表示细胞凋亡加剧,也是出血性脑损伤的重要标志[10]。在哺乳动物细胞凋亡过程中,Bcl-2家族中的Bcl-2、Bcl-xL等凋亡抑制因子与Bax、Bak等促凋亡因子也起着至关重要的调控作用[11]。Bcl-2可调控线粒体外膜通透转运孔道复合体阻止促凋亡蛋白释放,从而抑制细胞凋亡进程。Bax受到凋亡信号刺激被激活后会发生磷酸化进入线粒体内,并与Bcl-2形成二聚体形成Bax大孔通道,与Bcl-2等蛋白发生对抗,发挥促凋亡作用[12]。故观察病灶组织Caspase-3、Bax、Bcl-2表达水平,即可直接反映脑出血大鼠细胞凋亡程度。
涂鄂文等[13]设计了脑出血大鼠实验观察槲皮素对大鼠神经细胞凋亡及Bcl-2、Bax蛋白表达的影响,发现槲皮素可以增加Bcl-2/Bax蛋白比值,从而抑制神经细胞凋亡,减轻大鼠神经损伤,槲皮素可提高病灶组织过氧化物歧化酶活性并降低丙二醛含量,从而减少氧自由基诱导的细胞凋亡过程。潘冬梅等[14]采用黄芪甲苷对高血压脑出血大鼠实施干预,发现其可减轻高血压脑出血大鼠氧化应激反应,改善大鼠神经行为学缺陷。郭辉等[15]发现,黄芪总皂苷能保护脑出血大鼠神经功能并减轻大鼠脑水肿程度,认为其机制在于抑制细胞凋亡。可见,抑制神经细胞凋亡是保护脑出血大鼠神经功能,减轻脑损伤的重要机制。
环烯醚萜苷是栀子药材中的有效化学成分,具有清热抗炎等药理作用,栀子苷(京尼平苷)是其中的代表成分[16]。动物学研究[17]表明,给予大鼠60 mg·kg-1京尼平苷灌胃,在肾脏中检出最高浓度,其次为肝、脾、脑。而且京尼平苷入脑后主要分布在神经递质较为丰富的海马部位[18],为环烯醚萜苷治疗各类脑损伤疾病奠定了基础。现代药理研究证实,栀子在神经保护、抗炎、抗氧化应激等方面均有一定的活性。曹静等[19]发现,栀子苷可以提高大鼠在Y迷宫中的学习与记忆能力。步楠等[20]发现,栀子苷可有效缓解溃疡性结肠炎模型大鼠疾病症状并抑制炎性因子表达水平。因此,猜测环烯醚萜苷治疗脑出血大鼠也会有一定效果,故设计动物学实验探究其可能的作用机制。结果表明,脑出血发生后大鼠脑组织含水量增加,且认知及运动功能均明显下降,Caspase-3、Bax蛋白表达水平上调,Bcl-2表达水平明显降低提示细胞凋亡加剧。给予大鼠唐栀子环烯醚萜苷干预后,大鼠Caspase-3、Bax蛋白表达水平明显下降,Bcl-2表达水平明显升高,大鼠认知及运动功能明显改善,脑水肿程度明显下降,说明唐栀子环烯醚萜苷可有效缓解脑出血疾病症状,其可能的机制在于调控凋亡基因并抑制细胞凋亡。
综上,唐栀子环烯醚萜苷可通过下调Caspase-3、Bax蛋白并提升Bcl-2蛋白表达抑制细胞凋亡进程,从而对脑出血大鼠认知及运动功能起到保护作用。

