tRNA来源的小RNA(tRF)的生物学功能及在癌症中的作用
许琳枫,王显仪,柴彬淑,马中良
转运RNA(tRNA)是普遍存在的核酸,占整个细胞RNA的4%~10%。在体内主要存在3种核酸,即信使RNA(mRNA)、转运RNA(tRNA)和核糖体RNA(rRNA)。由中心法则可知,遗传信息是从DNA 传递给mRNA,然后通过翻译过程传递给蛋白质。tRNA将氨基酸运送至核糖体,从而将mRNA模板中的遗传信息翻译成相应的多肽链。原先认为tRNA在完成其转运使命后便发生降解,然而,越来越多的研究表明,来源于tRNA 的小片段RNA(tRNA-de‐rived Fragments,tRFs)不仅是在tRNA二级结构的不同位点进行切割而得的产物,而且还是病理以及生理过程中具有调节性的重要的非编码RNA。
1 tRF的形成与分类
tRF 起初在原核生物中被发现,之后也发现其广泛存在于真核生物哺乳动物中,并且与应激反应有关,比如在低氧、氧化、病毒侵染等应激情况下,可能会产生更多的tRF[1]。另外,由于tRF 的序列长度与微小RNA(microRNA,miRNA)十分相似,所以在非编码RNA 研究的早期阶段,研究某些tRF(如tRF-1280、ts-53、ts-101 等)时,常将其当做miRNA做进一步探究。
对于tRF 的命名,有些是根据其发现或发表的时间顺序来命名,例如tRF-3006;此外,像tRNA‐Gly-GCC 这个tRF的命名由来是mRNA 上的密码子与tRNA 上的反密码GCC 配对,识别出tRNA 所携带的氨基酸Gly。
1.1 tRFs 主要种类 tRF 主要有3 种,包括tRF-5,tRF-3 和tRF-1。tRF-5 和tRF-3分别来源于成熟tRNA 的5′端和3′端,所以又称为5′tRF 和3′tRF。tRF-5 是由Dicer 酶在D 环和反密码子环之间的不同位置切割产生,根据切割位点的不同,tRF-5可分为3种亚型:tRF-5a(最短)、tRF-5b和tRF5c(最长)。先前有研究表明tRF-5 和tRF-3 是靠Dicer 切割产生,然而,最近有研究者发现,tRF-5 和tRF-3 可能不是只由Dicer切割,还有别的物质参与切割过程。tRF-3 是由血管生成素(Angiogenin,ANG)、Dicer 或核酸外切酶在TψC 环切割产生的,根据在T 环上切割位点的不同,tRF-3分为tRF-3a和tRF-3b。此外,在tRF-3的尾部,有一个“CCA”三核苷酸序列,在3′端经过RNA 酶Z(RNaseZ)切割,形成的tRF 称为3′CCA tRF。tRF-1 来源于前体tRNA 的3’UTR 区域(非翻译区),又称3‘U-tRF,它是由具有PolyU 序列的RNA酶Z(RNaseZ)切割产生的[2]。
除了主要的3 种tRF 外,还有tRF-2 和i-tRF。tRF-2 是在缺氧条件下,tRNA 的反密码子环发生分解产生的。i-tRF与上述类型的tRF不同,主要来自成熟的tRNA 内部区域(除了5′末端和3′末端以外的区域)。有趣的是,i-tRF 的命名是根据tRNA 中5‘末端的起始位置。A-tRF、V-tRF 和D-tRF 分别是从反密码子环、可变区以及D 环上切割产生的片段[3]。
1.2 tRNA 半分子 tRNA 半分子(tRNA Halves,tiRNAs)是与tRNA 相关的另一种小片段RNA。应激诱导反应下,刺激血管生成素促进tRNA裂解,从而产生tiRNA。它是由血管生成素从成熟tRNA 的反密码子环上的不同位点切割生成,长度大致为tRNA 的一半30-40 nt。同样依据切割位点的不同,包含5′序列以及反密码子环的称为5′tiRNA,而含有3′序列和反密码子环的称为3′tiRNA[4]。
目前,根据大数据的分析发现tRF 的种类越来越多,Yao等[5]已开发出tRF 的在线数据库资源——OncotRF(http://bioinformatics.zju.edu.cn/OncotRF),它是识别诊断和预后生物标志物、开发癌症治疗靶点和研究癌症发病机制的宝贵资源库。MINTbase(http://cm.jefferson.edu/MINTbase/)是一个含有多种人体组织中发现的tRF 的数据库,可从中获取有关tRF 的最大丰度和数据信息;此外还能够生成各种癌症类型的tRF的相对丰度图并将其转换为数字形式表示[6]。上述两个数据库为将tRF 用于癌症的临床诊断、预后以及进一步的研究提供了科学依据。
2 tRF的生物学功能以及作用机制
tRF 和tiRNA 通过多种机制发挥生物学作用,包括抑制翻译过程、调节基因表达、调控细胞周期等,此外,Torres 等[7]发现tRNA 基因的差异表达会导致tRF 的丰度发生变化,而不是成熟tRNA 的丰度改变。
2.1 抑制翻译过程 tRF 和tiRNA 以多种方式抑制翻译。比如tRF 和tiRNA 可以通过影响核糖体的形成来抑制蛋白质翻译起始[8]。tiRNA(主要是5′tiRNA)可以使翻译速度降低10%~15%。由于tRNA 是蛋白质生物合成的关键分子,所以tRNA 破坏可能导致翻译受到抑制。研究表明,某些特定的tiRNAs 可以组装成G-四链结构(G4-Motif),它能够竞争性地与翻译起始复合体中的eIF4G/eIF4A/eIF4E结合,形成的复合物位于mRNA帽子结构上,从而抑制mRNA 翻译[9]。Lee 等[10]研究发现,由tRF-3、Argonaute 3(Ago3)和Argonaute 4(Ago4)结合形成的沉默复合物,直接结合靶基因的mRNA,使其进入特定的细胞质加工体,并带有大量的mRNA降解酶,最终通过降解靶基因的mRNA来抑制靶基因的翻译。
2.2 调节基因表达 tRF 和tiRNA 参与调节基因表达。Kumar 等发现,一些tRF 优先与Ago 蛋白家族结合,并且Ago 和Dicer 是参与RNA 干扰过程中基因沉默调控的重要因子。Choi 等研究发现来源于成熟tRNA5′端的tRNAGlu-CTC 在Ago1 和Ago4 作用下发挥基因沉默功能。Torres 等发现,近一半的人类tRNA 基因表达沉默或低表达。在HIV-1 感染的细胞中发现了来源于tRNALys 的tRF-3006,并且具有高丰度。另外,tRF-3006 使报告基因沉默并与Dicer和Ago2结合,促使了抑制HIV[11]。
tRF-1、tRF-3 和tRF-5 可能通过与Piwi 蛋白或Ago 蛋白相互作用来调节基因表达,从而影响基因的沉默。在胚胎干细胞和胚胎中,来源于tRNAGly-GCC 的tRF-5 抑制内源性反转录相关基因的表达。Piwi 蛋白Twi12 与tRF-3 相互作用形成tRF-3-Twi12复合物,该复合物与Xrn2和Tan1协同作用,共同调节rRNA的加工过程[12]。
2.3 调节细胞周期 tRF 和tiRNA 通过参与细胞周期过程来调节细胞增殖。敲低tRF-1001 可以干扰细胞增殖,将细胞停滞在G2 期,并抑制DNA 的生物合成[13]。
tRF 还可通过与细胞色素C(Cytochrome C,Cyt C)结合防止细胞凋亡。先前有研究表明,成熟的tRNA 分子可以与Cyt C 结合,抑制细胞凋亡体的形成和caspase 9的活性,从而促进细胞存活。在高渗透压条件下,部分tRF 在血管生成素作用下可以与线粒体释放的Cyt C 形成核糖核蛋白复合体,从而抑制细胞凋亡体的形成和活性[14]。由此可见,tRF与Cyt C 之间相互作用引发一系列生物学过程,导致细胞凋亡受到抑制,这渐渐被认为是一种新的抗细胞凋亡机制。
3 tRF在癌症中的研究进展
3.1 tRF 与癌症相关信号通路 tRF 可以通过调控癌基因或抑癌基因的表达,参与癌症相关的信号通路,从而影响一系列与癌症发生,发展相关的生物学过程。并且tRF 在多种恶性肿瘤细胞中具有功能活性[15]。
在结直肠癌(Colorectal Cancer,CRC)中,tR‐NALeu 和tRF/miR-1280 通过抑制可维持肿瘤干细胞类似细胞功能的Notch 信号通路,从而抑制CRC的生长和转移。Wang 等研究发现,由于上皮细胞凋亡和过氧化物酶增殖物激活受体信号通路,导致发生负反馈调节,所以tiRNATyr-GTA 在CRC 中具有作为治疗靶点的潜能。在大肠癌中,一些tRF 主要作用于含维生素的代谢途径和环鸟嘌呤一磷酸/蛋白激酶G信号通路,并且它们的靶点是部分差异表达的mRNAs[2]。此外,癌基因AURKA 通过调节Wnt/β-catenin 和PI3K/AKT 信号通路使组蛋白甲基化,从而诱导上皮向间质转化,所以AURKA 可作为胃癌治疗的潜在靶点。另外,由tRNAGlu,tRNAAla,tRNAAsp 和tRNATyr衍生的一类新的tRFs,通过取代YBX1中的3‘-UTR来抑制乳腺癌细胞中多个致癌基因转录本的稳定性,对癌症产生抑制作用。这里的YBX1 是一种多功能的RNA 结合蛋白,参与多种细胞信号转导途径,在多种癌症中过表达[16]。由此可见,许多信号通路的调节与人类癌症疾病密切相关。
3.2 诊断及预后的生物标志物 tRF在癌症中的异常表达引起了广泛关注,我们通过一些技术如基因组测序等探索到tRF 作为生物标志物在临床中的应用。尽管tRF 作为生物标志物的研究仍处于初步阶段,但已有一些新的研究进展。
在非小细胞肺癌(Non-small Cell Lung Cancer,NSCLC)患者血清样本中,tRFLeu-CAG 表达水平较高,并且在IV 期患者样本中的表达最显著,,所以tRFLeu-CAG 可以作为NSCLC 诊断的生物标志物[17]。Ana 等检测到了来自5’端的tRNAVal-CAC,tRNAGlu-CTC在大肠癌中表达水平较高,由此认为tRNAVal-CAC 和tRNAGlu-CTC 有可能成为诊断大肠癌的生物标记。Mo等发现5‘tiRNAVal通过抑制Wnt信号通路而成为一种新的肿瘤抑制因子,其可能成为乳腺癌的潜在诊断生物标志物。Michael 等研究发现,tRNALys-CTT 和tRNAPhe-GAA 在前列腺癌的不同分期中存在差异表达,并且来源于tRNALys-CTT 的tRF-315 以及来源于tRNAPhe-GAA 的tRF-544,它们在前列腺癌中的表达水平分别上调和下调,所以,它们可能成为评估前列腺癌病情和预后的潜在生物标志物。此外,来源于tRNA 内部区域的tRNAGly-CCC是慢性淋巴细胞白血病(Chronic Lymphocytic Leukemia,CLL)预后不良的潜在生物标志物,还可用于筛查CLL。tRF-5s也可用于检测牛白血病病毒(Bovine Leukemia Vi‐rus,BLV)的情况。在肾透明细胞癌中,tRFVal-AAC的表达水平与肿瘤分期有关,在Ⅲ/Ⅳ期时,tRFVal-AAC表达水平显著降低,因此有望成为癌症诊断标志物。此外,tRF 还可以作为生物标志物来区分乳腺癌中肿瘤衍生的细胞外囊泡[18]。
tRF 也被认为是潜在的非侵入性生物标志物。在非三阴性乳腺癌患者中,tDR-7816、tDR-5334 和tDR-4733 在血清中的丰度低于健康对照组,这些tRF 可用来判断非三阴性乳腺癌的发生与否。其中,tDR-7816可能通过影响异种代谢过程促进乳腺癌的发生。在急性组织器官损伤过程中,循环系统的tRF 水平升高,使得tRF 在15 个敏感基因中比其他已知的组织损伤标志物更敏感,所以其具有作为识别器官损伤的新标志物的潜力。在肿瘤患者的尿液和血清中也能检测到tRFs。此外,最新研究表明,来自tRNA5′末端的六个tRF(tRFGlu-CTC-003,tRFGly-CCC-007,tRFGly-CCC-008,tRFLeu-CAA-003,tRFSer-TGA-001,tRFSer-TGA-002) 在早期乳腺癌(Early Breast Cancer,EBC)患者的血浆样品中表达水平显著下调,可作为EBC 的新型诊断生物标志物[19]。
因此,tRF 有可能成为癌症诊断的新的生物标志物,这显示了其潜在的临床应用价值,但还需进行深入的评估。表1 为目前已发现的具有生物标志物功能的tRF。
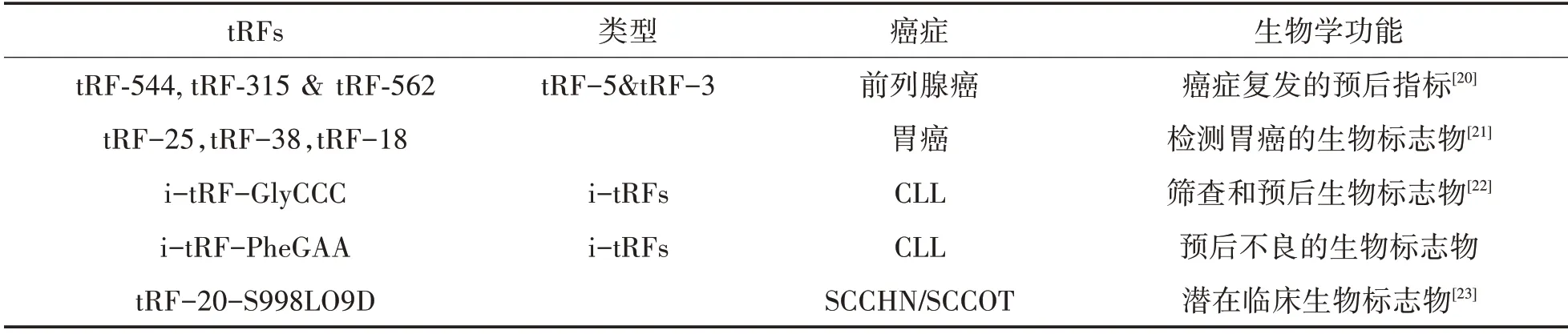
表1 具有生物标志物功能的tRF
3.3 精准治疗的靶标 tRF不仅可以发挥生物标志物的功能,而且还具有开发癌症靶向治疗的新可能。在人T 细胞白血病病毒1 型(the Human T-cell Leukemia Virus Type 1,HTLV-1)转化的细胞中,tRF-3019表达水平较高。其中HTLV-1是一种引起恶性T 细胞白血病的逆转录病毒。Ruggero 等[24]发现tRF-3019 能够启动HTLV-1 逆转录酶,并在病毒中大量存在,所以有可能成为控制HTLV-1 感染的新靶点。
Kim 等的研究发现,抑制3‘端来源的tRFLeu-CAG 导致患者的原位肝癌细胞凋亡。tRFLeu-CAG与至少两个核糖体蛋白mRNAs 相互作用,以增强蛋白质翻译。因此,这种抑制减少了核糖体蛋白的翻译,并导致核糖体亚基减少。例如,RPS28 mRNA 的翻译减少导致pre-18S核糖体RNA处理受阻,最终抑制了40S 核糖体亚基的产生。这表明tRFLeu-CAG可能成为潜在的癌症靶标[25]。
此外,还发现tRFLeu-CAG 在非小细胞肺癌中的表达水平升高,Ⅲ、Ⅳ期水平升高显著,并且抑制tRFLeu-CAG则可抑制AURKA癌基因的表达,即使癌细胞的增殖受到抑制,所以tRFLeu-CAG 有潜力作为治疗靶点[17]。分别来自于tRNAGly-GCC-1-1和tRNAGly-GCC-1-2 的tDR-0009 和tDR-7336在三阴性乳腺癌(Triple Negative Breast Cancer,TNBC)中高表达,并且与阿霉素在调节干细胞以及细胞对IL-6的反应中有关[26]。所以tRF 可能在耐药中也发挥重要作用,值得进一步研究。
3.4 tRF在其他肿瘤中的作用 在B细胞淋巴瘤细胞中,tRF-3027 通过抑制一种内源性单链DNA 结合蛋白RPA1来抑制细胞增殖并可调节DNA 损伤。最新有研究发现,来源于前体tRNASer 的tRF-1001,在许多肿瘤细胞系中高表达。敲除tRF-1001 基因可抑制肿瘤细胞增殖以及DNA 生物合成。此外tRF3E 通过核仁素(Nucleolin,NCL)介导的机制在乳腺癌发病机制中发挥重要作用,从而抑制肿瘤发生[27]。
在本实验室研究中,发现了tRFLeu-CAG 是来源于5'tRNA 的半分子,并且可以促进非小细胞肺癌(NSCLC)的发展,同时在NSCLC 中是高表达的。随着临床分期的不同,tRFLeu-CAG 表达呈现上调趋势。另外还研究发现tRFLeu-CAG 可以在NSCLC 中引起化学药物抗性和诱导自噬。有趣的是,Veneziano等[28]还发现在CLL中,tRF的表达出现失调情况。目前已确定的tRFs 的类型以及在癌症中的生物学功能如表2所示。
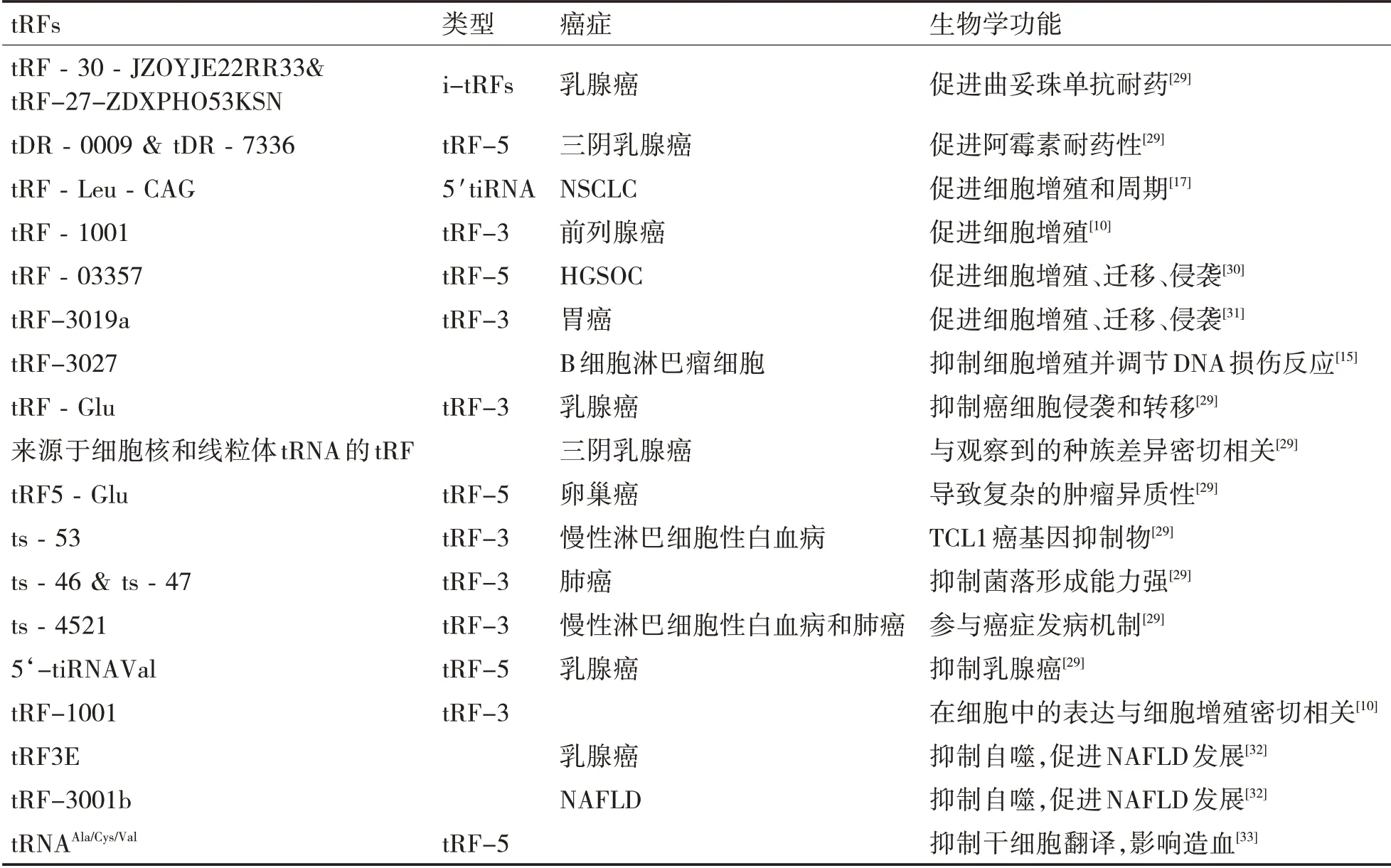
表2 已证实的tRF的类型以及在癌症中的作用
4 总结与展望
目前,已经证实了微小RNA(microRNA,miRNA)、环状RNA(circular RNA,circRNA)以及长链非编码RNA(Long Non-coding RNA,lncRNA)的调节作用,tRF 在转录和转录后水平表达调控中发挥重要作用[34-36]。
近年来tRF 的研究取得了一些重要进展,其在调控基因表达、蛋白质翻译等生物学功能方面发挥着不同的作用,并与各种癌症发展密切相关,既可促进肿瘤发生,也具有抑制癌症发展的潜力。
随着精准医学的兴起,tRF 的临床潜力也引起了广泛关注。tRF 可被用作诊断性生物标志物,治疗靶点和预后性生物标志物。在临床开发方面,开发新的试剂盒以及研制新型药物,tRF 因其独特性可充分发挥重要作用。
tRF 为癌症的探索和治疗提供了新的方向,在该领域的研究中已经取得了许多令人鼓舞的成果,OncotRF 和MINTbase 数据库的建立已为我们提供了很多便利,但同时对tRF 的研究仍然存在许多挑战。我们对tRF 的生物发生过程以及分子机制尚不清楚。例如,tRF由血管生成素(ANG)、Dicer或核酸外切酶等多种酶剪切而来,这些酶受到怎样的信号调控,以及某些和miRNAs 具有相似大小的tRF能否以miRNA 的作用方式发挥作用,依然未知。并且tRF 与其他非编码RNA(miRNA、lncRNA、circRNA)之间的作用仍未明确阐述,以及在早期研究中,将tRF 认为是miRNA,二者间的区别与联系目前尚未清晰。此外,tRF 由tRNA 剪切而来,那么tRF 的出现对tRNA 有怎样的影响,能否使tRNA 发挥正常的转运氨基酸作用,在氨基酸代谢中是否发挥重要角色,依然值得探究。在临床应用时,tRF有可能会造成耐药性,耐药问题的解决还有待进一步研究。此外,与tRF 相关的蛋白质、作用的靶基因以及调控的信号通路还有待进一步丰富。并且我们需要更精确和智能的检测分析技术来提高研究效率,以实现对tRF 作用机制的探索和临床应用的可能性。
总而言之,在未来临床医学上,tRF 在肿瘤治疗方面具有巨大的应用潜力,这为我们抗击癌症提供了新手段。

