强直性脊柱炎患者外周血IL-18系列的表达
付晓宇,刘建民
(锦州医科大学附属第一医院检验科,辽宁 锦州 121000)
强直性脊柱炎是一种病因尚不清楚的慢性风湿免疫性疾病,诊断时间长、当前可用疗法的相对不足都迫切需要对疾病发病机理有更深入的了解。疾病早期表现为炎性腰背痛,休息后或夜间加重,活动后减轻。随着疾病的发展,患者逐渐由出现骶髂至脊柱、髋关节的异位骨化,最终导致关节囊、脊柱周围韧带等等非骨质结构发生不可逆转的异位骨化。疾病晚期特征性的脊柱“竹节样变”和髋关节骨性强直融合是致畸、致残的关键原因[1-2],不仅限制患者身体活动范围并带来难以忍受的疼痛,还会影响患者的心理健康[3]。虽然具体机制尚不明确,但研究表明,AS的疾病发展主要包括炎症和新骨形成两个阶段[4],TNF-α对AS的炎症发展起重要作用,目前肿瘤坏死因子拮抗剂是治疗AS的主要药物[5]。在对AS的早期抗炎治疗中,虽能有效缓解强直性脊柱炎的早期症状[6],但并没有完全阻止晚期异位骨化的进展。反映AS的炎症过程能促进异位骨化,但二者是两个相互独立的过程[7]。作为重要的细胞因子,IL-18与TNF-α在强直性脊柱炎患者血清中表达水平呈正相关[8]。IL-18是否参与了AS的发生发展,是通过炎症反应促进异位骨化,还是直接参与异位骨化并不清楚。本实验用检测T细胞、中性粒细胞、B细胞、单核细胞中IL-18、IL-18R及IL-18BP的表达水平,探究IL-18、IL-18R及IL-18BP是否参与AS疾病发生,以及其主要的效应细胞,希望可以为延缓或抑制强直性脊柱炎骨化进展提供新的研究方向。
1 资料与方法
1.1 一般资料
严格按照1984年修订的纽约标准及骶髂关节X线表现[9],选择2018年12月至2019年12月在锦州医科大学附属第一医院就诊的45例强直性脊柱炎患者,并排除其他风湿免疫性疾病等疾病。X线表现II级及以下为疾病早期组有24人,其中男性18例,女性6例,年龄18~57岁;III级及IV级为疾病晚期组有21人,其中男性16例,女性5例,年龄18~57岁。选择同时期在该院进行体检的45例健康人作为健康对照组(healthy control,HC),其中男性30例,女性15例,年龄18~57岁。两组受试者均知情同意本次研究。本研究已获得伦理委员会批准实施,两组性别、年龄构成比差异无统计学意义(P>0.05),具有可比性,见表1。

表1 研究对象的一般资料
1.2 方法
1.2.1 收集血液样本
抽取所有受试者3 mL空腹静脉血于含EDTA抗凝剂的采血管中。
1.2.2 采用全自动血沉分析仪检测血浆ESR水平
采用免疫透射比浊法检测血清CRP水平,全自动生化分析仪检测血清ALP水平,采用酶联免疫吸附法检测血清中TNF-α、IL-18水平。
1.2.3 流式细胞术
离心弃上清后加入死细胞去除液和人Fc受体阻断剂,室温避光孵育15 min,依次加入抗CD4、CD8、CD16、CD19、CD14和抗IL-18R抗体,避光孵育15 min后裂解红细胞离心,用固定/透明液固定细胞,依次加入抗IL-18抗体和抗IL-18BP抗体孵育30 min,透膜洗液清洗后加入BV510耦合驴抗兔Ig-G抗体,流式细胞仪检测T细胞、中性粒细胞、B细胞、单核细胞的IL-18R、IL-18、IL-18BP的表达[10-11]。
1.3 统计学方法
所有数据均用GraphPad Prism 8.0进行统计学分析。组间比较采用t检验,Spearman秩相关进行相关性分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组外周血中CRP、ESR、TNF-α、ALP、IL-18水平
AS组外周血中CRP、ESR、TNF-α、ALP、IL-18水平较健康组高(P<0.05),TNF-α、IL-18、ALP在疾病晚期组较疾病早期组高(P<0.05),且TNF-α与IL-18两者正相关(P=0.007,r=0.4887),CRP、ESR在疾病早期组与疾病晚期组差异无统计学意义,见表2~4。

表2 AS组与健康对照组CRP、ESR、TNF-α、ALP、IL-18水平比较

表3 疾病早期组与疾病晚期组CRP、ESR、TNF-α、ALP、IL-18水平比较
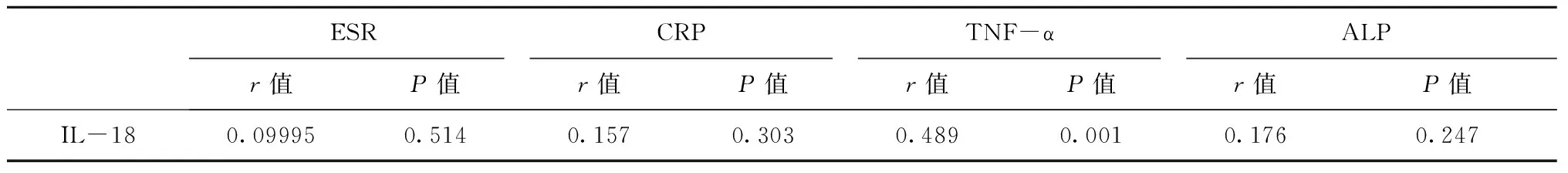
表4 AS组CRP、ESR、TNF-α、ALP与IL-18的相关性分析
2.2 在强直性脊柱炎异位骨化患者外周血中表达IL-18的CD14+单核细胞比例升高
结果显示,与健康对照组相比,在强直性脊柱炎异位骨化患者外周血中IL-18+单核细胞比例升高,IL18+的CD4+T细胞、CD8+T细胞、CD16+中性粒细胞、CD19+B细胞的MFI升高,见图1~2。
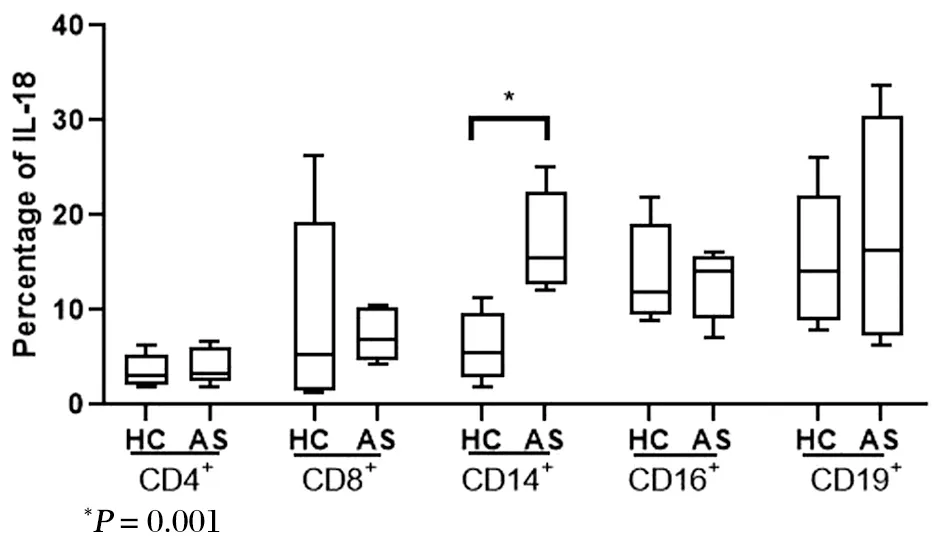
图1 健康组与强直性脊柱炎组外周血IL-18+细胞的百分比
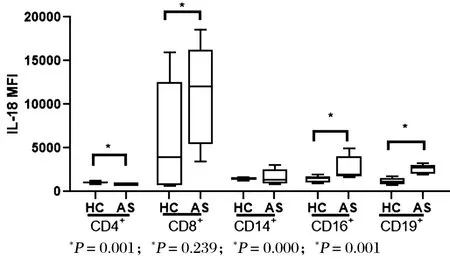
图2 健康组与强直性脊柱炎组外周血各细胞IL-18 MFI的表达变化
2.3 在强直性脊柱炎异位骨化患者外周血中表达IL-18R的CD8+T细胞水平及CD8+T细胞IL-18R的MFI明显升高
AS异位骨化患者组与健康对照组相比,表达IL-18R的CD8+T细胞比例及IL-18R+CD8+T细胞的MFI明显升高,表达IL-18R的CD4+T细胞、CD14+单核细胞、CD16+中性粒细胞、CD19+B细胞的细胞比例及MFI差异无统计学意义,见图3~4。
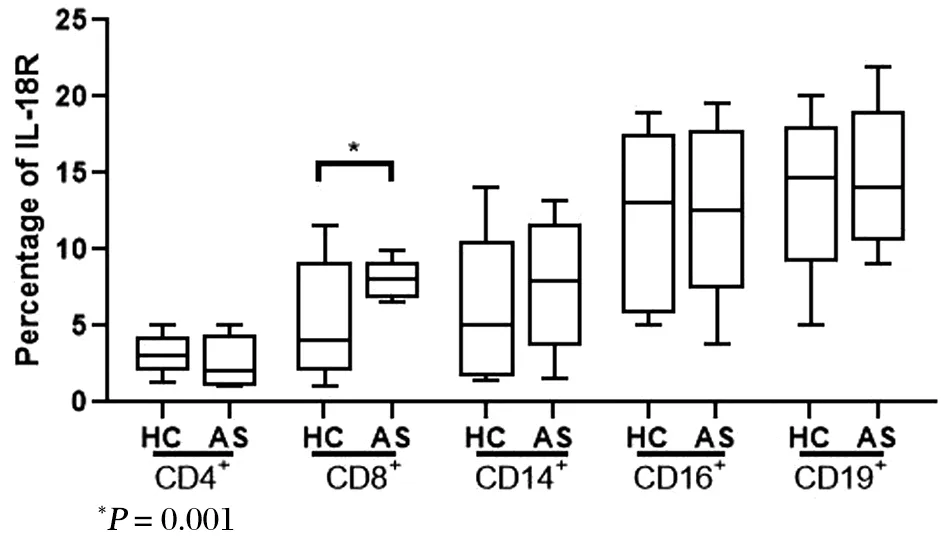
图3 健康组与强直性脊柱炎组外周血IL-18R+细胞的百分比

图4 健康组与强直性脊柱炎组外周血各细胞IL-18R MFI的表达变化
2.4 在强直性脊柱炎异位骨化患者外周血中IL-18BP+CD8+T细胞的MFI降低
结果显示,较健康对照组,AS异位骨化患者外周血中IL-18BP+CD4+T细胞的细胞比例升高,MFI降低;IL-18BP+CD8+T细胞的细胞比例差异无统计学意义,MFI降低;CD14+单核细胞、CD16+中性粒细胞的细胞比例及MFI差异均无统计学意义;IL-18BP+CD19+B细胞比例下降,MFI升高,见图5~6。
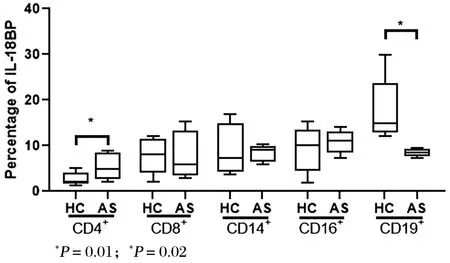
图5 健康组与强直性脊柱炎组外周血IL-18BP+细胞的百分比
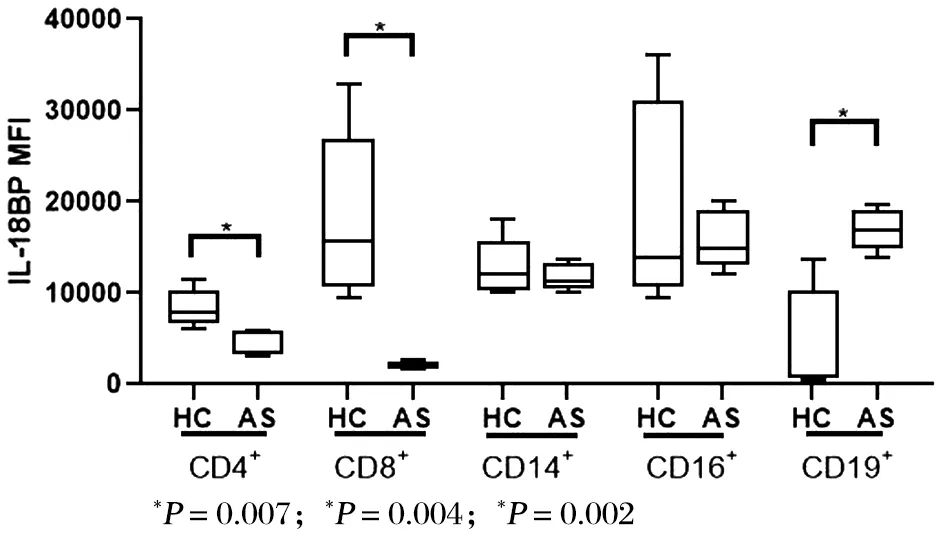
图6 健康组与强直性脊柱炎组外周血各细胞IL-18BP MFI的表达变化
3 讨 论
强直性脊柱炎是一种好发于青壮年的致畸致残的慢性风湿免疫性疾病,存在炎症和骨化两个阶段。炎症在AS疾病早期开始出现,加重骨破坏,促进新骨形成[12]。但炎症与新骨形成是两个相互关联又相互独立的过程,目前抑制炎症的主要药物抗TNF-α并不能完全阻止骨化,说明AS可能不止通过TNF-α介导的炎症来促进异位骨化。TNF-α、CRP、ESR作为重要的炎症检测指标,相关研究表明三者与AS的疾病严重程度和抗TNF-α治疗后疗效呈相关性,可以作为AS疾病严重程度辅助检测指标[13-14]。本研究同样也发现,CRP、ESR、TNF-α在AS组较健康对照组高,TNF-α在疾病晚期组较疾病早期组高。正常人体内通过成骨细胞与破骨细胞的稳态,维持着骨组织的正常生长。一旦这种稳态被打破,就会有异常的骨侵蚀或异位骨化[15]。新骨形成过程包含软骨细胞被成骨细胞和破骨细胞取代、成纤维细胞向骨细胞转化。主要由成骨细胞分泌的ALP,通过促进磷酸钙在骨中沉积,影响骨组织生成[16]。本研究中,ALP在AS组较健康组高,在疾病晚期组较疾病早期组高,可能与AS的异位骨化相关,且在疾病晚期较疾病早期,异位骨化程度加重。
IL-18是一种多效性细胞因子,是IL-1家族成员,可由T细胞、NK细胞、树突状细胞、关节软骨细胞、成骨细胞、滑膜成纤维细胞等多种细胞分泌,可同时参与调节先天和后天的免疫应答[17]。AS作为遗传性疾病,HLA B27是已知的作为诊断AS的辅助检测指标[18]。相关研究表明,AS的患者的滑液和外周血中有HLA B27限制性CD8+T细胞的表达[19]。而IL-18在抗原呈递过程中对T细胞的活化具有多效性作用。IL-18最初确定为自然杀伤细胞和T细胞IFN-γ的有效诱导剂,与Th1反应有关。而IFN-γ会使髓样细胞的分化从破骨细胞向树突状细胞转移。IL-18通过诱导T细胞中粒细胞-巨噬细胞集落刺激因子的表达来促进树突状细胞的分化而发挥类似的作用。IL-18还可以以宿主微环境依赖性方式调节Th2和Th17细胞反应及CD8+细胞毒性细胞与中性粒细胞的活性[20]。本次研究结果显示,IL-18在AS组的表达水平比健康对照组高,在疾病晚期组中较疾病早期组高,且与炎性指标TNF-α呈正相关,提示IL-18可能通过影响TNF-α的水平参与AS的炎症过程。
IL-18R作为IL-18的受体,IL-18与其结合发挥生物效应,IL-18R主要在T细胞、NK细胞、中性粒细胞中产生。Yu W等[21]的研究表明,IL-18R在成骨和AS发病中起着关键作用。IL-18BP作为IL-18的天然抑制蛋白,通过与IL-18结合,降低IL-18R表达的效应细胞的功能。在生物体中,IL-18的生物活性取决于IL-18产生的强度、IL-18BP的水平以及IL-18R的细胞表面表达水平,三者保持相对的稳态,维持机体正常[22]。
本次研究中,AS组外周血CD8+T细胞、CD14+单核细胞及CD16+中性粒细胞中IL-18表达增强,提示AS患者外周血IL-18水平升高可能与CD8+T细胞、单核细胞及中性粒细胞IL-18表达增高有关。AS组IL-18R+CD8+T细胞比例及MFI明显升高,表明CD8+T细胞可能作为强直性脊柱炎异位骨化患者体内分泌的IL-18的主要效应细胞,发挥生物效应。提示CD8+T细胞、单核细胞、中性粒细胞分泌的IL-18参与AS炎症的进展。外周血IL-18BP+CD8+T细胞在AS组中表达水平降低,提示在AS患者外周血中IL-18的生物活性增强可能与IL-18BP表达减少有关。
综上所述,IL-18的过度表达与IL-18BP的表达降低,影响IL-18与IL-18BP的平衡,参与AS的炎症阶段,CD8+T细胞产生的IL-18、IL-18R、IL-18BP可能通过参与强直性脊柱炎的炎症进展促进AS的异位骨化。研究CD8+T细胞产生的IL-18及IL-18BP可能会为治疗TNFi疗效不佳的患者提供新的治疗方法。

