稳定表达线粒体钙离子荧光探针4mt-GCaMP6巨噬细胞系的构建
华盛平,王 瑶,郑润琪,李金亮,张维娜,夏 晴
(国家生物医学分析中心,北京 100850)
巨噬细胞作为一种在固有免疫应答和适应性免疫启动中发挥重要作用的免疫细胞,在保护机体免受感染方面发挥着关键作用。巨噬细胞免疫学功能主要包括吞噬(病原体、病毒感染细胞、细胞碎片和死细胞等)、抗原递呈和细胞因子分泌[1-2]。钙离子是细胞内重要的第二信使,在细胞周期、运动、自噬和凋亡等生物学事件中发挥重要调节作用[3]。细胞中钙离子主要存在于细胞浆、线粒体和内质网中,对线粒体发挥功能至关重要[4]。钙离子促进线粒体内ATP的产生,当线粒体内钙离子浓度过载时会导致细胞死亡[5]。近年来,钙离子信号在免疫细胞生物学功能中的作用受到关注,发现钙离子信号在T细胞分泌集落刺激因子以及肥大细胞脱颗粒过程中均发挥了重要作用[6-7]。相对于T细胞和肥大细胞,有关巨噬细胞钙离子信号的研究较少,特别是关于线粒体钙离子信号在巨噬细胞中的作用和调控机制尚未见报道。
4mt-GCaMP6线粒体钙离子荧光探针是在GCaMP6探针基础上加入线粒体靶向定位序列,通过绿色荧光强度可特征性地指示线粒体内钙离子浓度的变化[8]。本研究使用4mt-GCaMP6制备慢病毒并感染永生化小鼠骨髓来源的巨噬细胞(immortalized bone marrow-derived macrophages,iBMDM),构建稳定表达线粒体钙离子荧光探针的巨噬细胞系iBMDM-4mt-GCaMP6,为探究线粒体钙信号在巨噬细胞生物学功能中的作用及相关分子机制提供工具。
1 材料与方法
1.1 细胞和主要试剂
iBMDM巨噬细胞和293T细胞取自本实验室细胞库。4mt-GCaMP6线粒体钙离子荧光探针为本实验室前期构建[8],慢病毒包装质粒(psPAX2和pCMV-VSVG)取自本实验室质粒库。DMEM基础培养基、胰蛋白酶和青链霉素(中科迈晨科技有限公司),胎牛血清(美国Gibco公司),聚凝胺(上海汉恒生物有限公司),嘌呤霉素(北京吉普赛生物技术有限公司),离子霉素(上海陶素生化公司)。Ringer溶液为实验室自制(mmol·L-1:NaCl 155,KCl 4.5,CaCl22.0,MgCl21.0,HEPES 5.0,葡萄糖10.0,pH=7.4)。病毒浓缩柱(美国Millipore公司),Mito-Tracker™Red FM和Lab-Tek八腔室盖玻片(美国Thermo Fisher公司)。
1.2 4mt-GCaMP6慢病毒的制备
将293T细胞传代接种于10 cm培养皿中,待细胞密度为40%时,细胞换液加新鲜的DMEM培养基10 mL。配置磷酸钙转染体系:HBS溶液1 mL,4mt-GCaMP6质粒 6 mg,psPAX2质粒 4.5 mg,pCMV-VSVG质粒1.5 mg。用移液枪将转染体系混合均匀后静置5 min,缓慢逐滴加入CaCl267 mL,混合均匀后静置15 min,随后将转染体系逐滴加入培养基中。6 h后细胞换液加入培养基10 mL,48 h后补加培养基5 mL,72 h后收集含有病毒的培养上清到离心管中。常温离心机中200×g离心15 min,随后取上清用0.45 mm滤器过滤到病毒浓缩柱中。4℃,7000×g离心30 min,随后在病毒间操作台收取病毒浓缩液,分装病毒浓缩液至EP管中,-80℃冰箱长期保存。
1.3 线粒体钙离子荧光探针巨噬细胞系构建
每皿1×106巨噬细胞iBMDM接种于直径6 cm的培养皿中,在培养皿中加37℃预温的DMEM培养基4 mL。细胞贴壁后加入4mt-GCaMP6慢病毒浓缩液100 mL,同时加入聚凝胺8 mmol·L-1终浓度。病毒感染36 h后加入嘌呤霉素2 mg·L-1终浓度,抗性筛选培养7 d,获得稳定表达线粒体钙离子荧光探针的细胞系iBMDM-4mt-GCaMP6。
1.4 观测线粒体钙离子iBMDM-4mt-GCaMP6荧光探针表达和共定位
将离子霉素抗性筛选7 d后的iBMDM-4mt-GCaMP6细胞用胰蛋白酶消化后,按每孔3×104细胞均匀接种于Lab-Tek八腔室中。待细胞完全贴壁并状态良好时,用生理盐水洗3次,去除原DMEM培养基。每孔加入Ringer缓冲液300 mL,缓冲液中含有200 nmol·L-1线粒体指示探针Mito-Tracker™Red FM。细胞培养箱中孵育30 min后,将Lab-Tek八腔室置激光共聚焦荧光显微镜下观测,在波长488 nm的激发光下观察iBMDM-4mt-GCaMP6细胞的线粒体钙离子荧光探针发光强度和线粒体共定位。
1.5 离子霉素刺激下线粒体钙离子动态成像
将稳定表达线粒体钙离子荧光探针的iBMDM-4mt-GCaMP6细胞用胰蛋白酶消化后,按每孔3×104细胞均匀接种于Lab-Tek八腔室中。待细胞完全贴壁并状态良好时,用生理盐水洗3次去除原DMEM培养基,每孔加入预温的Ringer缓冲液150 mL,置共聚焦荧光显微镜成像系统下,以每帧3 s的间隔预先拍摄30 s。提前用预温的Ringer缓冲液稀释离子霉素至目标浓度,拍摄第30秒时向观测腔室快速滴加Ringer缓冲液150 μL,离子霉素终浓度 10 μmol·L-1,持续拍摄10 min。多孔拍摄结束后,使用Volocity软件对实验数据统计分析,每孔统计20个细胞(n=20)。
2 结果
2.1 慢病毒感染后线粒体钙离子荧光探针在巨噬细胞iBMDM成功表达的鉴定
将线粒体钙离子荧光探针4mt-GCaMP6慢病毒感染巨噬细胞iBMDM后,嘌呤霉素抗性筛选7 d,将具有嘌呤霉素抗性的细胞置于共聚焦荧光显微镜下观测。在绿色荧光通道下可见细胞有明显的绿色荧光,发出绿色荧光的部分为丝网状结构,发光细胞率为100%(图1)。共聚焦荧光显微镜观测结果显示,线粒体钙离子荧光探针4mt-GCaMP6在巨噬细胞iBMDM中成功表达,表明iBMDM-4mt-GCaMP6细胞系构建成功。
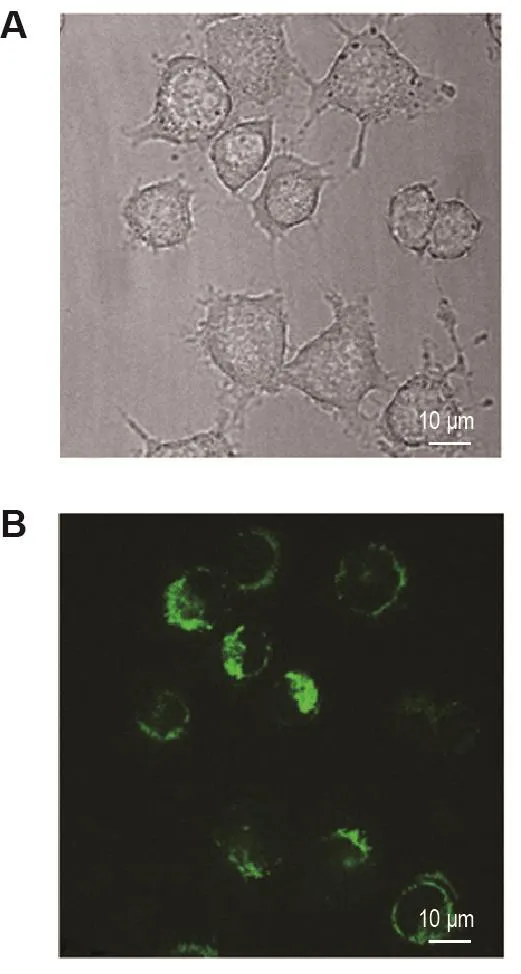
Fig.1 Expression of mitochondrial calcium probe 4mt-GCaMP6 in immortalized bone marrow-derived macrophages(iBMDM).A:cells were excited with bright field;B:cells were excited with 488 nm laser(green).
2.2 线粒体钙离子探针和线粒体指示探针共定位一致
为进一步验证iBMDM-4mt-GCaMP6细胞系能够正确指征线粒体定位,使用线粒体指示染料Mito-Tracker™Red FM与iBMDM-4mt-GCaMP6细胞共孵育30 min。随后用共聚焦荧光显微镜观测,在绿色荧光通道下细胞中丝网状结构发出绿色荧光(图2A),在红色荧光通道下Mito-Tracker™Red FM指征细胞线粒体为红色荧光区域(图2B),红绿荧光通道同时打开时观测到二者重合为黄色(图2C)。使用Volocity软件对红绿荧光通道进行共定位分析,共定位系数为91.2%。线粒体指示探针Mito-Tracker™Red FM共定位实验表明,构建的钙离子荧光探针细胞iBMDM-4mt-GCaMP6可有效指示细胞线粒体内钙离子。
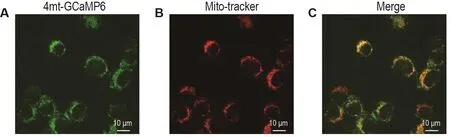
Fig.2 Co-localization of mitochondrial calcium fluorescent probe 4mt-GCaMP6 and mitochondrial indicator probe Mito-TrackerTMRed FM.A:mitochondrial calcium probe 4mt-GCaMP6 was excited with 488 nm laser(green);B:mitochondrial indicator probe Mito-Tracker™ Red FM was excited with 561 nm laser(red);C:cells were excited with 488 and 561 nm laser.
2.3 离子霉素刺激后钙离子荧光探针可指示巨噬细胞线粒体钙流变化
由图3所示,为验证所构建的iBMDM-4mt-GCaMP6细胞能否响应刺激,指示细胞线粒体内钙离子浓度变化,使用内质网钙离子释放剂离子霉素刺激细胞,在激光共聚焦荧光显微镜下动态观测线粒体钙离子浓度的变化。离子霉素是经典的内质网钙离子释放剂,可导致内质网钙离子短时间内释放到胞浆并进入到线粒体内,促使线粒体内钙离子浓度增加。激光共聚焦荧光显微镜观测结果显示,iBMDM-4mt-GCaMP6细胞加入离子霉素10 μmol·L-1刺激后,线粒体内钙离子浓度发生动态改变(图3A),细胞内绿色荧光钙离子信号在6~9 s内发生2倍的瞬时增强,在持续约45 s后逐渐回落到基础水平(图3B)。离子霉素响应实验表明,构建的线粒体钙离子荧光探针细胞iBMDM-4mt-GCaMP6可有效、准确地指示巨噬细胞线粒体钙离子浓度的变化。
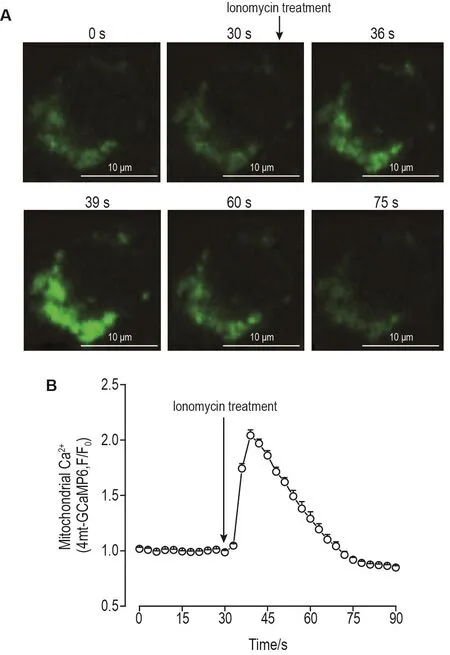
Fig.3 Transient increase of mitochondrial calcium fluorescence probe signal induced by ionomycin in macrophages.A:changes of mitochondrial calcium flow in cells before and after the addition of ionomycin;B:GCaMP6 fluorescence change which represents mitochondrial Ca2+alterations was calculated by F/F0,where F0 refers to the median value of the fluorescence signals during the baseline period(from 0 to 30 s).±s,n=20.
3 讨论
线粒体是细胞的能量工厂,通过三羧酸循环及氧化磷酸化为细胞合成ATP。钙离子能够直接激活电子传递链上的一系列蛋白质的活性,如ATP合成酶等。钙离子在线粒体内浓度的升高可促进线粒体ATP的产生,提供细胞增殖、运动和细胞因子分泌等各种生命活动所需要的能量[9]。
钙稳态在细胞生理和病理生理中起关键作用,胞内钙离子浓度持续升高可引发细胞死亡。线粒体钙稳态的动态平衡,对于线粒体能量代谢、形态维持和氧化状态的调节等具有重要意义[10]。近年来,钙离子信号在免疫细胞功能调控中的作用受到关注。Vaeth等[11]发现,储备型钙离子内流、钙调神经磷酸酶和活化T细胞的核因子,三者通过上调细胞糖酵解和氧化磷酸化来调控T细胞的活化和增殖。Vennekens 等[12]发现,瞬时受体电位通道 4(transient receptor potential melastain type 4,TRPM4)缺陷的肥大细胞脱颗粒能力增强并释放更多组胺、白三烯和肿瘤坏死因子,并且TRPM4缺陷小鼠有更严重的免疫球蛋白E介导的急性皮肤过敏反应[12]。
钙离子信号在巨噬细胞响应病原体刺激、吞噬及细胞因子分泌过程中的作用已有报道。Schappe等[13]发现,TRPM7介导的钙离子内流是脂多糖诱导巨噬细胞激活所必需的,TRPM7缺陷的巨噬细胞在内毒素激活时不能分泌白细胞介素1β和其他关键的促炎细胞因子。Zumerle等[14]发现,细胞间由ATP介导的钙离子信号可增强巨噬细胞的吞噬能力,但关于线粒体钙离子信号在巨噬细胞中作用的研究还鲜见报道,原因可能主要是因为缺乏能够明确指示线粒体钙离子浓度变化的手段。
基因编码的绿色荧光钙离子探针GCaMP6通过在质粒的N端添加不同的定位序列,能够将该探针靶向定位到质膜、线粒体以和内质网中,从而观察不同细胞器内钙离子的变化[15]。本研究中使用4mt-GCaMP6线粒体钙离子荧光探针,在GCaMP6质粒中添加了线粒体定位序列4mt,从而靶向细胞中线粒体内钙离子。Zhao等[8]使用线粒体钙离子探针4mt-GCaMP6观测细胞有丝分裂时线粒体钙离子动态变化,揭示了线粒体对急性细胞能量应激的代谢适应机制。Wang等[16]使用线粒体基质钙离子探针mt-GCaMP6s观测卵母细胞成熟和激活过程中线粒体钙离子动态变化,证明线粒体钙离子对卵母细胞激活的重要性。
综上所述,本研究使用可视化的定位线粒体钙离子的基因编辑探针4mt-GCaMP6,使用慢病毒感染方式构建了可视化观测线粒体钙离子浓度变化的巨噬细胞系iBMDM-4mt-GCaMP6。该工具细胞的成功构建,该工具细胞的成功构建,为后续研究巨噬细胞吞噬或杀伤病原体及发挥抗原递呈等生物学功能时线粒体钙离子浓度的变化,以及不同极化状态时的特征、作用和相关调控机制等提供了有利工具。

