小米多糖分离纯化及抗氧化活性研究
范三红 李 兰 张锦华 贾槐旺 白宝清
(山西大学生命科学学院1,太原 030006)(特色植物资源研究与利用山西重点实验室;山西大学2,太原 030006)
小米的营养比较丰富,含有蛋白质[1]、脂肪[2]、淀粉[3]、维生素和矿物质[4]等多种营养成分。同时,小米有健脾胃、促进消化、补血健脑和降血压等功效[5]。
多糖类化合物是由至少十个单糖组成的的高分子聚合物,并有降血糖[6]、抗氧化[7]、抗凝血[8]、抗肿瘤[9]和免疫调节[10]等重要的临床作用。目前,多糖较为常见的的提取方法有水提醇沉法[11]、酶法[12]、超声波辅助碱提法[13]、超声辅助酶法[14]等。前人对小米的研究集中在小米黄色素[15]、多酚[16]、脂肪[17]、蛋白质[18]等方面,而对小米多糖的相关报道较少。潘海龙等[19]在提取小米中多糖采用正交优化法的收率为7.76 mg/g。尹震花[20]对补骨脂多糖用DEAE-52纤维素色谱柱和Sephadex G-100柱色谱进行分离纯化,得到了2种多糖(PPs-1-1和PPs-2-1)。在提取多糖时加入适量纤维素酶,可以破坏细胞壁从而促进多糖物质溶出,提高提取量。晁红娟等[21]在毛竹提取多糖过程中,添加纤维素酶比不加酶条件下提取率和纯度分别提高了10%和8.5%。目前酶法提取小米多糖还未见报道,本实验以河峪黄小米为原料,采用超声辅助酶法探索小米多糖最优提取工艺条件,并进行分离纯化以及抗氧化活性研究,为小米多糖的开发及综合利用提供参考。
1 材料和方法
1.1 材料与试剂
河峪黄小米,山西省晋中市榆社县。
木瓜蛋白酶、苯酚、葡萄糖、氯仿、浓硫酸、正丁醇、DEAE纤维素DEAE-52、葡聚糖凝胶G-100、1,1-二苯基-2-三硝基苯肼 (DPPH)、羟甲基氨基甲烷(Tris)、硫酸亚铁、水杨酸、浓盐酸。
1.2 仪器与设备
AL204型电子分析天平,SB-5200DT超声波清洗仪,SP-2000UV型紫外可见分光光度计,SC-3614低速离心机 ,HL-2B恒流泵。
1.3 方法
1.3.1 小米多糖提取1.3.1.1 小米预处理
小米洗净并60 ℃烘干,粉碎后过60目筛,装袋冷藏备用。
1.3.1.2 小米多糖提取
小米粉→水提取→调节pH值→加酶,水浴→灭酶10 min→超声(220W)→离心→浓缩上清液→加3倍无水乙醇→4 ℃静置12 h→离心→沉淀→溶解定容→测定多糖浓度。
1.3.2 小米多糖的测定1.3.2.1 葡萄糖标准曲线
称取105 ℃、4 h烘至质量不变的葡萄糖10 mg置于100 mL 容量瓶定容。分别取0、0.2、0.4、0.6、0.8、1.0 mL放于小试管,加蒸馏水至2.0 mL,用移液管加5%苯酚溶液1 mL,迅速加浓硫酸5 mL,混匀,冷却至常温后在490 nm测定吸光值。制得标准曲线回归方程y=0.012 6x-0.010 1,R2=0.996 1。
1.3.2.2 多糖测定方法
粗多糖溶解定容至100 mL,摇匀后取2 mL,加5%苯酚溶液1 mL,5 mL浓硫酸,490 nm波长处测其吸光度值。小米多糖提取量计算见式(1)。
Y=(c×V×N)/m
(1)
式中:V为定容体积/mL;m为小米质量/g;c为溶液中多糖的质量浓度/mg·g-1;N是稀释倍数。
1.3.3 单因素实验
选料液比1∶10、1∶20、1∶30、1∶40、1∶50(g/mL),超声时间10、20、30、40、50 min,纤维素酶量0.5%、1.0%、1.5%、2.0%、2.5%和提取温度30、40、50、60、70 ℃这4个因素,以小米多糖提取量为评价指标。
1.3.4 Plackett-Burman实验
以单因素实验为基础,多糖提取量为评价指标,从多个单因素中选出影响多糖提取量的关键性因素[22]。

表1 Plackett-Burman实验因素及水平
1.3.5 响应面实验
根据Plackett-Burman实验结果,选取料液比(A)、超声时间(B)、纤维素酶量(C)为单因素,以小米多糖提取量为响应值,进行响应面优化实验。实验因素水平见表2。

表2 Box-Behnken 实验因素水平表
1.3.6 小米多糖脱蛋白1.3.6.1 蛋白含量的测定
采用考马斯亮蓝G-250法[23]测定蛋白质含量,得标准曲线为Y=6.702 9X+0.003 9,R2=0.998 9。
1.3.6.2 脱蛋白方法选择
Sevag法:将1/5的氯仿,正丁醇混合液(V氯仿∶V正丁醇=5∶1)加入多糖溶液中,震荡20 min,离心(3 000 r/min,10 min)得上清液,重复6次按式(2)、式(3)计算蛋白脱除率和多糖保留率。
木瓜蛋白酶法:多糖溶液中加入2%的木瓜蛋白酶溶液,50 ℃水浴30 min,灭酶后离心得上清液,计算蛋白脱除率和多糖保留率。
酶法-Sevag法:先用酶法进行脱蛋白处理,然后用Sevag法脱除蛋白,测蛋白脱除率和多糖保留率。
蛋白脱除率=
(2)

(3)
1.3.7 小米多糖脱色
H2O2法:用0.05 mol/L的NaOH溶液将多糖溶液调pH至8.5,加入多糖溶液1/5体积的30% H2O2溶液,50 ℃恒温脱色2 h,冷却至室温调pH为7.0,取上清液分别在450、490 nm测定其吸光度值,多糖脱色率和保留率计算见式(4)、式(5)。

(4)

(5)
活性炭:将活性炭多次清洗过滤并烘干,多糖溶液加入3%活性炭,60 ℃水浴2 h,取上清液在450、490 nm测定其吸光度值,并计算多糖脱色率和多糖保留率。
D315树脂法[24]:在一定量的多糖溶液中加入5.00 g树脂,调pH至6.0,振荡24 h,过滤,在450、490 nm测上清液吸光度值,计算脱色率和多糖保留率。
1.3.8 DEAE-52柱层析
首先对DEAE-52进行活化处理,用铁架台固定DEAE-纤维素层析柱(2.6 cm×30 cm)后进行装柱,过程中应不产生气泡,分层现象,平衡12 h后上样,多糖上样3 mL,用tris-HCl、0.1、0.2、0.3 mol/L NaCl溶液进行洗脱,流速2 mL/min,2 min收集一管,用苯酚-硫酸法测定每管多糖含量。
1.3.9 Sephadex G-100柱层析
将小米多糖组分MP-1配制成溶液,上样2 mL,用0.1 mol/L NaCl溶液进行洗脱,流速0.5 mL/min,6 min收集一管,用苯酚-硫酸法测定每管多糖含量。
1.3.10 体外抗氧化活性研究1.3.10.1 羟基自由基清除能力
参考文献[25]并稍加改进,取0.5、1.0、1.5、2.0、2.5 mg/mL的多糖溶液各1 mL加入6 mmol/L硫酸亚铁溶液1 mL,摇匀,10 min后加6 mmol/L水杨酸溶液1 mL,摇匀,30 min后于510 nm处测定吸光度Ai,蒸馏水代替水杨酸测得本底Aj,蒸馏水代替多糖溶液为空白A0,羟基自由基清除率计算见式(6)。
S=[1-(Ai-Aj)/A0]×100%
(6)
1.3.10.2 DPPH自由基清除能力
参考文献[26]并加以修改:取0.5、1.0、1.5、2.0、2.5 mg/mL的多糖溶液1 mL分别加入1 mL的0.2 mmol/L DPPH-无水乙醇溶液混匀,避光放置30 min,517 nm测吸光度Ai,用蒸馏水代替DPPH自由基得本底Aj,再用蒸馏水代替多糖溶液得空白A0,DPPH自由基清除率计算见式(6)。
1.3.10.3 超氧阴离子自由基清除能力
参考文献[27]并进行修改:取0.5、1.0、1.5、2.0、2.5 mg/mL的多糖溶液各1 mL,加入4.5 mL的pH=8.2的0.1 mmol/L tris-HCl溶液和2.4 mL蒸馏水混匀,常温放置10 min,加0.1 mL 6 mmol/L邻苯三酚,3 min后加1 mol/L HCl 0.1 mL终止反应,325 nm测定吸光度Ai,蒸馏水代替水杨酸溶液测本底Aj,蒸馏水代替多糖溶液为空白A0,超氧阴离子自由基清除率计算见式(6)。
1.3.11 数据统计与分析
本实验均进行3次重复,采用Design-Expert 8.0.6、Origin8.5和SPSS 21.0软件作图分析。
2 结果与分析
2.1 单因素实验结果分析
由图1可知,小米中多糖的提取量随料液比的逐渐增大呈现出先上升后下降趋势,可能是料液比太小时,多糖提取不够充分;料液比过大时,多糖提取量降低可能是过大料液比会降低提取液的固形物含量, 还会减少其吸收超声波能[28];超声时间超过20 min后,多糖提取量显著下降,原因可能是长时间超声,超声波的空化作用会破坏部分多糖的结构,并且长时间超声会加剧杂质的溶出,从而降低了提取量[29];酶用量超过1%后,多糖提取量开始出现下降趋势,可能是酶量添加到1%时多糖已完全溶出,过多的酶分子对多糖的提取无贡献,还会导致多糖降解,从而降低了多糖提取量;当温度60 ℃后继续升温,多糖提取量开始下降,可能由于高温破坏了多糖分子结构,从而提取量下降[30]。
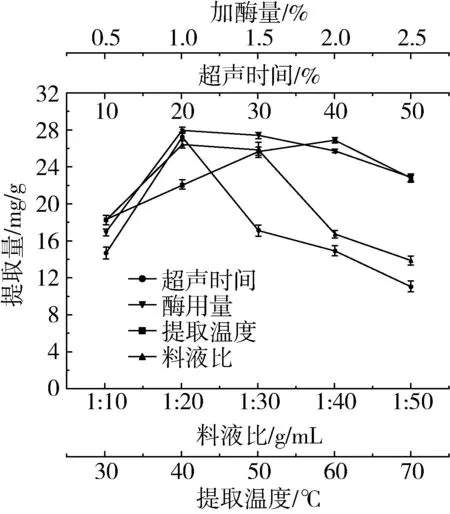
图1 单因素实验结果
2.2 Plackett-Burman实验
在单因素实验的基础上,以小米多糖提取量为评价指标进行Plackett-Burman实验设计,每个因素分别设计高 (1)、低 (-1) 2个水平,对料液比(A)、加酶量(B)、超声时间(C)、提取温度(D)进行显著性考察。由表4可见,影响实验的主次顺序为C>A>B>D,其中A、B、C影响极显著(P<0.01),所以选用这3个因素响应面实验。

表3 Plackett-Burman实验设计表及结果

表4 Plackett-Burman 实验统计分析
2.3 响应面实验
根据单因素实验和Plackett-Burman实验结果,选取料液比,超声时间,纤维素酶量3个因素,以小米多糖提取量为响应值进行响应面实验,用Design-Expert 8.0.6软件对表5数据进行多元回归拟合,得到小米粗多糖提取量对料液比,超声时间,纤维素酶量的二次多项回归模型为:小米多糖提取量=30.28+0.95A+1.24B+0.44C+1.22AB+1.08AC+0.46BC-2.94A2-8.85B2-3.03C2。
2.3.1 小米多糖提取响应分析方案及结果

表5 小米多糖提取响应分析方案及结果

表6 小米多糖提取量回归模型的方差分析

2.3.2 响应面各因素交互作用分析
响应面的弯曲程度与该因素对多糖提取量影响成正相关,等高线图中,椭圆形表明两因素交互作用显著,圆形说明交互作用不显著[31]。在实验因素水平范围内,存在小米多糖的最大提取量。响应面结果表明超声时间10~30 min、料液比1∶10~1∶25范围内,小米多糖提取量先增大后减小。超声时间20 min、料液比1∶20 g/mL附近值对小米多糖提取量有重要影响;料液比1∶10~1∶25、酶用量0.5%~1.5%多糖提取量先增大后减小;超声时间10~30 min、酶用量0.5%~1.5%时,多糖提取量先增大后减小,超声时间20 min、酶用量1.0%附近值多糖提取量最大。
2.3.3 最优工艺确定与回归模型的验证实验
以多糖提取量为响应值,通过回归模型分析,得出超声辅助酶法提取小米多糖的最佳工艺条件:料液比1∶22.00、超声时间20.87 min、酶用量1.04%、多糖提取量为30.451 mg/g。为了实验中方便操作,将本工艺条件修正为料液比1∶22、超声时间21 min、酶用量1%、此条件下多糖提取量为30.34 mg/g,与理论值相差0.111 mg/g,说明该修正工艺与实际结果拟合性较好,所建模型正确,利用响应面优化的小米多糖提取工艺条件真实可靠,有实用价值。
2.4 小米多糖脱蛋白
采用3种方法对多糖进行脱蛋白,结果见图2。当仅用木瓜蛋白酶法对多糖进行脱蛋白处理时蛋白脱除率65%,多糖保留率77%;只用Sevag法对小米多糖进行脱蛋白时蛋白脱除率73%,多糖保留率75%;当用酶法-Sevag法结合时蛋白脱除率可达78.23%,多糖保留率89.42%。选用酶法-Sevag法除多糖中的蛋白可在保证多糖保留率的情况下最大限度的脱除蛋白质[32]。
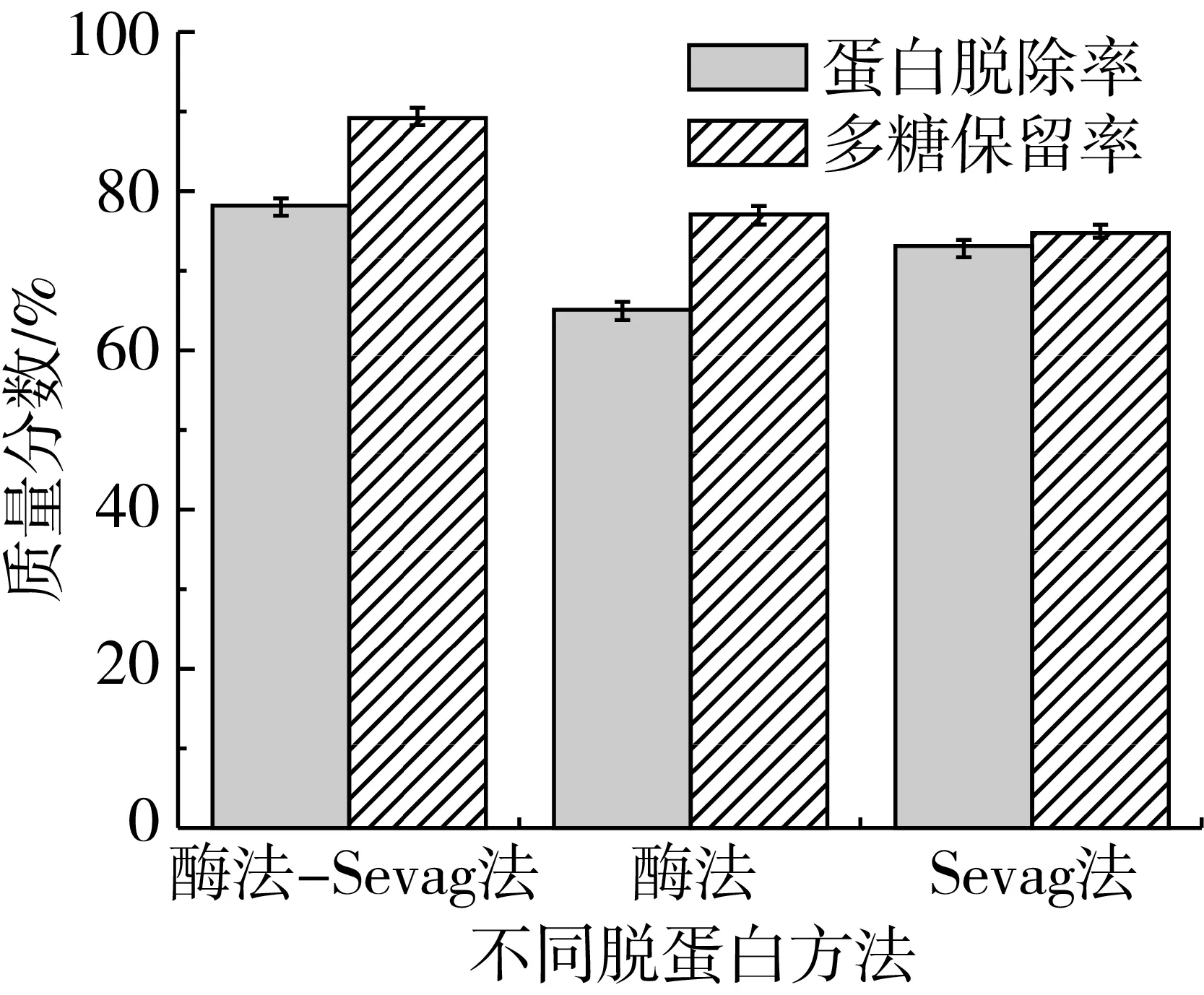
图2 脱蛋白方法对多糖提取量的影响
2.5 小米多糖脱色
如图3所示,3种不同脱色方法对小米多糖的脱色率都在60%以上,其中,当选用H2O2法对多糖进行脱色时脱色率仅为62%,并且H2O2氧化性较强,会破坏多糖糖苷键,导致多糖保留率降低[33]。活性炭法时效果不太好可能是因为活性炭对色素特异性吸附[34]。采用D315树脂法脱色效果最佳,脱色率和多糖保留率分别是88%、80.20%,故选用D315树脂法脱色处理小米多糖。

图3 脱色方法对多糖提取量的影响
2.6 DEAE-52柱层析
采用DEAE-52纤维素柱对脱蛋白脱色处理后小米多糖进行进一步的分离纯化,如图8。小米多糖经DEAE-52柱层析纯化得到两个组份MP-1、MP-2。因MP-2含量较少,所以将MP-1进行富集,透析,进一步纯化。
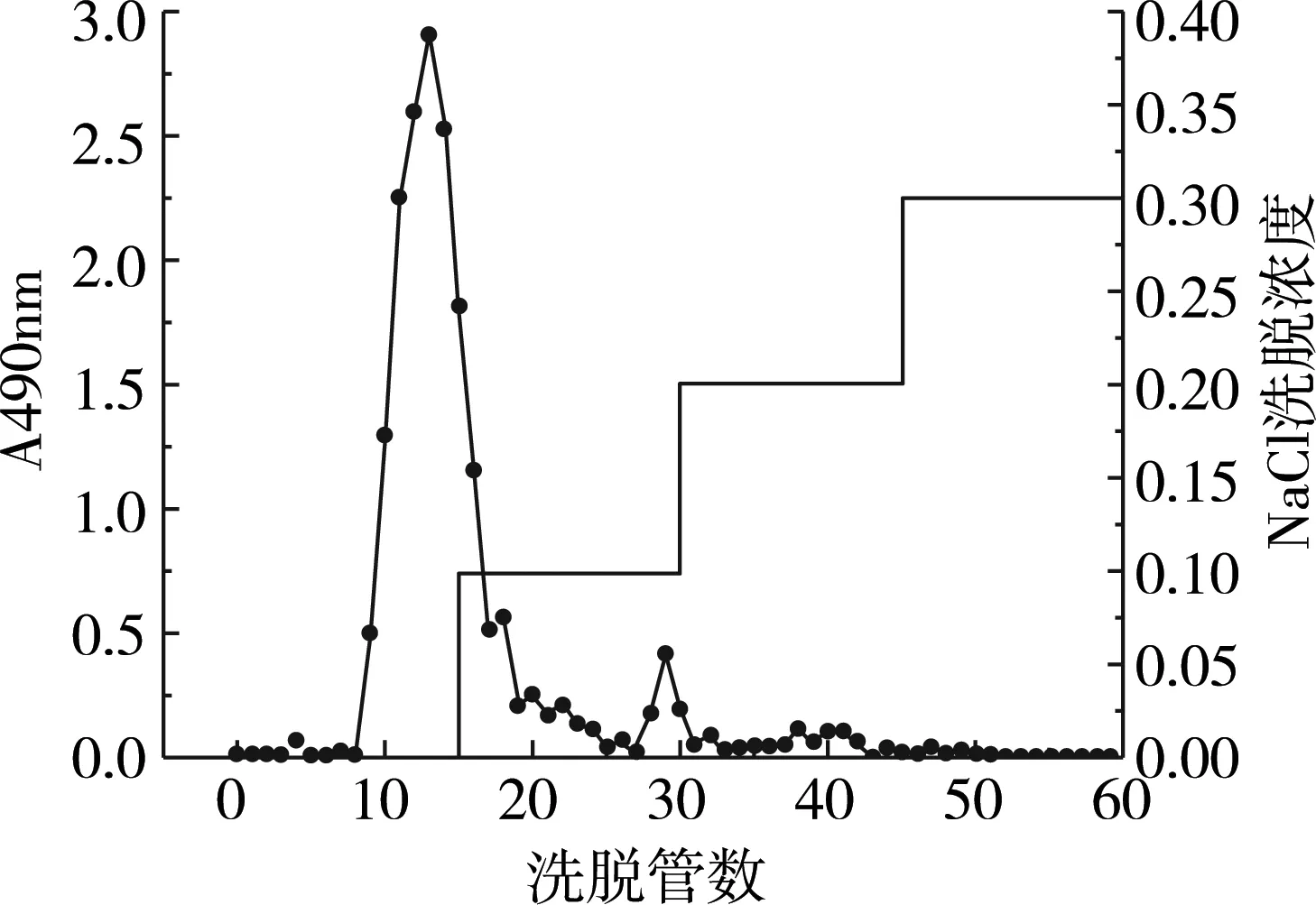
图4 小米多糖DEAE-52色谱柱洗脱曲线
2.7 Sephadex G-100凝胶柱层析
小米多糖MP-1经Sephadex G-100凝胶柱层析洗脱,得到单一对称的曲线图,证明此时得到的小米多糖是较纯多糖,对该组份进行富集,干燥可得小米多糖MP-1组分纯品。

图5 小米多糖Sephadex G-100色谱柱洗脱曲线
2.8 体外抗氧化活性
图6为VC和小米多糖MP-1抗氧化能力结果图。在0.5~2.5 mg/mL时,MP-1和VC对羟自由基清除能力呈上升趋势,在0.5~2 mg/mL时,MP-1对羟自由基清除率逐渐上升,在2.5mg/mL时基本平稳,清除率是70.69%;在0.5~2mg/mL时,VC和小米多糖MP-1对DPPH自由基清除能力都随着浓度的增加而增强,当质量浓度为2.5 mg/mL时,VC和MP-1对DPPH自由基清除率分别为99.31%、75.33%:超氧阴离子自由基是一种本身对身体无害的弱氧化剂,但是它与羟基分子结合可能会破坏DNA和其他生物分子[35],0.5~2 mg/mL的MP-1对超氧阴离子自由基的清除率为25.56%~65.32%。经SPSS 21.0分析可得,MP-1对DPPH自由基、羟自由基、超氧阴离子清除率最高分别为75.33%、70.69%、68.62%,对DPPH自由基、羟自由基、超氧阴离子半抑制质量浓度分别为1.105、0.200、1.371 mg/mL,表明小米中多糖具有较好的抗氧化能力。

图6 MP-1和VC的抗氧化能力
3 结论
小米中多糖提取优化工艺条件,并对其进行分离纯化和抗氧化活性研究。最终确定小米多糖最佳提取工艺参数为:液料比为1∶22,超声时间21 min,纤维素酶添加量1%,超声温度60 ℃,小米多糖提取量为30.34 mg/g。经木瓜蛋白酶法-Sevag法脱蛋白,D315树脂法脱色, DEAE-52纤维素色谱柱和Sephadex G-100柱色谱纯化得到多糖组分MP-1,并对MP-1进行体外抗氧化性活性研究。抗氧化研究表明,MP-1对DPPH自由基、羟自由基、超氧阴离子清除率最高分别为75.33%、70.69%、68.62%,对DPPH自由基、羟自由基、超氧阴离子半抑制质量浓度分别为1.105、0.200、1.371 mg/mL,表明小米多糖具有较好的抗氧化能力。

