夹脊电针对兔退变腰椎间盘神经纤维内向生长的影响*
王 科,黄国付,李 李,王力霞△
(1.湖北中医药大学,湖北 武汉 430065; 2.武汉市武昌医院,湖北 武汉 430063)
椎间盘退变广泛存在于各年龄段人群中,以其为病理基础的腰椎间盘退行性疾病如盘源性腰痛、腰椎间盘突出症等因临床发病率高且易复发,严重影响患者生活质量甚至导致劳动能力丧失,所以对其防治研究一直是国际相关领域的重点。腰椎间盘退变性疾病属于我国中医学之“腰痛”“痹证”范围,电针在治疗腰椎间盘突出症(LDH)等以椎间盘退变为病理基础的疾病疗效确切,得到了广泛认可[1-2]。
健康的椎间盘神经纤维分布于纤维环的外1/3,有研究发现退变椎间盘中存在神经纤维内向生长的现象,椎间盘退变释放大量炎性介质或力学失衡刺激了内向生长的新生神经纤维[3-4],成为椎间盘源性疼痛的病理基础。神经丝蛋白(NF)是构成神经元胞体和神经轴突细胞骨架的主要成分,脊髓损伤后,其在相关修复过程中扮演了重要角色[5]。P物质(SP)是一种神经递质,广泛存在于初级神经元和神经纤维中,感受器兴奋而分泌。Netrin-1是一种具有双向调节功能的神经导向因子。本研究从以上角度研究电针对退变腰椎间盘神经纤维内向生长的影响,探析电针预防和治疗椎间盘退变性疾病可能的作用机理。
1 材料与方法
1.1 实验动物
选用健康成年雄性新西兰大白兔20只,月龄5~6月,体质量3.5~4 kg,由武汉万千佳兴生物科技有限公司提供(合格证编号:No.42010000002901),在标准条件下饲养4周后开始实验,实验过程通过了武汉市第一医院动物伦理委员会的审批。
1.2 主要仪器与试剂
1.2.1 仪器 GE Signa HDx 3.0T磁共振仪(美国通用电气);韩氏穴位神经刺激仪(HANS);脱水机、冻台(武汉俊杰电子有限公司);摊片机、包埋机(浙江省金华市科迪仪器设备有限公司);切片机(上海徕卡仪器有限公司);烘箱(上海福玛实验设备有限公司);微波炉(格兰仕微波炉电器有限公司);脱色摇床(北京六一仪器厂);普通光学显微镜(重庆光电仪器有限公司)。
1.2.2 试剂 10×EDTA修复液(谷歌生物);H2O2(国药集团化学试剂有限公司);BSA(Roche,北京索莱宝科技有限公司分装);抗兔/鼠通用型免疫组化试剂盒REALTMEnVision+/HRP RABBIT/MOUSE(Dako Denmark A/S);Anti -Neurofilament heavy polypeptide Mouse mAb、Anti-Substance P Rabbit(Servicebio)。
1.3 造模方法
采用Kroeber等[6]及黄国付等[7]的造模方法,用10%水合氯醛(1 mL/kg)沿耳缘静脉缓慢推注麻醉后,以俯卧位固定,实验兔背部备皮,找到L4~5并在其同侧碘伏消毒后做直切口,钝性分离椎旁筋肉,显露椎体后分别在其钻入一直径1.5 mm的克氏针,并在每根克氏针两头装配一垂直连接杆,两个连接杆之间安置一弹簧装置,并施加200 N的压力持续28 d,如图1,术后予以青霉素4×106U肌注,1次/d,连续治疗5 d,达到造模周期后进行磁共振成像检测,确认造模是否成功。

图1 模型的建立和电针治疗
1.4 分组及处理
所有动物分为正常组(Control)、模型组(Model)、假模型组(Sham)、模型+电针组(Model+EA)和模型+假电针组(Model+Acu)5组,每组4只。正常组:自然饲养28 d,不作任何治疗;模型组:轴向压力诱导椎间盘退变28 d;假模型组:处理同模型组但不进行椎体间加压;模型+电针组:轴向压力诱导椎间盘退变28 d,造模成功后第1天开始针刺治疗,每疗程治疗时间为6 d,疗程间期为1 d,共治疗4疗程;模型+假电针组:处理及治疗同电针组,但针刺夹脊穴不通电。
治疗方法:参照“实验针灸学”[8]实验动物穴位定位标准,取兔L4~5夹脊穴,消毒后开始针刺治疗(0.30 mm×25 mm,苏州产无菌针灸针),针刺深度5~8 mm,进针后快速捻转至针下有沉涩感后,在针柄上连接韩式穴位神经刺激仪,刺激频率为2/15 Hz,刺激强度为1~2 mA,20 min/次,1次/d,如图1。
1.5 观察指标及方法
正常组、模型组和假模型组处理后28 d拆除加压装置,并拔出克氏针,行磁共振检测后处死动物取出L4~5椎间盘(包括纤维环和髓核);模型+电针组、模型+假电针组治疗疗程结束后处理方法同上。所有组织编号并根据固定-脱水-透明化-浸蜡包埋-修块-切片-摊片顺序制备包埋切片。通过HE染色方法观察电针对退变椎间盘的组织学改变:切片置于二甲苯溶液中脱蜡,然后置于梯度递减浓度酒精中(100%~75%)脱二甲苯,蒸馏水洗去酒精,苏木素染色,酒精分化,氨水返蓝,再将伊红染液置入染色,再置入梯度递增浓度酒精中(95%~100%)脱水,二甲苯处理15 min后中性树胶封片拍照。
运用免疫组化的方法观察电针对退变椎间盘的保护作用。分别进行NF200、SP和Netrin1组化染色并评分,观察神经纤维在椎间盘的内向生长。每组切片置于65 ℃烘箱2 h,脱蜡后用PBS冲洗,EDTA微波修复,PBS冲洗,再放入3%H2O2孵育10 min,PBS冲洗后充分甩出液体再用5%BSA封闭。除去BSA后每张标本切片置入50 μL一抗:Anti -Netrin1(Abcam,货号:ab122903);Anti -Substance P Rabbit(Servicebio;货号:GB11412); Anti -Neurofilament heavy polypeptide Mouse mAb (Servicebio;货号:GB13141)。4 ℃过夜,PBS冲洗并去除后加入同样剂量相应种属的二抗,重复处理后加入同样计量相同种属的Netrin-1抗体,4 ℃孵育50 min。PBS冲洗后DAB溶液处理。显色完全后冲洗复染,分化反蓝。切片通过浓度递增酒精(70%~100%)充分脱水后透明化,中性树胶封固。将切片放在普通显微镜下,观察、采集图片,每张切片选择3个高倍镜视野,应用Image J图像分析系统计数阳性细胞后再进行统计学分析。
1.6 统计学处理
2 结果
2.1 磁共振成像结果
术后28 d到达造模周期后行GE Signa HDx 3.0T磁共振仪成像检测,摄取T2加权矢状位图像,结果显示见图2。正常椎间盘显示为匀称明亮的高信号,加压28 d后L4~5椎间盘显现颜色深暗的低信号,与相邻上下椎间盘及正常椎间盘有明显差异,证明椎间盘退变动物模型建立成功。

图2 造模前后磁共振检测椎间盘组织信号变化
2.2 组织学研究
HE染色发现:正常组椎间盘髓核区呈椭圆形,纤维环排列整齐致密有序,与髓核之间界限清楚,髓核为高度凝胶状物质。退变椎间盘髓核皱缩,纤维环排列松散,出现较小的裂缝。经过针刺28 d治疗后,纤维环重新排列,细胞外基质含量增加,退变椎间盘组织有再生迹象,如图3,通过电针的干预可使纤维环营养重新分布,对椎间盘退变有一定的保护作用。

图3 各组标本HE染色(200×)
2.3 免疫组化
2.3.1 NF200表达 如图4和表1,正常组及假模型组椎间盘中NF200有少量表达,模型组较正常组及假模型组NF200明显升高,差异有统计学意义(P<0.05),
模型组与假电针组NF200表达差异无统计学意义(P>0.05),电针治疗后NF200表达明显下降,差异有统计学意义(P<0.05)。
2.3.2 SP表达 如图5和表1,正常组及假模型组椎间盘标本中P物质(SP)基本不表达,模型组中SP阳性染色可见于纤维环和髓核之中,较正常组与假模型组比较,差异有统计学意义(P<0.05),模型组与假电针组SP表达差异无统计学意义(P>0.05),电针28 d治疗后椎间盘SP表达相对减少,差异有统计学意义(P<0.05)。
2.3.3 Netrin-1表达 定位于细胞膜、细胞浆和细胞外基质中,在椎间盘髓核和纤维环中均有分布。如图6、表1,正常组及假模型组椎间盘组织中有少量Netrin-1表达,随着椎间盘逐渐的退变和衰老,Netrin-1表达明显上调,差异有统计学意义(P<0.05),可见阳性染色细胞增多,模型组与假电针组差异无统计学意义(P>0.05)。电针治疗可下调椎间盘中Netrin-1的表达,与电针组相比,假电针组中观察到组织中Netrin-1表达显著上调,差异有统计学意义(P<0.05)。
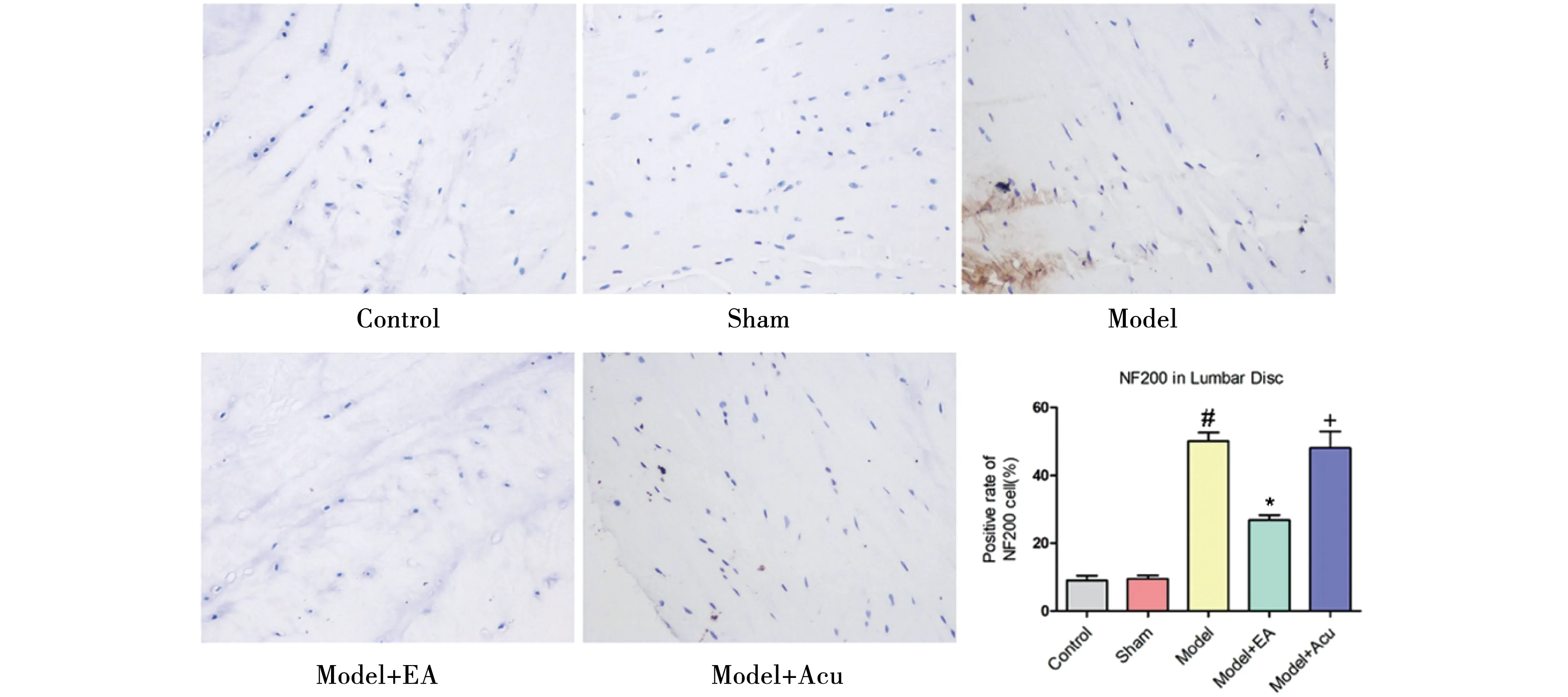
注:与正常组及假模型组比较,#P<0.05;与模型组比较,*P<0.05;与模型+电针组相比较,+P<0.05。图4 各组标本NF200免疫组化(200×)
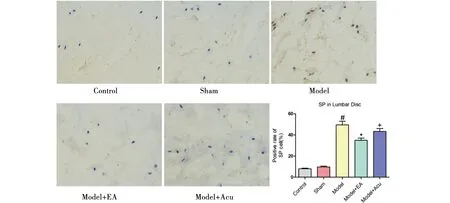
注:与正常组及假模型组比较,#P<0.05;与模型组比较,*P<0.05;与模型+电针组比较,+P<0.05。图5 各组标本SP免疫组化(400×)
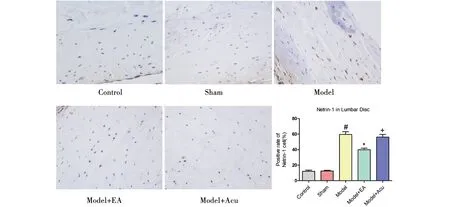
注:与正常组及假模型组比较,#P<0.05;与模型组比较,*P<0.05;与模型+电针组比较,+P<0.05。图6 各组标本Netrin-1免疫组化(200×)

表1 各组标本NF200、SP及Netrin-1阳性细胞数
3 讨论
在椎间盘退变过程中,最显著的特点是神经纤维沿着纤维环破裂的缝隙向椎间盘内部生长,这些内向生长的神经纤维受到椎间盘退变所释放大量炎性介质的化学刺激或由椎间盘不稳造成的机械刺激成为盘源性疼痛发生的重要病理基础。椎间盘结构的完整性决定了其特有的生理功能。软骨终板、髓核以及纤维环共同组成了应力缓冲系统,异常应力首先累及软骨终板,软骨终板路径营养供给减少是椎间盘退变的始发元素[9-10],随之出现椎间盘内含水量降低,细胞合成蛋白多糖能力下降,细胞外基质(ECM)分解,椎间盘弹性下降[11],纤维环分担更多的异常应力,长时间重复超负荷作用下纤维环将出现显著的板层分离[12],本研究也证实了这一点,破损的纤维环失去了正常的生理功能,对髓核的约束力减弱,髓核更容易从破损处突出。Peng B等[13]发现盘源性腰痛患者椎间盘中新生神经纤维沿着椎间盘破裂间隙中的肉芽组织长入纤维环和髓核,这可能是导致临床症状的主要原因。
腰椎间盘内的神经纤维主要为感觉神经纤维和交感神经纤维[14-18]。NF按分子质量可分为NF68、NF140和NF200 3种,NF200正常情况下只存在于轴索中,胞体中含量极少,故染色呈阴性。椎间盘破裂后产生大量炎性介质以及创伤刺激促使其内神经元大量积累NF200以完成神经的修复与生长。既往对NF200研究[19-21]在脊髓损伤的恢复中的作用较多。实验中健康组及假模型组NF200表达基本相同,模型组NF200表达显著升高,认为NF200参与退变腰椎间盘神经纤维内向生长。
SP自身可以诱发炎症反应,其可能机制是通过增加椎间盘中白介素-6(IL-6)的表达激活炎症反应[22]。SP还可以间接激活作用于局部伤害感受器表面的辣椒素受体(VR1),形成疼痛信号向中枢传递,使人体感知疼痛,同时局部高浓度聚集的氢离子还可以直接激活感觉神经元,通过持续产生激发电流,从而加强疼痛信号的传导;作为神经递质,其自身也参与疼痛信号的传递,增强大脑对疼痛的感受[23]。亦有研究[24]证明,电针可降低SP并提高5-HT而缓解偏头痛。退变的椎间盘髓核或撕裂的纤维环,炎症反应刺激椎间盘内细胞合成释放相关神经生长因子(NGF和BDNF)[25],通过诱导向内生长的神经纤维表达SP等神经肽,产生伤害性感受信息,引起盘源性腰痛[18,26]。
Netrin-1双向调节功能是通过依靠不同的受体来实现[26]。一个是二环己基碳二亚胺,介导Netrin-1吸引轴突的作用,促进神经纤维长芽和延伸[27],另一个则是UNC5B,介导其发挥排斥轴突的作用,抑制神经纤维长芽和延伸[28]。笔者推测Netrin-1的两个受体在椎间盘和DRG中的分布是不同的,经文献检索后发现[29-30]:UNC5B受体在成年动物脊髓和DRG感觉神经元中的表达量远远高于DCC受体,而在椎间盘,DCC受体的含量明显要高一些。因此,在退变的椎间盘中,Netrin-1与DCC相结合,诱导神经定向生长,是导致盘源性腰痛及下腰痛的主要原因,电针能下调退变椎间盘Netrin-1中的表达,抑制神经内向生长。在正常椎间盘中,也发现了少量的Netrin-1,其机制有可能参与椎间盘细胞本身活性的维持及诱导椎间盘内部细胞的迁移,或是Netrin-1的低表达随时为神经血管的内生长做着准备,一旦发生椎间盘严重退变,伴随纤维环破裂以及神经血管的浸入反应,Netrin-1在这种条件下出现高表达,NF200在其引导下完成内向生长,在退变椎间盘中,Netrin-1免疫阳性盘细胞百分比与神经血管评分呈显著正相关[31]。
本研究应用轴向压力诱导方法成功制备腰椎间盘退变模型,发现退变的椎间盘髓核皱缩,纤维环排列松散,出现较小的裂缝;并且NF200、SP和Netrin-1阳性细胞数较正常椎间盘明显增加,提示可能在Netrin-1引导下NF200参与退变椎间盘神经纤维的内向生长,SP释放增多是引起盘源性腰痛的可能原因。电针治疗后,纤维环出现重新排列,细胞外基质增加,椎间盘组织有再生迹象;NF200、SP和Netrin-1阳性细胞数较模型组明显减少,说明电针治疗可能通过减少NF200、Netrin-1而抑制退变椎间盘神经纤维内向生长,并且通过降低SP释放缓解因退变导致的疼痛。笔者前期研究发现电针可以从降低椎间盘组织中MMP-13和增强TIMP-1的表达以及actin、tubulin的表达等方面防治椎间盘退变[32-33]。丛心宇等[34]制备了椎间盘退变大鼠模型,并使用电针干预,发现电针可以降低退变椎间盘组织中ADAMTS-4的表达进而治疗椎间盘退变。夹脊电针可降低以椎间盘退变为病理基础的LDH患者Oswestry功能障碍指数并缓解其临床症状,改善椎间盘退变Pfirrmann’s MRI分级指数[35]。本研究阐明了电针夹脊穴治疗腰椎间盘退变的可能机制,为临床治疗相关疾病提供理论依据,但其具体依靠哪一通路以及电针对退变椎间盘内交感神经内向生长有无影响尚未明确。

