针刀对类风湿性关节炎模型大鼠的治疗作用及对滑膜细胞凋亡的影响*
李萌萌,万碧江
(湖北中医药大学,湖北 武汉 430061)
类风湿关节炎(Rheumatoid arthritis,RA)是一种病因不明的、慢性全身性自身免疫性疾病,表现为对称性、破坏性的小关节病变及慢性炎症。其基本病理改变为慢性滑膜炎症及滑膜组织增生[1]。现临床多采用抗炎及抗风湿药物治疗,虽然在抑制炎症发展、减轻关节疼痛和延缓疾病进展等方面取得了良好的治疗效果,但仍有部分患者表现出进行性关节损伤或对药物产生不良反应[2],仍然需要寻找新的治疗选择。针刀疗法创始人朱汉章教授在《针刀医学原理》中提出,针刀治疗对RA有良好的疗效,可快速缓解因关节内炎性渗出引起的关节肿胀、疼痛并恢复关节功能[3]。临床研究证实针刀治疗RA疗效确切[4-6],RA是针刀疗法的优势病种之一[7]。但目前针对针刀治疗RA的内在机制研究尚未见报道。故本实验采用牛Ⅱ型胶原乳化剂诱导关节炎(CIA)的方法建立RA大鼠模型,观察其自然病程及针刀干预对CIA大鼠的影响,探讨针刀治疗RA的可能机制,以利于针刀疗法的推广应用。
1 材料和方法
1.1 实验动物
SPF级SD雌性大鼠30只,体质量180~200 g,由湖北省实验动物中心提供,动物许可证号:SCXK(鄂)2017-0012。饲养于湖北中医药大学SPF级实验室,自然光线,自由进食饮水,大鼠适应性喂养1周后开始实验。
1.2 药物与试剂
胶原蛋白II型(牛)(美国SIGMA,货号:CJ7806);弗氏不完全佐剂(美国SIGMA,货号:100242-200402);TRIzol®Reagent(美国Ambion,货号:15596-026);超纯RNA提取试剂盒(北京康为世纪生物科技有限公司,货号:CW0581S);PowerUpTMSYBR®Green Master Mix(美国Thermo Scientific,货号:A25742);DEPC水(Biosharp,货号:BL510A)。
1.3 主要仪器
一次性汉章系列无菌针刀(0.4 mm×30 mm,北京健力园医疗器械有限公司);5700型荧光定量PCR仪(美国伯乐公司);JEM-1400透射电子显微镜(日本电子 JEOL);艾科浦超纯水制成机(美国艾科浦国际有限公司);ZQP-86振动切片机(上海之信仪器);CP100WX超速离心机(日立);Nilcoh990数码相机(康尼公司)。
1.4 分组与造模方法
适应性饲养动物1周后,将30只大鼠采用随机数字表法随机分为空白组、模型组和针刀组,按文献记载建造CIA大鼠模型[8]。制备Ⅱ型乳剂:将10 mgⅡ型胶原蛋白溶解于5 mL 0.1 mol/L乙酸溶液中,4 ℃过夜,次日将胶原溶液和弗氏不完全佐剂按1∶1比例混匀,制成Ⅱ型胶原乳剂,浓度为1 mg/mL,4 ℃保存。造模:用体积分数为1%的戊巴比妥钠麻醉大鼠后,在模型组、针刀组大鼠左后足跖皮内注射Ⅱ型胶原乳剂0.1 mL进行初次免疫,空白组于相同部位皮内注射等量生理盐水。初次免疫7 d后行强化免疫,药物注射部位、用量和方法同前;初次免疫14 d后评价造模结果。
1.5 干预方法
1.5.1 空白组 正常饲养,不做干预处理。
1.5.2 模型组 造模成功后正常饲养,不做干预处理。
1.5.3 针刀组 造模成功后,针刀组大鼠使用自制鼠衣固定,在左侧大鼠患膝行触诊,于关节周围找到条索状物并用龙胆紫定点,每次选3点,常规备皮,消毒,按四步进针规程操作进针,然后行纵向疏通及横向剥离2~3刀治疗,最后避开神经及血管,用针刀将关节囊切开数点,放出少许关节液,出针后以消毒棉签按压针孔1 min,敷以创可贴固定,再辅以手法治疗放松膝关节周围软组织。针刀组大鼠于初次免疫后第15天开始接受针刀干预治疗,每周治疗1次,共治疗3次。
1.6 观察指标
1.6.1 各组大鼠足跖厚度及AI评分 初次免疫后定期用千分游标卡尺测量大鼠左下肢足跖厚度,观察大鼠足跖肿胀程度在免疫过程中及针刀治疗前后的变化,并拍照记录。初次免疫后定期根据AI评分判断标准[9-10]对各组大鼠行关节炎指数评分,大鼠前后四肢足趾的红肿程度分别按0~4分计算。根据四肢累计积分算出AI值,最高分为16分。AI值越高,则代表病情越严重。评分≥4分提示造模成功。具体评分标准见表1。

表1 关节炎指数评分标准
1.6.2 HE染色法检测膝关节病理变化情况 针刀组治疗结束后,随机选取空白组、模型组和针刀组大鼠各5只,取致炎侧(左侧)膝关节除去多余的皮毛及软组织,用PBS缓冲液洗去血液和残渣,置入4%多聚甲醛中固定1周后,将组织转移至20~30倍体积的EDTA脱钙液中6~8周,如大头针能轻松刺入关节则脱钙满意,然后纵置关节,常规脱水、透明后进行石蜡包埋,振动切片机5 μm厚连续切片,常规HE染色,显微镜下观察膝关节软骨及滑膜组织病理形态变化。
1.6.3 Caspase-3、Caspase-9 mRNA检测 采用实时荧光定量PCR法(real-time quantitative PCR,q-RT-PCR法)法检测膝关节滑膜组织中Caspase-3、Caspase-9 mRNA的表达。取余空白组、模型组和针刀组大鼠左膝关节滑膜组织100 mg,在研钵中加液氮充分研磨,用Trizol法提取滑膜组织总RNA,按cDNA合成试剂盒说明书操作,将RNA反转录为cDNA,运用SYBR Green I染料法,在荧光定量PCR仪上,以β-actin基因作为内参对照,进行各目的基因的定量检测,PCR引物序列见表2,由昆泰锐(武汉公司)合成,反应总体系为20 μL,反应扩增条件:50 ℃ 2 min、95 ℃ 2 min、95 ℃ 15 s、60 ℃ 15 s和72 ℃ 1 min,共40个循环。反应结束获得Caspase-3、Caspase-9的循环阈值(Cycle threshold,Ct),采用2-ΔΔCt公式计算目的基因的相对表达量。

表2 RT-PCR引物序列
1.7 统计学处理

2 结果
2.1 针刀干预对CIA大鼠足趾厚度及AI的影响
如图1~2、表3~4,根据观察及测量结果,空白组大鼠无关节肿胀、皮损及关节活动障碍等表现;模型组大鼠初次免疫后3~6 d出现造模侧足跖皮肤溃破,后出现足趾、足踝和膝关节红肿,于8~10 d红肿加重,并逐渐向对侧及双前肢蔓延,初次免疫后21 d左右红肿达到顶峰,皮肤充血发亮,并持续存在;针刀组大鼠于第1次针刀干预后即初次免疫后21 d开始,大鼠足趾厚度及AI值较模型组明显降低,差异具有统计学意义(P<0.01),提示针刀干预可明显改善CIA大鼠足趾肿胀程度。
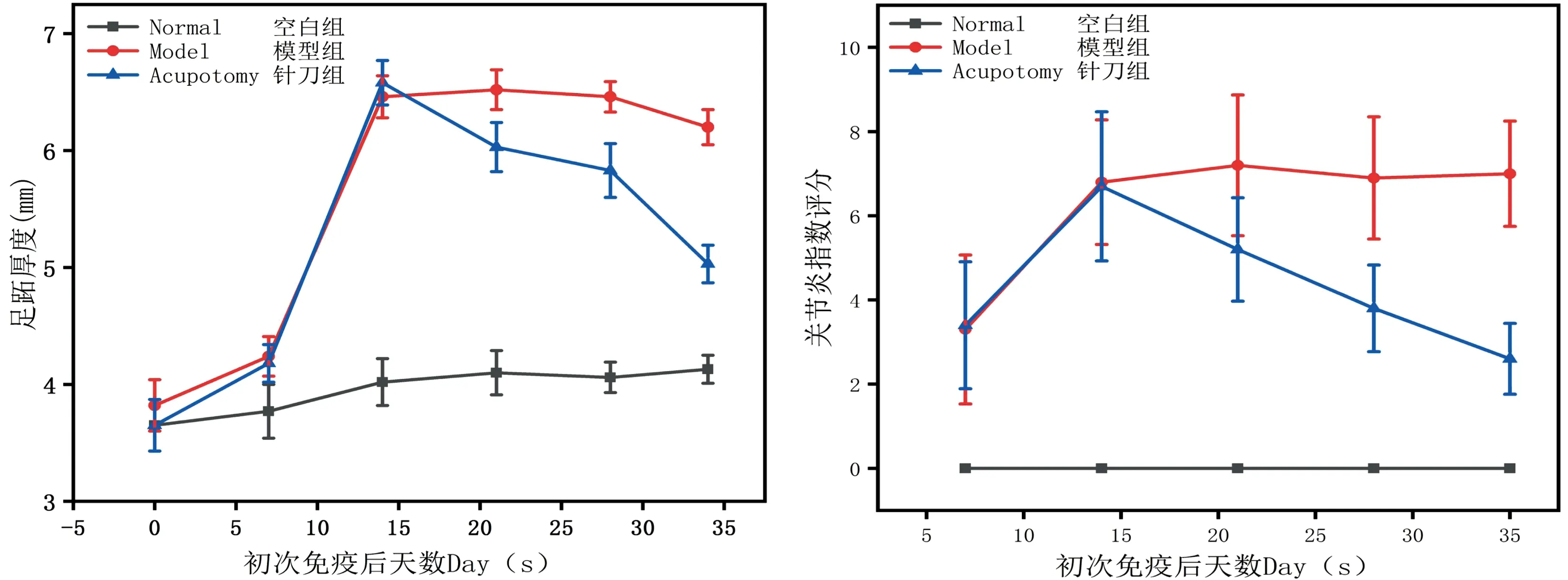
图1 针刀干预对CIA大鼠足趾厚度及AI的影响

表3 针刀干预对CIA大鼠足跖厚度的影响

表4 针刀干预对CIA大鼠AI的影响
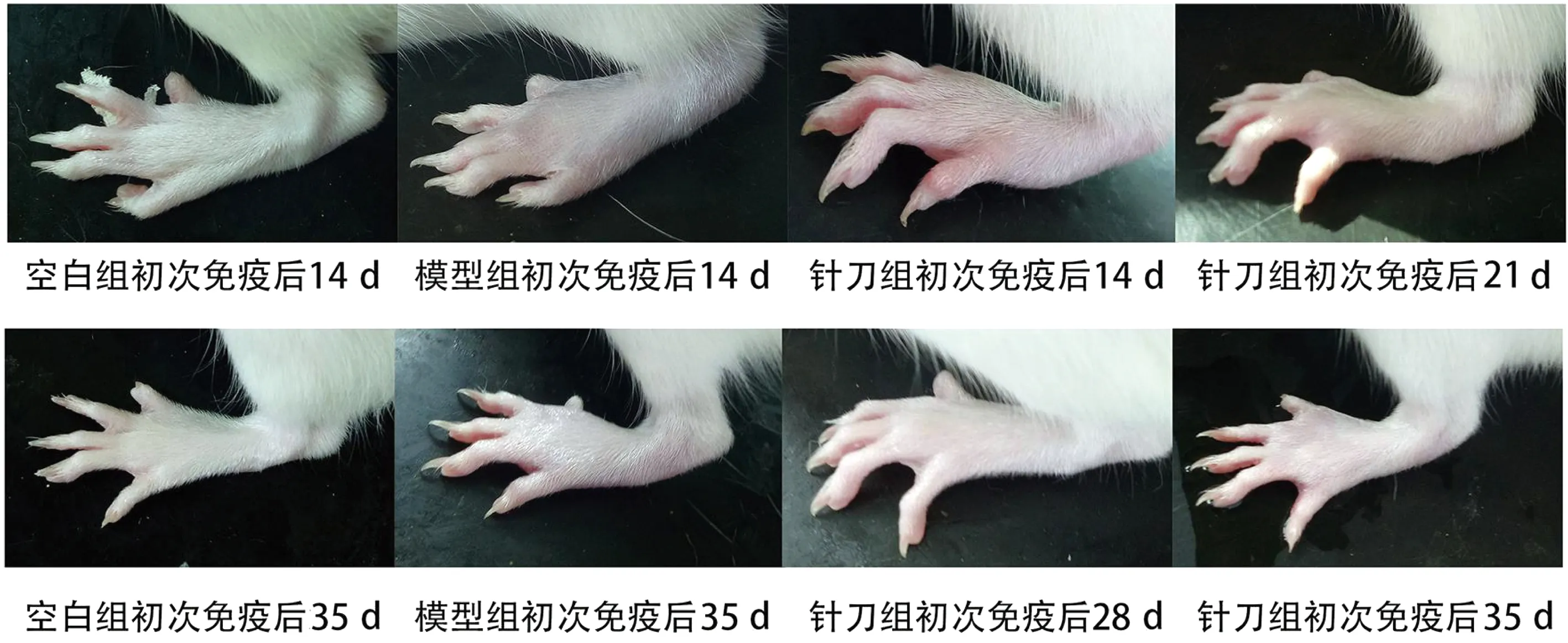
图2 各组CIA大鼠足跖厚度变化情况
2.2 针刀干预对CIA大鼠膝关节病理变化的影响
如图3,空白组大鼠膝关节滑膜呈单层细胞排列,未见增生及炎性细胞浸润,关节腔内无渗出,无血管翳形成,关节软骨表面光滑,无关节破坏;模型组大鼠滑膜组织滑膜层增厚,表面不平整,其中有大量炎性细胞浸润,多见淋巴细胞和单核细胞,新生血管增多,并可见软骨侵蚀现象;针刀组大鼠滑膜细胞增生反应改善,滑膜层数减少,炎性细胞对滑膜的浸润缓解,新生血管数少,软骨表面较光滑。

注:A:空白组(200×);B:模型组(200×);C:针刀组(200×);D:空白组(400×);E:模型组(400×);F:针刀组(400×)。图3 各组大鼠膝关节病理形态比较(HE染色)
2.3 针刀干预对CIA大鼠膝关节滑膜组织Caspase-3、Caspase-9 mRNA表达的影响
如表5,与空白组比较,模型组大鼠膝关节滑膜组织Caspase-3、Caspase-9 mRNA表达水平均明显降低,差异具有统计学意义(P<0.05);针刀组大鼠膝关节滑膜组织Caspase-3、Caspase-9 mRNA表达水平较模型组明显升高,差异具有统计学意义(P<0.05),但仍低于空白组水平,差异具有统计学意义(P<0.05)。

表5 各组大鼠关节滑膜组织Caspase-3、Caspase-9 mRNA相对表达量
3 讨论
RA是一种以反复发作的多关节炎症为主要表现的人体自身免疫综合征,若不予以干预治疗,后期可引起不可逆的骨关节侵蚀,导致关节畸形和功能障碍。有研究表明,滑膜慢性炎症和滑膜组织增生在RA的发病机理中起着核心作用[11],是导致关节破坏的基本原因[12]。因此如何缓解滑膜组织炎症、抑制滑膜细胞增殖是治疗RA的突破点。
类风湿性关节炎属中医学“痹证”范畴,痹者闭也。《素问·痹论》提出:“风寒湿三气杂至,合而为痹”,其基本病机为正虚邪凑,风寒湿杂至,经络气血“不通”,治疗原则以“通”为要。针刀疗法作为将针刺疗法的“针”和手术疗法的“刀”融为一体的治疗方法,将经络理论与现代医学的观点和方法相结合,以经络系统为主干,以闭合性手术的方式,通过松解关节囊、排出关节内炎性渗出以降低关节内部张力,从而达到“流畅气血、祛邪养正、宣通脉络”的作用[3]。本研究证明针刀干预对类风湿性关节炎模型大鼠有明确的治疗效果。通过CIA大鼠足趾厚度检测、AI评分以及关节病理切片观察可发现针刀干预可明显改善CIA大鼠关节肿胀,缓解炎性细胞对滑膜组织的浸润。
天冬氨酸特异性半胱氨酸蛋白酶家族可对细胞内蛋白质进行不可逆的裂解,导致蛋白质获得或者丧失其功能,进而协调细胞凋亡的发生[13]。其中Caspase-3、Caspase-9在启动细胞死亡进程的内源性途径中发挥着至关重要的作用[14-15]。本研究发现,模型组大鼠滑膜组织Caspase-3、Caspase-9 mRNA表达量降低,与空白组对照明显,提示滑膜组织细胞凋亡相关基因表达异常,滑膜组织内细胞增殖和死亡之间的平衡失调,导致滑膜组织增生。针刀组大鼠滑膜组织Caspase-3、Caspase-9 mRNA表达量较模型组明显上调,提示针刀治疗可能是通过内源性途径,激活Caspase-3、Caspase-9,促进滑膜细胞进入死亡程序,抑制滑膜组织的增生而发挥治疗作用。
综上所述,通过观察针刀干预对CIA大鼠模型的影响,初步证明了针刀治疗可通过上调滑膜细胞凋亡相关基因的表达抑制滑膜组织增生,进而缓解关节肿胀及炎性浸润,为针刀治疗RA提供了实验依据。但针刀治疗RA机制复杂,尚有待进一步的实验研究。

