单中心非小细胞肺癌患者KRAS 基因突变分析
李媛媛 向天敏 陈思现 陈永锋 周素丽 陆 伟 张桢珍 蔡永广
1.广东省农垦中心医院肿瘤内科五区,广东湛江 524002;2.上海鹍远生物技术有限公司医学科研部,上海 524002
肺癌是最常见的恶性肿瘤,其发病率和死亡率均 居全球恶性肿瘤首位,其中非小细胞肺癌(NSCLC)占肺癌的80%~85%,是最常见的肺癌类型[1]。铂类为主的双药化疗是治疗NSCLC 的一线方案,虽可一定程度缓解病情、改善生活质量、延长生存期,但细胞毒性和化疗不良反应影响患者的治疗依从性。近年来,随着分子谱分析、靶向治疗药物和精准医疗的发展,NSCLC 的靶向治疗引起临床广泛关注[2]。目前EGFR体细胞突变和ALK、ROS1 和RET 重排已被证实为NSCLC 治疗的重要靶点[3-7]。临床研究显示,应用表皮生长因子受体络氨酸激酶抑制剂(EGFR-TKIs)治疗NSCLC 具有良好的有效性和安全性[8]。KRAS 基因是NSCLC 常见的突变癌基因,是NSCLC 治疗的重要靶点[9]。研究显示不同的KRAS 突变可能导致NSCLC中不同的信号转导级联及不同的致癌和药物敏感性,KRAS 状态可作为预测化疗效果的生物标志物[9]。KRAS 是EGFR 信号通路的下游结点,KRAS 发生持续活化突变,可能影响患者对EGFR-TKIs 的治疗效果[10]。因此NSCLC 患者化疗或EGFR 靶向治疗前检测KRAS 基因的突变状态对指导肿瘤患者个体化用药具有重要临床意义。本研究对单中心NSCLC 患者KRAS 基因突变进行检测,并分析KRAS 突变与患者临床特征的相关性,旨在为进一步研究非小细胞肺癌个体化治疗提供数据参考。
1.资料与方法
1.1 一般资料
收集2016 年12 月—2020 年10 月广东农垦中心医院保存的NSCLC 患者的组织标本103 例,血液标本107 例。其中肺腺癌185 例,其他NSCLC 25 例(包括鳞癌21 例、腺鳞癌3 例和大细胞癌1 例);男104 例,女106 例;吸烟者68 例,不吸烟者106 例,其他36 例未知;青年(<40 岁)4 例,中老年(≥40 岁)206 例。本研究获得了患者的知情同意书,并经广东农垦中心医院医学伦理委员会审查批准。
1.2 方法
1.2.1 标本采集 肿瘤组织用10%中性缓冲福尔马林固定过夜,常规石蜡包埋,由病理学家进行病理诊断和肿瘤纯度检测,肿瘤组织大于10%的样本用于DNA提取。采集外周血10 mL 于Streck 管内,1600 g 离心10 min,取上清血浆样本于2 mL EP 管,再16 000 g离心10 min,抽取上清于2 mL EP 管保存于-80℃用于后续分析。
1.2.2 DNA 提取组织样本DNA 采用QIAamp FFPE组织DNA 提取试剂盒(德国凯杰公司,货号:56404)分离纯化;血浆游离DNA 采用QIAamp Circulating Nucleic Acid Kit 试剂盒分离纯化(德国凯杰公司,货号:55114)。所有步骤均严格按照说明书进行。使用1%的凝胶电泳检测样本目的条带是否有杂带或降解,以测定样本核酸的完整性;使用Qubit 3.0 进行浓度的精确定量,以备后续文库构建所用。
1.2.3 高通量测序和数据分析 使用OncoAim®肺癌靶向基因检测试剂盒(上海鹍远生物技术有限公司,货号:A01D-1)构建高通量测序文库,对肺癌相关的12 个基因的基因突变、重排、拷贝数的变异情况进行检测。采用NextSeq 500 测序仪(美国Illumina 公司)进行PE150 测序。使用序列比对软件BWA 将原始数据比对到人类参考基因组(hg19),使用软件GATK 3.2、MuTect 和VarScan 进行本地序列比对优化、变异识别和注释,结合人工校对,判断KRAS 基因突变情况。
1.3 统计学方法
采用R 软件4.0.1 版本对突变结果进行统计分析,计数数据比较采用χ2检验或Fisher’s 精确检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 KRAS 突变位点分析
210 例NSCLC 患者中,KRAS 突变29 例(13.8%),其中密码子G12X 占58.6%(17/29),密码子G13X 占10.3%(3/29),密码子Q61X 占27.6%(8/29)。除了G12C 外(31.0%,9/29),Q61L 突变检出率在本研究对象中相对较高(24.1%,7/29),其中1 例患者同时检测到Q61L 和K117N 双突变。见图1。

图1 29 例KRAS 突变的非小细胞肺癌患者各种密码子突变频率分布
2.2 KRAS Q61L 突变频率与文献报道数据比较
与欧美人群、东亚人群的数据比较,本研究Q61L的突变检出率显著高于文献报道数据,差异有统计学意义(P <0.05)。见表1。

表1 本组研究与文献报道的NSCLC 患者Q61L 突变的比较(例)
2.3 NSCLC 患者中KRAS 基因突变与临床特征的关系
KRAS 突变与性别相关,男性患者突变率高,差异有统计学意义(P <0.05),而与年龄、是否吸烟、组织学类型以及样本类型无关(P >0.05),见表2。吸烟患者密码子G12/13 碱基的突变高于不吸烟患者,差异有统计学意义(P <0.05);吸烟患者密码子Q61L碱基突变与非吸烟患者比较,差异无统计学意义(P >0.05),见表3。
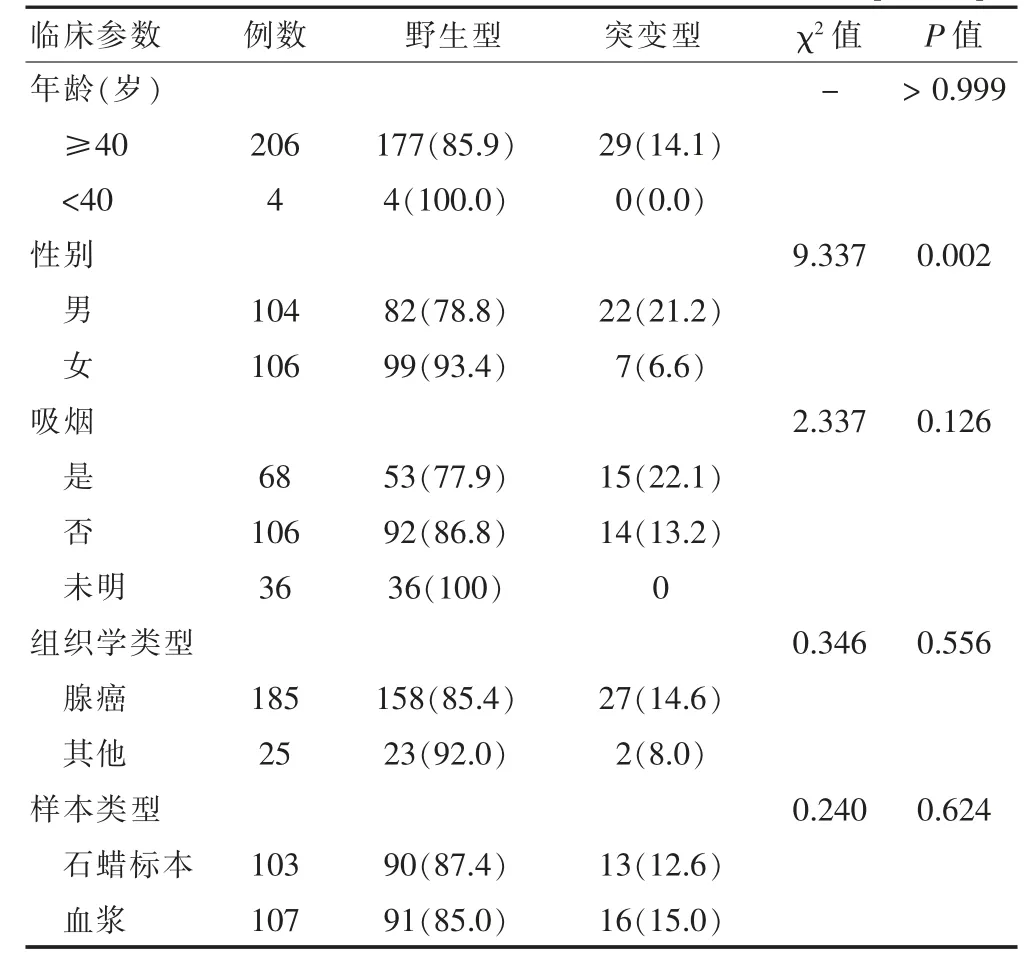
表2 NSCLC 患者临床病理特征与KRAS 基因突变情况[例(%)]

表3 NSCLC 患者吸烟、非吸烟与KRAS 基因各密码子突变的关系[例(%)]
2.4 KRAS 基因突变在组织样本与血浆样本中的比较分析
在103 例组织样本中检测到KRAS 突变13 例,突变率为12.6%(13/103);在107 例血液样本中检测到KRAS 突变16 例,突变率为15.0%(16/107)。见表2。组织样本、血浆样本中,男性KRAS 突变率均明显高于女性(P <0.05);然而,在组织样本和血浆样本中,KRAS 基因突变均与吸烟史无关(P >0.05)。见表4。
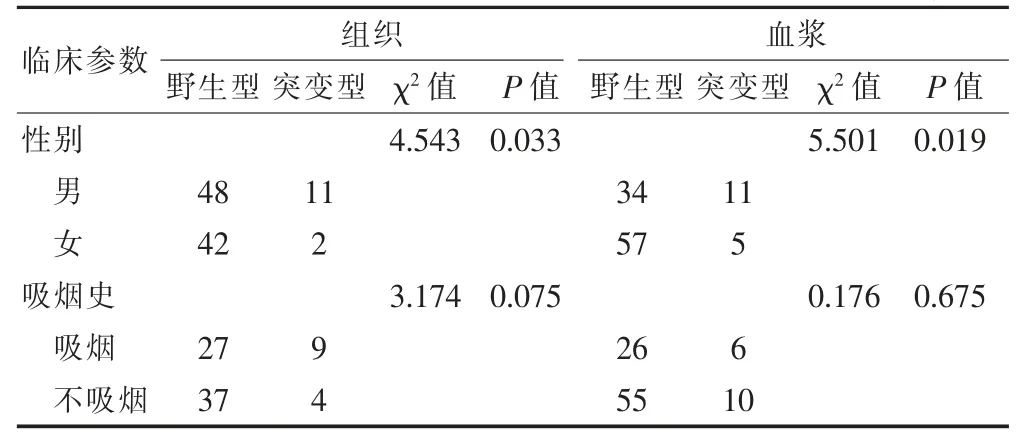
表4 不同样本类型KRAS 突变与临床病理特征的关系(例)
3 讨论
KRAS 基因是RAS 家族中的原癌基因,也是EGFR 信号转导通路中关键的下游信号分子。研究显示,KRAS 是大多数癌症中最常见的突变基因之一,约90%胰腺癌和50%的结肠癌患者存在KRAS 突变。欧美国家NSCLC 患者人群中KRAS 基因突变频率较高,在腺癌患者中甚至达到了30%~50%,但东亚NSCLC 患者KRAS 突病率约为10%[12,14]。本研究单中心人群的NSCLC 患者KRAS 基因突变率,与文献报道的东亚人群基本一致。提示单中心人群KRAS 突变数据符合整个东亚人群的KRAS 突变分布规律,不存在地域特异性。也进一步证实了亚洲地区NSCLS 患者的KRAS 突变率低于欧美的NSCLC 人群[12,14]。
在NSCLC 中,KRAS 突变主要发生在第12、13 和61 密码子,其中以密码子G12X 突变最为常见[15],本研究结果与此结论相符。本研究检测到了显著高于既往文献报道[11-13]的KRAS Q61L 突变,这可能与地域差异有关。湛江市位于中国大陆最南端、广东省最南部,常年日照时间比较长。有文献报道,紫外线辐射靶向嘧啶二聚体,导致高度偏倚产生RAS Q61 突变[16]。文献报道显示,紫外线辐射相关的皮肤黑色素瘤患者中,NRAS 基因突变患者中密码子Q61X 检出率接近90%[17]。因此,日照充足的南方地区的确可能比北部区域产生更多的Q61 相关突变,但目前仅有一个研究中心的数据支持这一假说。今后尚需进一步开展更多中心的相关研究以验证该结论。
本研究认为男性NSCLC 患者KRAS 基因突变率高于女性患者,这与有关文献结论一致[18]。吸烟可引起KRAS 突变积累[18-20],而女性吸烟比例普遍较低,本研究的女性患者吸烟比例不足10%,这可能是导致男性与女性间KRAS 基因突变检出率存在明显差异的原因,但性别差异的具体机制尚待进一步研究。本研究的单中心数据显示KRAS 基因与患者是否吸烟无关,这与许多文献报道吸烟与KRAS 基因突变密切相关不一致[18-19],可能是因为其他研究中G12/13 位为最主要的突变位点,而本中心存在较多的Q61L 突变导致的。进一步分析吸烟与具体突变位点的相关性,发现的吸烟与KRAS 基因G12/13 密码子突变有关,与Q61L 突变无关。这与已有研究结论一致,即在KRAS突变的肺癌患者中,第12、13 密码子最常见,其中颠换突变(G>T 或G>C)在曾经吸烟和正在吸烟的患者中非常普遍[20]。
肿瘤组织仍是用于检测基因突变的最佳样本,但是对于晚期无法进行手术、组织DNA 不足以及经治疗后复发的患者获取活检组织比较困难,就可能导致患者错过最佳的分子靶向治疗期。研究显示,近年来研究发现外周血液中存在着肿瘤细胞凋亡坏死释放出的游离DNA(ctDNA),可反映肿瘤细胞的基因状态,是特征性的肿瘤标志物[21-22]。研究报道血浆与组织基因突变总一致率80%以上[23-24]。由于ctDNA 在血浆中含量低、易降解[25-26],选择一种高灵敏度的检测方法对于检测结果的准确性起到了关键作用。本研究中基于高通量测序的方法检测出血浆与组织样本中KRAS阳性检出率没有显著性差异,将两组样本中KRAS 突变与临床病理特征进行相关性分析发现,统计学结果跟两组样本合并分析得出的结果一致,KRAS 基因突变与性别相关,而跟吸烟史无关。本研究结果提示了血浆样本基因检测分析可以反映本研究人群KRAS基因整体突变情况。
综上所述,本研究中单中心NSCLC 患者KRAS的整体突变率与东亚人群数据一致,而突变位点分布与既往报道存在差异;KRAS 基因密码子Q61L 突变相对较高,可能是该中心NSCLC 患者的一个重要的驱动突变;Q61L 突变与吸烟无关,导致了该中心KRAS总突变与患者是否吸烟无关。液体活检可作为一种有效的方法用于临床分子检测,为不便采集组织样本的肿瘤患者提供支持。

