囊型包虫病所致过敏反应对肠黏膜屏障功能的影响
商海波 李 鑫 刘可可 王 江
新疆医科大学第一附属医院麻醉科,新疆乌鲁木齐 830054
包虫病是一种流行于牧区的人畜共患性疾病,在手术切除或外伤等外力作用下极易引起囊液外溢,经腹膜或组织吸收入血或直接入血后发生过敏反应,且极易发生过敏性休克,给临床治疗带来了极大困难[1]。肠黏膜屏障是一种存在于肠道内防止有害物质进入的生物屏障[2]。在肠腔中存在着大量的有害物质,完整的肠上皮屏障可阻止潜在有害物质的通过,在体内平衡中起着重要作用[3]。有学者表示,肠黏膜屏障受损后细菌、内毒素等进入循环和淋巴系统是引起炎症介质大量表达和全身炎症反应综合征的始动环节[4]。烧伤、急性创伤、中暑、应激等多种病理过程可对肠黏膜造成损伤[5]。研究表明,细胞因子白细胞介素-6(interleukin 6,IL-6)、肿瘤坏死因子α(TNF-α)和磷酸化核转录因子kappa B-p65(phosphorylated nucler factor of kappa B-p65,p-NF-κBp65)可直接对肠黏膜产生损伤,在胰腺炎、创伤等引起的肠损伤中具有重要作用[6-7]。本研究通过了解包虫病所致过敏反应对包虫病小鼠肠黏膜屏障的影响,探索用于包虫病过敏患者的更完备的诊疗方案。
1 材料与方法
1.1 实验试剂与仪器
实验试剂:小鼠D-乳酸试剂盒(型号:MAK058 sigma 公司);二胺氧化酶(diamine oxidase DAO)试剂盒(型号:CSB-E10090M,武汉华美公司);IL-6 和TNF-α 酶联免疫吸附试验(ELISA)试剂盒(型号:EK206/3-96,杭州联科生物技术股份有限公司);Western blot 相关试剂盒(Sangon Biotech 公司);TUNEL 凋亡检测试剂盒(货号:MK1020,武汉博士德公司);BCA 试剂盒(货号:DQ111-01,全式金公司)。
仪器:酶标仪(型号:xMark,TMBio-Rad 公司);微量移液器(型号:单道移液器,大龙医疗设备有限公司);电热恒温培养箱(型号:DNP-9272,上海精宏试验设备有限公司);微量振荡器(型号:MM-2,金坛市医疗仪器厂);恒温鼓风干燥箱(型号:DHG 型,上海精宏试验设备有限公司);显微镜(型号:E200,Nikon生物显微镜)。
1.2 动物模型与分组
实验小鼠:6~8 周龄的雌性BALB/c 小鼠45 只,购自新疆医科大学[SYXK(新)2016-0002],体重18~22 g,SPF 级,饲养于新疆医科大学实验动物中心,保持温度18~22℃,相对湿度50%~60%,由专人饲养,提供洁净的生存环境、优质颗粒饲料、清洁的自来水。新疆医科大学第一附属医院伦理委员会批准通过此饲养及实验设计方案(IACUC20170315-04),所有实验操作遵循实验动物保护规定。采用随机数字表法将小鼠分成空白对照组、囊型包虫病模型组、囊型包虫病致敏组,每组各15 只。由乌鲁木齐市屠宰场抽取羊包虫囊液,获得幼虫微囊,囊型包虫病模型组和囊型包虫病致敏组小鼠分别经腹腔注射细粒棘球绦虫的幼虫微囊,每只小鼠接种约50 个微囊的剂量,建立包虫小鼠模型,空白对照组给予等量生理盐水代替。所有小鼠均饲养3 个月,取血后剖开小鼠腹腔,观察到腹腔内存在包虫囊泡时认为囊型包虫病小鼠模型创建成功;创建包虫病模型小鼠3 个月后建立包虫过敏模型,囊型包虫病致敏组每只小鼠经腹部注射羊源细粒棘球蚴包虫囊液约0.1 mL/10 g 引发过敏反应,空白对照组和囊型包虫病模型组每只小鼠注射生理盐水0.1 mL/10 g[8]。
观察过敏反应:激发过敏反应后,观察小鼠过敏反应情况,当出现抓鼻、喷嚏、瘙痒时认为小鼠发生过敏反应,抓鼻和瘙痒为轻度过敏;对外部刺激反应减弱,活动减少为中度过敏;紫绀、抽搐或死亡为重度过敏,观察时间约为1 h;同时采用马血清导致小鼠过敏性休克反应症状评分表对小鼠过敏症状进行评分[9]。0 分为无症状;1 分为反复抓、搔嘴或耳朵或后退挠耳;2 分为活动减少,自我孤立,眼周、口周水肿;3 分为静止不动超过1 min;4 分为刺激胡须无反应;5 分为震颤、抽搐、死亡。
1.3 样本采集
观察结束后,采用摘眼球取血法留取血标本,随后麻醉小鼠,开腹观察包虫生长情况并留取肠组织标本。将采集到的血标本,在室温下,以3000 r/min(离心半径为30 cm)离心10 min 后,取上层血清装于EP管中,并冻存在-80℃冰箱中。打开腹腔,截取距盲肠5 cm 处远端回肠组织,置于液氮速冻后存于-80℃,用于检测组织中TNF-α 和IL-6 的含量。另留取部分肠组织,置10%甲醛中固定48 h,行病理学观察。
1.4 小肠组织学观察
取各组小鼠的回肠组织,置于10%甲醛中固定24 h,进行石蜡切片、行苏木精-伊红(HE)染色后,在光镜下观察比较各组肠黏膜组织病理学变化。
1.5 血浆D-乳酸和DAO 含量的检测
使用sigma 公司试剂盒(货号:MAK058)测定血浆D-乳酸和DAO 含量,将三组小鼠稀释后的血浆和标准品分别加入酶标板中,经过孵育、洗涤等过程后,用酶标仪在450 nm 波长下依序测量各孔的光密度,计算其含量,实验重复操作3 次,具体按说明书操作。
1.6 肠组织TNF-α 和IL-6 的测定
将三组小鼠肠组织样本与冷的生理盐水按照1∶9的比例混合,加入置于冰上的玻璃匀浆器中匀浆,取匀浆液于室温下,以3000 r/min(离心半径为30 cm)离心15 min,取上清液,应用联科生物公司ELISA 试剂盒检测TNF-α、IL-6 和DAO 浓度,实验重复操作3 次,严格按说明书操作。
1.7 肠黏膜上皮细胞凋亡的检测
取三组小鼠回肠组织石蜡包埋切片,使用武汉博士德公司TUNEL 凋亡检测试剂盒(货号:MK1020),检测凋亡率,实验重复操作3 次,具体步骤按说明书操作。
1.8 Western blot 检测回肠组织中磷酸化NF-κB p65蛋白水平
取三组小鼠回肠组织约100 mg,置于离心管中,加入400μLRIPA 裂解液,混匀后,于室温下,以12000r/min(离心半径为30 cm)离心15 min,收集上清液,获取蛋白样品,采用全式金公司BCA 法试剂盒(货号:DQ111-01)测定蛋白浓度;然后取蛋白样品,经过煮沸、SDS-PAGE 电泳分离蛋白、使蛋白转至PVDF 膜,然后封闭转印膜1 h,TBST 洗3 次,用TBST 稀释一抗(1∶800),4℃孵育过夜,TBST 漂洗3 次,加入稀释的二抗(1∶5000),室温孵育1 h,经显色等过程,最后使用ChemiScope mini 化学发光仪检测、拍照,实验重复操作3 次。
1.9 统计学方法
采用SPSS 19.0 对所得数据进行统计学分析,计量资料采用均数±标准差()表示,组间两两比较采用Dunnett-t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 小鼠模型建立情况
囊型包虫病致敏组小鼠在腹腔注射粗制囊液后均出现不同程度的过敏反应症状:其中4 只小鼠为轻度过敏,症状评分为1 分;11 只小鼠为中度过敏发应,症状评分为2~3 分;无重度过敏反应发生。空白对照组和囊型包虫病模型组小鼠未见明显的过敏反应症状,取血后打开小鼠腹腔,囊型包虫病模型组和囊型包虫病致敏组小鼠腹腔内均有不同程度的包虫囊泡存在,证实造模成功。见图1。

图1 解剖小鼠证实囊型包虫感染情况
2.2 肠黏膜组织学改变
镜下观察,空白对照组小鼠回肠组织结构大体正常,少量绒毛结构破坏,间质少量慢性炎症细胞侵入;囊型包虫病致敏组回肠黏膜明显萎缩,大量肠绒毛变短或断裂,间质较多急慢性炎症细胞浸润;与囊型包虫病致敏组比较,囊型包虫病模型组回肠黏膜萎缩、肠绒毛结构破坏较轻,慢性炎症细胞浸润减少。见图2。

图2 各组小鼠肠黏膜组织苏木精-伊红染色结构
2.3 三组小鼠血浆中DAO 和D-乳酸水平比较
与空白对照组比较,囊型包虫病模型组和囊型包虫病致敏组DAO 含量升高,差异有统计学意义(P <0.05);与囊型包虫病模型组比较,囊型包虫病致敏组DAO 含量升高,差异有统计学意义(P <0.05)。与空白对照组比较,囊型包虫病模型组和囊型包虫病致敏组D-乳酸升高,差异有统计学意义(P <0.05);与囊型包虫病模型组比较,囊型包虫病致敏组D-乳酸含量升高,差异有统计学意义(P <0.05)。见表1。
表1 三组小鼠血浆中DAO 和D-乳酸水平比较()

表1 三组小鼠血浆中DAO 和D-乳酸水平比较()
注:与空白对照组比较,△P <0.05;与囊型包虫病模型组比较,▲P <0.05。DAO:二胺氧化酶
2.4 三组小鼠肠组织中IL-6 和TNF-α 含量比较
与空白对照组比较,囊型包虫病模型组和囊型包虫病致敏组IL-6 含量明显升高,差异有统计学意义(P <0.05);与囊型包虫病模型组比较,囊型包虫病致敏组IL-6 含量升高,差异有统计学意义(P <0.05)。与空白对照组比较,囊型包虫病模型组和囊型包虫病致敏组TNF-α 含量明显升高,差异有统计学意义(P <0.05);与囊型包虫病模型组比较,囊型包虫病致敏组TNF-α 含量明显升高,差异有统计学意义(P <0.05)。见表2。
表2 三组小鼠肠组织中IL-6 和TNF-α 的含量比较(pg/mL,)

表2 三组小鼠肠组织中IL-6 和TNF-α 的含量比较(pg/mL,)
注:与空白对照组比较,△P <0.05;与囊型包虫病模型组比较,▲P <0.05。IL-6:白细胞介素6;TNF-α:肿瘤坏死因子α
2.5 三组小鼠肠黏膜上皮细胞凋亡率比较
显微镜下观察三组小鼠回肠黏膜组织细胞凋亡情况,空白对照组与囊型包虫病模型组肠黏膜上皮细胞凋亡率比较,差异无统计学意义(P >0.05)。与空白对照组和囊型包虫病模型组比较,囊型包虫病致敏组肠黏膜上皮细胞凋亡率升高,差异有统计学意义(P <0.05),见表3、图3。
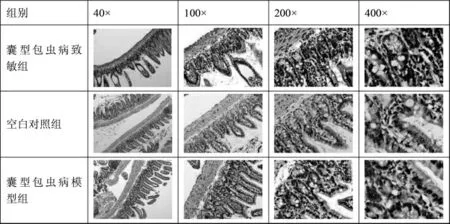
图3 三组小鼠肠黏膜上皮细胞凋亡检测图
表3 三组小鼠肠黏膜上皮细胞凋亡率比较(%,)

表3 三组小鼠肠黏膜上皮细胞凋亡率比较(%,)
注:与空白对照组比较,△P <0.05;与囊型包虫病模型组比较,▲P <0.05
2.6 三组小鼠肠组织中p-NF-κBp65 蛋白水平比较
与空白对照组比较,囊型包虫病模型组和囊型包虫病致敏组的p-NF-κBp65 蛋白表达显著升高,差异有统计学意义(P <0.05);与囊型包虫病模型组比较,囊型包虫病致敏组p-NF-κBp65 蛋白表达升高,差异有统计学意义(P <0.05)。见表4、图4。
表4 三组小鼠肠组织中p-NF-κBp65 蛋白水平比较()
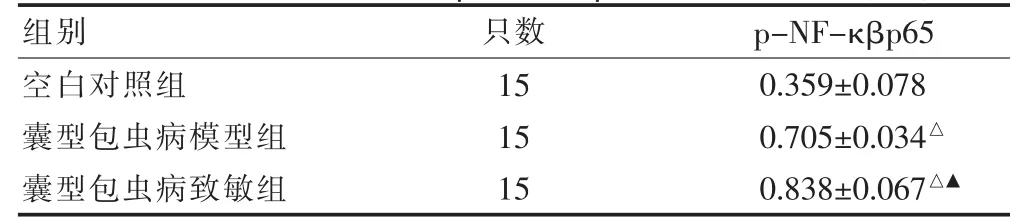
表4 三组小鼠肠组织中p-NF-κBp65 蛋白水平比较()
注:与空白对照组比较,△P <0.05;与囊型包虫病模型组比较,▲P <0.05。p-NF-κBp65:磷酸化核转录因子kappa B-p65

图4 三组小鼠的p-NF-κB p65 蛋白表达
3 讨论
肠道是机体重要的应激场所,其屏障功能的紊乱有利于过度免疫炎症反应的发展[10]。当过敏反应、应激、创伤等各种因素作用于机体后,刺激机体免疫系统生成多种炎症介质,对肠黏膜产生损伤;且过敏反应中释放的组胺和引发的应激反应可引起微循环灌注不足,导致肠黏膜上皮细胞功能障碍和过度凋亡,进而造成肠黏膜损伤、内毒素和细菌移位,引起全身炎症反应,对患者的预后和转归产生不良影响[11-12]。DAO 是一种存在于肠黏膜上层成熟绒毛细胞中的细胞内酶。肠黏膜上皮细胞膜完整性受损时可导致DAO 释放到细胞间质和循环中,使得血浆和肠腔中DAO 水平升高,血液中DAO 含量的增长可间接地说明肠道上皮细胞的损伤[13]。D-乳酸是消化道内细菌发酵的产物,当肠道因缺血或炎症反应等病理过程发生损伤时,肠黏膜完整性受损,通透性增加,肠腔中的D-乳酸通过屏障进入循环系统,使血浆中D-乳酸水平升高。因此,血浆中DAO 和D-乳酸的升高可反映肠黏膜屏障功能障碍,是黏膜屏障损伤的常用指标[14]。本研究中囊型包虫病致敏组和囊型包虫病模型组血浆中DAO 和D-乳酸相较空白对照组明显升高,病理切片显示黏膜损伤严重,说明囊型包虫病致敏组和囊型包虫病模型组肠黏膜发生了损伤。
研究显示,在自然感染囊性包虫病的绵羊中,细粒棘球蚴病可能减少SIgA 的分泌,影响肠黏膜的免疫屏障,使得肠黏膜损伤[15]。赵骁等[16]研究发现,在通过腹腔注射原头蚴建立的囊型包虫病小鼠模型中,小肠黏膜内免疫反应也可被激活,并产生IL-25 等细胞因子。因此在本研究中,囊型包虫病模型组小鼠肠黏膜损伤和通透性增加可能与肠黏膜免疫屏障损伤及免疫反应被激活有关。IL-6 是一种重要的细胞因子,研究发现过度表达的IL-6 可以破坏细胞内核酸和蛋白质,致使黏膜上皮细胞功能紊乱,引起肠黏膜机械屏障的障碍。TNF-α 也可对肠黏膜产生损伤,其在介导肠黏膜屏障功能障碍的复杂反应中起关键作用[17-18]。TNF-α 诱导IL-1、IL-6 的基因表达,活化磷脂酶A2,致使花生四烯酸分解,产生多种炎症介质,从而加重肠道炎症反应[19-23]。研究表明用TNF-α 处理24 h 可引起肠黏膜上皮细胞凋亡增多,通透性增加,使得肠黏膜产生损伤;使用TNF-α 阻断剂处理后,肠黏膜损伤明显减轻[24-25]。本研究中囊型包虫病致敏组肠组织IL-6 和TNF-α 较空白对照组和囊型包虫病模型组明显升高,说明回肠组织发生了炎症反应,IL-6 和TNF-α 可能导致了肠黏膜损伤。
核转录因子(NF-κB)是多种信号传导途径的共同通路和炎症及免疫反应的关键因子[26]。研究表明,重症胰腺炎所致肠黏膜损伤可能是通过NF-κB 信号通路,调节紧密连接蛋白表达,导致肠黏膜损伤[27]。炎症反应初期,细胞受到刺激后产生的细胞因子及内毒素可激活NF-κB,活化的NF-κB 可启动促凋亡基因,使细胞凋亡不断增多,使得肠黏膜上皮屏障损伤;抑制NF-κB 信号通路能产生肠缺血后的保护作用,维持肠黏膜屏障功能[28]。本研究发现,囊型包虫病模型组p-NF-κBp65 蛋白表达升高,而且囊型包虫病致敏组p-NF-κBp65 蛋白表达进一步升高,提示NF-κB 信号通路可能参与了囊型包虫病所致过敏反应产生的肠黏膜屏障功能障碍。
本研究显示囊型包虫病所致过敏反应可引起肠黏膜炎症反应,引起肠黏膜屏障功能障碍,囊型包虫病致敏组肠组织中p-NF-κBp65、IL-6、TNF-α 也明显升高,提示p-NF-κBp65、IL-6、TNF-α 在囊型包虫病所致过敏反应导致的肠黏膜损伤中可能扮演重要作用,这也将为今后囊型包虫病过敏引起的肠黏膜损伤机制的研究奠定基础。

