早期营养及心理干预联合同步放化疗治疗局部晚期非小细胞肺癌的临床研究*
姚 岚,包中会,蒋 义,倪燕侠,黄 琴,罗 燕,任洪波,张小梅,张 弦
重庆市巴南区第二人民医院肿瘤科,重庆 400054
据世界卫生组织的统计报道,全球恶性肿瘤新增1 808万例,死亡956万例,其中肺癌的发病人数和死亡人数均居恶性肿瘤第1位[1]。我国癌症中心数据显示,肺癌是我国人群中最常见的癌症,也是致死率最高的癌症[2]。其中,非小细胞肺癌(NSCLC)占全部肺癌的80%,局部晚期非小细胞肺癌(LANSCLC)约占全部NSCLC的50%,NSCLC 80%以上无法进行手术切除[3]。不可切除的NSCLC患者的一线治疗方案为同步放化疗等综合治疗。
营养不良是肿瘤常见的并发症,肺癌患者在确诊时往往伴有不同程度的营养不良,加上同步放化疗导致的胃肠道不良反应将加速患者营养状况的恶化,直接影响患者的生活质量、治疗疗效及生存时间[4]。放化疗虽然能够控制疾病,但治疗引起的不良反应也加重了患者的心理负担。疾病及治疗所造成的精神压力,可产生相应的负面心理情绪,直接影响患者营养状况,导致治疗效果进一步下降。因此早期、积极、合理的营养及心理干预措施就显得极为重要。
1 资料与方法
1.1一般资料 选取2018年11月至2020年1月在本院接受同步放化疗的60例LANSCLC患者,采用随机数字表法分为研究组30例和对照组30例,2组患者的年龄、性别、病理类型、肿瘤分期等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。肺癌分期参照美国抗癌联盟会第8版分期,本研究经巴南区第二人民医院医学伦理委员会批准,患者均已签署知情同意书。
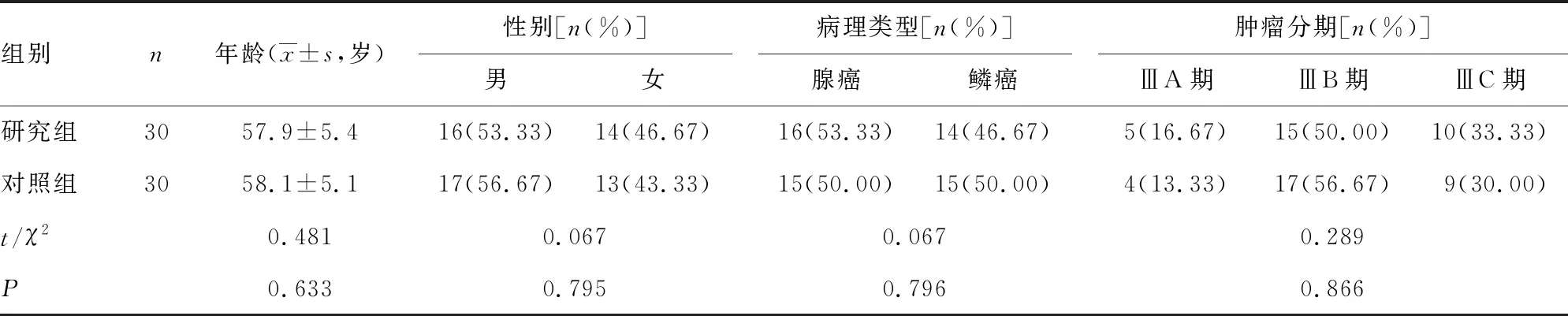
表1 2组患者的一般资料比较
纳入标准:(1)60例患者均经病理组织学或细胞学证实为LANSCLC患者;(2)根据美国抗癌联盟会第8版分期为ⅢA、ⅢB、ⅢC期的患者;(3)肺癌驱动基因检测无表皮生长因子受体基因突变及间变性淋巴瘤激酶/受体酪氨酸激酶1基因融合的患者;(4)年龄26岁~71岁;(5)东部肿瘤协作组评分为0~1分的患者;(6)肝肾功能、骨髓造血功能及心电图正常的患者;(7)无严重并发症,能接受同步放化疗等综合治疗的患者。
排除标准:(1)严重肝肾功能不全,不能接受放化疗者;(2)既往有胸部放疗史者;(3)既往有肺部切除术史者;(4)NSCLC ⅢA期有手术指征者;(5)存在二源性肿瘤者;(6)既往或现存患精神病病史者;(7)合并其他原因导致的心理疾病者;(8)不能配合回答问卷者;(9)认知功能障碍者。
1.2方法
1.2.1放疗 放疗采用体模固定患者,电子计算机断层扫描(CT)模拟机定位,确定原发肿瘤体积、临床靶体积及计划靶体积。脊髓≤40 Gy,双肺V20≤30%,V5≤60%,平均肺剂量≤20 Gy,心脏V30≤40%。2组放疗均在化疗第1天开始进行,放疗剂量相同(原发肿瘤体积60~66 Gy/30~33 F,计划靶体积50 Gy/25 F)。均采用调强放疗,直线加速器6MV-X线等中心照射,放疗25次后均复查CT重新制订放疗计划[5-7]。
1.2.2化疗 肺腺癌患者:第1天培美曲塞500 mg/m2静滴+第3天奈达铂75 mg/m2静滴[8-9]。肺鳞癌患者:第1天紫杉醇135 mg/m2静滴+第3天奈达铂75 mg/m2静滴或第1天多西他赛75 mg/m2静滴+第3天奈达铂75 mg/m2静滴[10]。化疗第1天开始给予放疗。放疗期间,距第1次全身化疗3周后开始予奈达铂40 mg(m2·W)增敏化疗,放疗结束后继续原方案化疗,3周为一周期,共6个周期。
1.2.3营养及心理干预措施 对照组只给予常规的肺癌知识宣教,出现营养风险及心理焦虑后给予对症处理。研究组在同步放化疗的基础上,接受早期、全程的营养及心理干预。
营养干预:患者放化疗期间,每周监测1次体质量变化,水及电解质平衡情况,并由具有营养干预经验的营养师评估营养状态,营养师根据体质量变化及营养情况给予营养指导,保证患者合理的总热量摄入。按照蛋白质15%~20%,脂肪25%~30%,碳水化合物50%~60%的方案给予膳食指导,在放化疗期间,每日总热量至少保证25~30 kCal/(kg·d),必要时添加肠内、肠外营养治疗。
心理干预:主管医师及时与研究组患者沟通病情,根据患者具体情况个体化制订心理干预内容,鼓励患者表达,进行自我倾诉,明确患者对疾病的疑虑,进行耐心解释,消除其恐惧心理,更好地配合治疗。责任护师给予优质护理及宣教,与患者建立良好的沟通,取得患者及家属的信任。对存在焦虑、抑郁等负面情绪的患者及时给予心理疏导,严重者及时采用药物治疗。介绍一些抗癌成功的病例,增强患者的信心,调节患者情绪。对压力较大、情绪不稳定的家属也给予健康教育及鼓励。
1.3观察指标及评价标准
1.3.1体质量 分别于同步放化疗前后测量并记录患者的体质量变化情况。
1.3.2营养状态 分别于同步放化疗前后评估患者的营养状态。根据住院患者营养风险筛查NRS-2002评估表,总分<3.0分,患者无营养风险,总分≥3.0分,患者存在营养风险。存在营养风险的患者通过患者提供的主观全面评估表确定营养不良等级,A级营养良好,B级中度营养不良,C级重度营养不良。营养达标率=(A级营养例数+B级营养例数)/总例数×100%。
1.3.3焦虑抑郁情况 分别于同步放化疗前后通过医院焦虑抑郁量表(HAD)对患者的精神状况进行评估,总分0~<8分代表无抑郁或焦虑,总分8~<11分代表可能或临界抑郁或焦虑,总分11~20分代表可能有明显的抑郁或焦虑。
1.3.4近期疗效评价 2组患者同步放化疗结束后1个月,按实体瘤疗效评价标准,所有目标病灶完全消失至少维持4周为完全缓解(CR);基线病灶最大径之和至少减少30%,且至少维持4周为部分缓解(PR);基线病灶最大径之和至少增加20%(且绝对值增加5 mm)或出现新病灶为进展(PD);基线病灶最大径之和有减少但未达PR或有增加但未达PD为稳定(SD)。客观缓解率=(CR例数+PR例数)/总例数×100%。
1.4质量控制 所有问卷调查均由本院的医师、护师、营养师通过系统培训后进行。问卷评估均在限定时间内,所有数据由本科医师录入系统,并可以随时查询。
2 结 果
2.12组患者治疗前后体质量比较 2组患者治疗前的体质量比较,差异无统计学意义(P>0.05);治疗后,研究组患者的体质量高于对照组,差异有统计学意义(P<0.05);研究组患者治疗前后的体质量比较,差异无统计学意义(P>0.05);对照组患者治疗后体质量低于治疗前,差异有统计学意义(P<0.05)。见表2。
表2 2组患者治疗前后体质量比较
2.22组患者治疗前后营养状况比较 治疗后研究组患者的营养达标率高于对照组,差异有统计学意义(P<0.05),见表3。
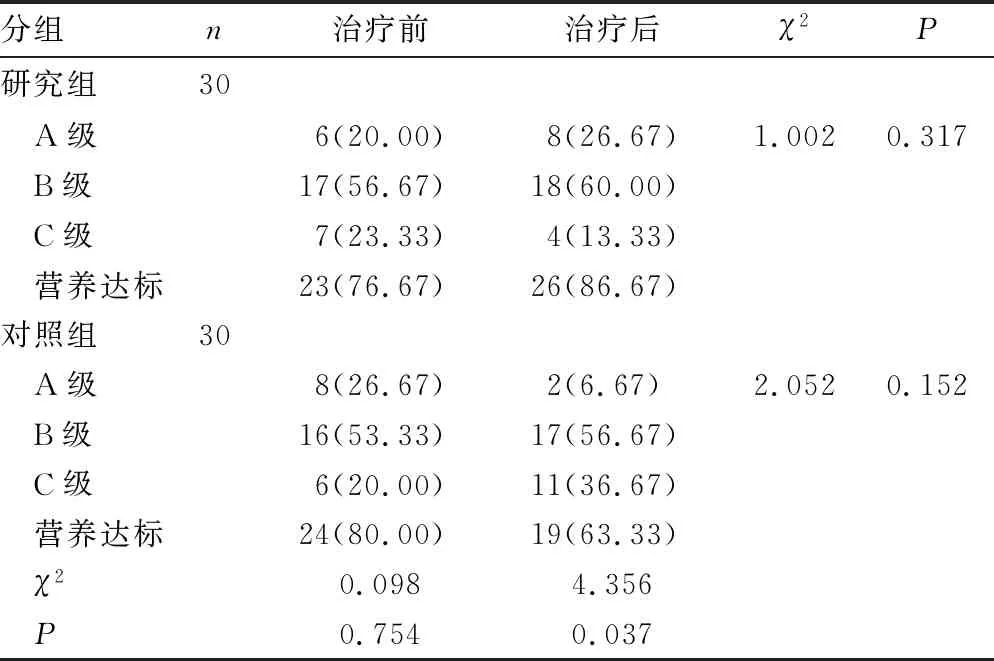
表3 2组患者治疗前后营养状况比较[n(%)]
2.32组患者治疗前后焦虑、抑郁情况比较 2组患者治疗前HAD评分比较,差异无统计学意义(P>0.05);治疗后,研究组HAD评分明显低于对照组,差异有统计学意义(P<0.05),见表4。
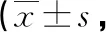
表4 2组患者治疗前后焦虑抑郁情况比较分)
2.42组患者近期疗效比较 研究组患者的客观缓解率高于对照组,差异有统计学意义(P<0.05),见表5。
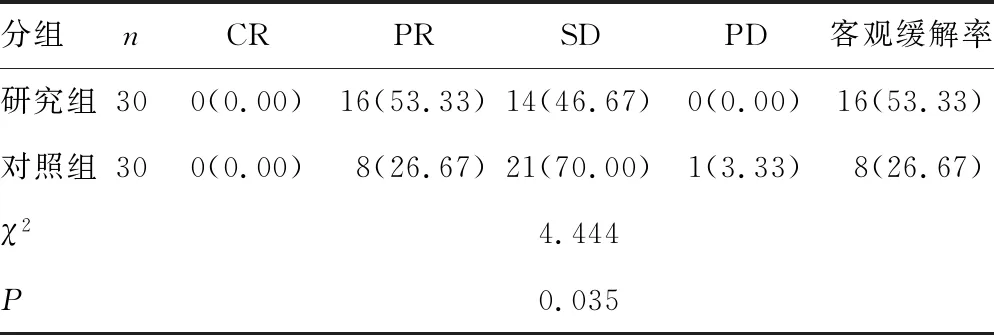
表5 2组患者近期疗效比较[n(%)]
3 讨 论
本研究中研究组80.00%的LANSCLC患者存在营养不良,其中重度营养不良者占23.33%,相关临床研究证实,肿瘤患者营养不良与疾病、抗肿瘤治疗不良反应及心理因素相关[11],营养不良会对恶性肿瘤放疗患者造成降低肿瘤细胞的放射敏感性、影响放疗摆位的精确性、增加放疗不良反应、降低放疗的耐受性、延长总住院时间等的不良影响,同时,营养不良还是肿瘤局部复发和生存率低的危险因素[12]。本研究发现早期进行营养干预治疗,保证放化疗期间肺癌患者拥有足够的营养摄入,在同步放化疗治疗结束后,体质量可维持恒定。因此,肺癌患者在放化疗期间联合营养支持治疗是必要的[13]。
本研究中LANSCLC患者普遍存在焦虑、抑郁情绪。相关临床研究表明,多数癌症患者存在明显的孤独感,失去了情感寄托,导致在诊断出癌症后出现严重的负面情绪,失去治疗的信心,产生严重的焦虑和抑郁情绪[14]。对肺癌患者实施心理干预,能减轻患者的应激反应,有效改善患者焦虑、抑郁情绪,提高患者治疗依从性,提高生活质量[15]。本研究中通过加强与患者及家属的沟通,给予患者更多的情感支持和关怀,增加患者对肺癌的认识,同时,也加强了与患者家属的联系,让患者体会到治疗期间周围人给予的关心与关怀,增加了患者在治疗疾病中的信心,在放化疗结束时,研究组的HAD评分明显低于对照组,差异有统计学意义(P<0.05),这表明了早期进行心理干预十分有必要。
本研究中研究组的客观缓解率高于对照组(P<0.05)。相关临床研究证实,将抗肿瘤治疗与营养支持治疗二者联合可延长患者的生存时间,营养支持可以提高肺癌患者对化疗的耐受性,增加治疗依从性,从而改善化疗疗效[16]。在实施放化疗过程中,多数患者伴有不同程度的心理障碍,在恶性肿瘤患者放化疗中加强针对性的心理干预能够有效改善不良情绪,提高患者的生存质量,改善整体治疗效果[17]。本研究中在治疗期间进行全程化的营养及心理管理,除了能够改善患者的营养、焦虑与抑郁状况,还能够提高患者的客观缓解率。这表明,抗肿瘤治疗与营养支持、心理干预联合有利于改善患者的治疗疗效。在后续的临床研究中,将扩大样本量,对病理类型进行分组讨论,研究联合治疗对不同病理类型的NSCLC的临床疗效。
综上所述,在接受同步放化疗的LANSCLC患者中,早期应用营养支持及心理干预治疗能明显降低营养不良风险,缓解患者焦虑、抑郁情绪,改善患者生存质量,提高治疗依从性,从而提高治疗疗效,具有重要的应用价值,值得临床推广应用。

