特发性肺纤维化患者血清淀粉样蛋白A和钙卫蛋白水平变化及临床意义研究
孙巧敏,张晓霞
河北省邢台市第三医院检验科,河北邢台 054000
特发性肺纤维化(IPF)是一种慢性、进行性、间质性肺纤维化疾病,起病隐匿,病情逐渐加重或急性加重,以呼吸功能不可逆受损和典型的间质性肺炎为特点,诊断时无法预测其进展程度,预后不良[1]。近年来已经有研究提示多种炎症相关因子可作为IPF预后的生物标志物,但迄今为止仍没有有效的蛋白质类标志物可以准确预测该病的转归[2]。血清淀粉样蛋白A(SAA)是一种急性时相反应蛋白,有报道显示在慢性阻塞性肺疾病、肺癌和结缔组织肺病中存在SAA过表达[3]。钙卫蛋白是一种异源二聚体复合物,属于S-100家族,也参与炎性反应。研究表明钙卫蛋白常作为炎性肠病的生物标志物,也和系统性硬化症、皮肤纤维化等多种纤维化疾病有关[4]。SAA、钙卫蛋白与IPF的关系尚未明确,本研究拟探讨SAA、钙卫蛋白在IPF患者中的变化,并分析其临床意义。
1 资料与方法
1.1一般资料 收集2016-2019年于本院呼吸科进行诊治的IPF患者25例为IPF组,其中男16例,女9例;平均年龄(66.3±8.5)岁。患者符合2002年《特发性肺(间质)纤维化诊断和治疗指南(草案)》[5]中的相关诊断标准。排除合并肺部其他感染、心血管并发症、胃部疾病或有阻塞性睡眠呼吸暂停低通气综合征病史等,从而使用他汀类药物进行治疗的患者。
同期收集本院与IPF组性别、年龄等基本资料匹配的,经诊断为非IPF的肺部其他疾病患者25例为疾病对照组,其中男15例,女10例;肺癌3例,结缔组织病间质性肺炎8例,细菌性肺炎7例,慢性阻塞性肺疾病7例;平均年龄(63.8±7.2)岁。并收集伴有胸痛、胸闷等自觉症状,但纤维支气管镜和影像学检查均正常的患者25例为健康对照组,其中男17例,女8例,平均年龄(64.7±6.5)岁。本研究经本院伦理委员会批准实施,批准件号为K2015237。所有研究对象均签署知情同意书。
1.2方法 收集并记录所有研究对象的详细资料,包括人口学资料和临床病历资料。临床病历资料主要包括血液学指标(血常规、肝功能、肾功能及血脂水平)和主要肺功能指标[第1秒用力呼气量(FEV1)、用力肺活量(FVC)和FEV1/FVC等]。所有研究对象出院后临床随访12个月。清晨抽取所有研究对象外周静脉血2 mL,促凝后4 ℃、3 000 r/min离心10 min,分离血清并使用对应的酶联免疫吸附试验试剂盒检测SAA和钙卫蛋白。SAA试剂盒购自上海泽叶生物科技有限公司(货号ZY-SAA-Hu,生产批号AS200525);钙卫蛋白试剂盒购于瑞士Bohlmann公司(货号EK-CAL,生产批号EK200417),检测过程严格按照说明书进行操作。

2 结 果
2.1各组血液学和肺功能指标比较 IPF组和疾病对照组肺功能较健康对照组明显变差(P<0.05);与疾病对照组和健康对照组比较,IPF组高密度脂蛋白水平降低,总胆固醇、低密度脂蛋白、三酰甘油水平升高(P<0.05)。见表1。
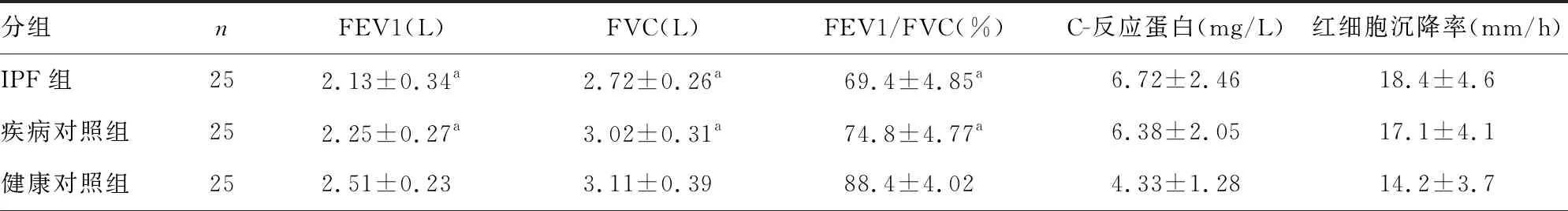
表1 各组肺功能和血液学指标比较

分组nD-二聚体(mg/L)血肌酐(μmol/L)乳酸脱氢酶(U/L)总胆固醇(mmol/L)高密度脂蛋白(mmol/L)IPF组250.47±0.1163.1±11.4197.6±31.76.27±1.46ab0.87±0.15ab疾病对照组250.46±0.1261.9±8.7177.8±29.44.43±0.971.27±0.26健康对照组250.43±0.0858.6±9.3170.3±28.24.14±0.851.34±0.31

注:与健康对照组比较,aP<0.05;与疾病对照组比较,bP<0.05。
2.2各组SAA和钙卫蛋白水平比较 IPF组SAA水平为(6.02±1.58)μg/mL,明显高于疾病对照组的(4.17±1.39)μg/mL和健康对照组的(3.64±1.83)μg/mL,差异有统计学意义(t=2.414,P=0.019;t=2.631,P=0.013),但疾病对照组和健康对照组比较差异无统计学意义(t=0.472,P=0.953);IPF组血清钙卫蛋白水平为(2.63±0.27)μg/mL,明显高于疾病对照组的(1.05±0.18)μg/mL和健康对照组的(0.78±0.15)μg/mL,差异有统计学意义(t=3.187,P=0.002;t=3.458,P<0.001),但疾病对照组和健康对照组比较差异无统计学意义(t=0.689,P=0.532)。
2.3SAA、钙卫蛋白与肺功能的相关性分析 SAA、钙卫蛋白水平与主要肺功能指标均呈负相关(P<0.05),见表2。

表2 SAA、钙卫蛋白与肺功能的相关性分析
2.4SAA与主要脂类指标的相关性分析 SAA与高密度脂蛋白水平呈负相关(P<0.05),与总胆固醇、低密度脂蛋白和三酰甘油水平均呈正相关(P<0.05),见表3。
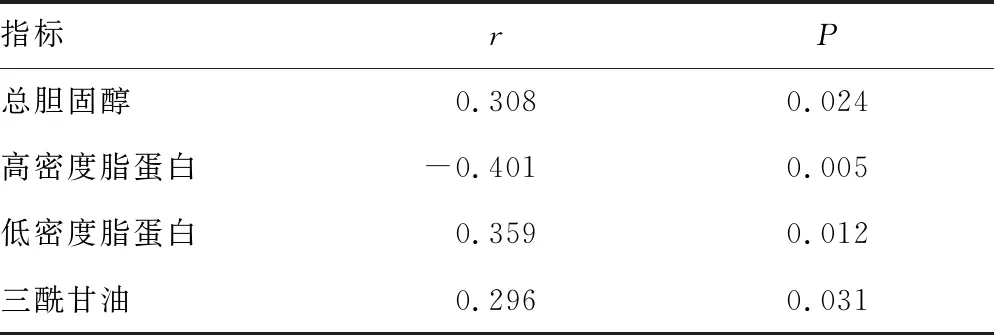
表3 SAA与主要脂类指标相关性分析结果
2.5ROC曲线分析 SAA和钙卫蛋白联合诊断IPF的灵敏度、特异度、阳性预测值和阴性预测值均较高。见表4。
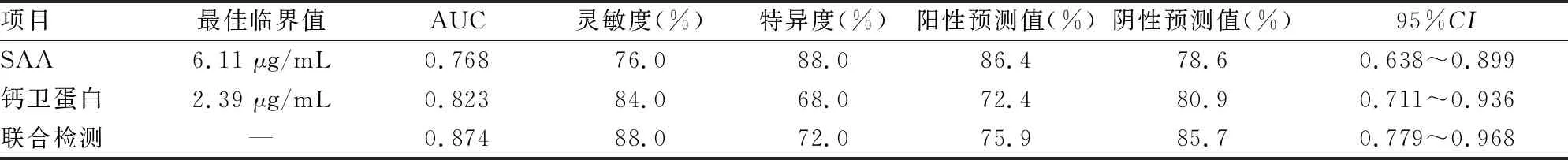
表4 ROC曲线分析
2.6Kaplan-Meier生存曲线分析 随访截止时共有8例IFP患者死亡。以SAA=6.11 μg/mL为最佳临界值,所有IFP患者中有11例SAA≥6.11 μg/mL,其中6例在随访期间死亡;14例IFP患者SAA<6.11 μg/mL,其中2例在随访期间死亡。以钙卫蛋白=2.39 μg/mL为最佳临界值,所有IFP患者中有15例钙卫蛋白≥2.39 μg/mL,其中5例在随访期间死亡; 10例IFP患者钙卫蛋白<2.39 μg/mL,其中3例在随访期间死亡。Kaplan-Meier生存曲线结果提示SAA≥6.11 μg/mL、钙卫蛋白≥2.39 μg/mL与出院后死亡比例升高有关,SAA、钙卫蛋白水平越高,存活率越低。见图1。

注:A为以SAA=6.11 μg/mL为最佳临界值的生存曲线;B为以钙卫蛋白=2.39 μg/mL为最佳临界值的生存曲线。
3 讨 论
炎症状态的持续在IPF中发挥重要作用,与炎症有关的分子有潜力作为IPF的生物标志物。本研究收集IPF患者的详细临床指征以分析SAA、钙卫蛋白水平与IPF诊断和临床转归间的潜在关系。
SAA属载脂蛋白家族异构体,主要由肝脏中激活的单核细胞产生,参与调节炎症过程和脂质代谢过程,被认为是系统性炎症活动最敏感的指标之一[6]。有研究显示慢性阻塞性肺病、肺癌相关的慢性炎症性肺病患者中SAA水平明显升高,SAA水平可能与肺部疾病关系密切[3,7]。本研究结果显示,IPF组SAA水平高于疾病对照组和健康对照组(P<0.05)。对于IPF等纤维化性肺疾病中SAA水平的升高机制,目前还没有明确的解释。有研究称IPF患者中SAA的过表达可能与纤维化有关,因为SAA不仅在肝脏中产生,还由肺成纤维细胞产生[8];慢性阻塞性肺病等与低氧刺激相关的肺部疾病中SAA水平也会升高[3,9],提示IPF患者存在的低氧分压状态也可能使SAA水平升高。多种因素造成的高水平SAA可诱导金属蛋白酶(MMP)-1、MMP-5和MMP-7等多种基质金属蛋白酶的过度生成,最终通过参与炎症调节而参与IPF的发展[2]。
钙卫蛋白是由S100A8和S100A9亚基组成的异源二聚体复合物,可由巨噬细胞、单核细胞和中性粒细胞产生,属于损伤相关分子模式蛋白,可促进炎性反应[10]。近年来对钙卫蛋白的研究多集中在炎症性肠病方面,在肺部疾病中的研究有限。在肺纤维化中,S100A9激活肺成纤维细胞增殖,并通过晚期糖基化终末产物受体(RAGE)诱导促炎细胞因子的产生,从而参与纤维化激活与进展[11]。RAGE是S-100家族蛋白受体,参与免疫反应并加速炎性反应。此外,RAGE的可溶性亚型通过干扰受体结合而对钙卫蛋白的促炎信号产生保护反应[12],IPF患者钙卫蛋白水平发生改变,提示钙卫蛋白参与了IPF的发病机制。已有研究显示IPF患者肺泡灌洗液中钙卫蛋白S100A9亚基水平高于结节病患者和体检健康者,且S100A9水平与患者肺功能降低有关[13]。本研究结果显示,IPF患者的血清钙卫蛋白水平高于疾病对照组和健康对照组(P<0.05),与之前的研究结果相似。IPF患者血清钙蛋白升高的确切机制尚不清楚,可能与IPF患者中性粒细胞和单核/巨噬细胞数量增加有关。已经证实支气管肺泡灌洗液中中性粒细胞增多与IPF预后不良相关,钙卫蛋白水平也可能与IPF患者疾病严重程度有关[13]。
SAA和钙卫蛋白的产生来源及机制存在差异,尚未有研究发现二者存在直接相关性,但二者均通过不同途径参与了IPF的进展,本研究结果显示,以SAA和钙卫蛋白联合检测IPF时,其AUC为0.874,诊断IPF的灵敏度、特异度、阳性预测值和阴性预测值均达到较高水平。
本研究结果还显示,IFP患者主要肺功能指标(FEV1和FEV1/FVC)降低,SAA和钙卫蛋白水平与上述2个主要肺功能指标均呈负相关,提示SAA和钙卫蛋白水平升高可能预示IPF患者肺功能不良。除肺功能外,本研究还发现IFP患者存在血清脂质代谢异常情况,SAA水平与高密度脂蛋白呈负相关,与总胆固醇、低密度脂蛋白和三酰甘油呈正相关,提示SAA可能通过参与脂类代谢影响患者预后。Kaplan-Meier生存曲线结果显示,入院就诊时SAA、钙卫蛋白水平越高,患者死亡风险越高,这表明二者与IPF患者生存结局有关。针对透析患者的研究显示,血液中存在的SAA会与高密度脂蛋白结合,形成的复合物对巨噬细胞有很高的亲和力,可将巨噬细胞从血液中清除,从而增加了患者心血管疾病的发生风险[14]。心肌梗死和肺动脉高压等心血管事件是IPF患者常见伴发病[15],IPF患者存在的炎症状态、缺氧状态、脂质代谢异常及肺纤维化状态等,可使SAA和钙卫蛋白水平升高,进而又促进炎症进展和肺纤维化进程,同时血液中存在的高水平SAA-高密度脂蛋白复合物,致使患者心血管疾病的发生风险提高,增加患者病死率。

