新鲜和干制龙眼果肉多糖免疫调节活性的分析
冯 潮, 温亚州, 杨宇哲, 甘庭圣, 杨瑞丽, 李 武*
(1.海南大学 食品科学与工程学院,海南 海口 570228;2.海南省营养与功能食品重点实验室,海南 海口 570228;3.华南农业大学 食品学院,广东 广州 510642;4.广东省食品质量安全重点实验室,广东 广州 510642)
多糖是由10个以上的单糖单元以糖苷键连接组成的大分子,其广泛参与细胞的黏附、免疫、增殖和分化[1]。近年来,天然来源的多糖因其具有的生物学活性,在药理学和生物化学领域引起了广泛关注[2-3]。目前,已有香菇多糖、灵芝多糖、黄芪多糖等几种天然来源的多糖被应用于临床或临床前研究[4-5]。研究发现,黄芪多糖具有激活巨噬细胞、调节T/B细胞和机体免疫的功能[1,5]。桑葚多糖可增加NK细胞活性,促进T/B淋巴细胞增殖,增强机体特异性和非特异性免疫[6]。灵芝多糖可促进树突状细胞的成熟,在癌症免疫治疗过程中诱导T细胞增殖[7]。同时,多糖具有补益心脾、缓解神经疼痛和消除肿胀等功效[8-9]。
龙眼是一种亚热带特色水果,除我国外,在南亚地区、美国和澳大利亚也有种植[10]。目前我国龙眼种植面积和产量均居世界首位[11]。干制龙眼(桂圆)是我国药典收录的一味中药,具有补益心脾、缓解神经疼痛和消除肿胀的功效[12]。现代药理学研究表明,多糖是龙眼肉生物活性的主要物质基础之一[13],报道显示龙眼多糖具有抗肿瘤[14]、抗氧化[15]和免疫调节等生物活性[16]。
由于龙眼产期集中,除鲜食外,其主要的加工方式为干制。文献显示,干燥过程可能会对多糖的结构和生物活性产生显著影响[17]。韩苗苗等对龙眼干燥过程中其总多糖的活性变化进行了分析,发现热风干燥12~60 h,其总多糖对DPPH、羟自由基清除能力和总抗氧化能力显著提高;干燥12~24 h时,总多糖抑制SGC7901和HepG2肿瘤细胞的能力显著增强。但是由于没有分析单一多糖组分的活性变化,作者推测多糖的生物活性差异可能与美拉德反应关联的多糖-蛋白质相互作用有关[18]。基于以上研究背景,作者采用小鼠肠系膜淋巴结细胞和巨噬细胞模型,分析了分离纯化获得的新鲜和干制龙眼果肉多糖的免疫调节活性,旨在为龙眼的精深加工提供理论依据。
1 材料与方法
1.1 材料与设备
龙眼(品种“储良”):购自广州市天平架水果市场,65℃鼓风干燥去皮、去核后的鲜龙眼至水分含量为11.4%,备用。小鼠巨噬细胞(RAW264.7):中山大学中山医学院提供;昆明小鼠(SPF级):购自海南省药物研究所;RPMI-1640培养基、FBS(胎牛血清)和DMEM培养基:购自赛默飞世尔科技(中国)有限公司;中性红、MTT(噻唑蓝)、LPS(脂多糖):购自西格玛奥德里奇公司;D301-R大孔吸附树脂:购自南开大学树脂公司;小鼠TNF-α试剂盒、IL-6试剂盒:购自美国R&D公司;DEAE-FF阴离子交换树脂:购自美国通用公司。Alpha LD Plus型真空冷冻干燥机:德国MARTIN CHRIST公司产品;1200高效液相色谱仪(HPLC):安捷伦科技(中国)有限公司产品;SW-CJ-IF型超净工作台:苏州净化设备有限公司产品;SpectraMax 190型全自动酶标仪:美谷分子仪器(上海)有限公司产品;311型二氧化碳培养箱:赛默飞世尔科技(中国)有限公司产品。
1.2 实验方法
1.2.1 鲜龙眼和干龙眼多糖的制备 鲜龙眼多糖(LPX3)制备:新鲜龙眼去皮、去核,打浆,料液体积比为1∶15,80℃水浴搅拌2 h,200目纱布过滤。果渣复提2次。将合并的滤液浓缩至总糖质量分数为2%~4%。体积分数80%乙醇溶液醇沉24 h,离心,少量蒸馏水复溶沉淀。加入D301-R大孔树脂,在pH 5.0、温度48℃、料液体积比61∶100、时间2 h条件下脱色素和除蛋白质。100目纱布过滤,浓缩后透析48 h,浓缩得粗龙眼多糖[19]。将阴离子交换树脂装入1.6 cm×30.0 cm的层析柱中,蒸馏水冲洗干净后用pH 9.0的Tris-HCl缓冲液平衡,上样,流量为0.5 mL/min。洗脱程序为:0.0 mol/L NaCl洗脱30 min,0.03 mol/L NaCl洗脱120 min,0.05 mol/L NaCl洗脱60 min。检测洗脱峰,将0.05 mol/L NaCl洗脱得到的组分浓缩,透析48 h,浓缩得到粗龙眼多糖。得到的粗龙眼多糖采用安捷伦1200 HPLC、TSKgel-G4000PWXL串联TSKgel-G3000PWXL纯化,以示差检测器检测并收集相应均一组分,浓缩,冷冻干燥后得到LPX3。
干龙眼多糖(LPG2)制备:体积分数80%的乙醇溶液浸泡干龙眼肉48 h,阴干后打浆,80℃水浴浸提2 h,料液体积比1∶15,200目纱布过滤。果渣复提2次。提取纯化过程同上所述。
1.2.2 小鼠肠系膜淋巴结细胞的制备 小鼠推颈处死,移至超净台内,取肠系膜淋巴结,剪碎过200目不锈钢筛网,PBS冲洗2次,收集细胞。常温1 000 r/min离心5 min收集细胞,用适量RPMI-1640完全培养基调整细胞浓度。37℃、体积分数5%CO2培养备用。
1.2.3 肠系膜淋巴结细胞增殖能力的测定 肠系膜淋巴结细胞增殖能力的测定参照文献[20],简述如下:细胞浓度调整至5×106个/mL,接种至96孔板。样品组用不同质量浓度(6.25、25、200μg/mL)的LPX3和LPG2孵育细胞。以等量RPMI-1640完全培养基为空白对照组,并设置6个平行。培养72 h后加入MTT溶液(5.0 mg/mL)20μL,37℃孵育4 h。加入三联液100μL,37℃再次孵育4 h。酶标仪测定490 nm处吸光度。计算公式如下:

式中:I为细胞增殖分数,%;A1为不同质量浓度LPX3和LPG2组肠系膜淋巴结细胞加入MTT和三联液处理后在490 nm处吸光度;A2为空白对照组肠系膜淋巴结细胞加入MTT和三联液处理后在490 nm处吸光度。
1.2.4 巨噬细胞增殖能力的测定 巨噬细胞增殖能力的测定参照文献[21]方法执行,简述如下:调整细胞浓度至2×105个/mL,接种至96孔板培养2.0 h,吸去培养基。加入100μL DMEM完全培养基,37℃、体积分数5%CO2培养12 h后吸去培养基。样品组加入不同质量浓度(100、200、400μg/mL)LPX3和LPG2。空白对照组加入等量的DMEM完全培养基,每组6个平行。培养24 h后加入MTT溶液(5.0 mg/mL)20μL,37℃继续孵育4.0 h。吸去培养基,加入DMSO 150μL。酶标仪振荡10 min后,测定490 nm处吸光度。计算公式如下:

式中:I为细胞增殖分数,%;A3为不同质量浓度LPX3和LPG2组巨噬细胞加入MTT和三联液处理后在490 nm处吸光度;A4为空白对照组巨噬细胞加入MTT和三联液处理后在490 nm处吸光度。
1.2.5 巨噬细胞吞噬能力的测定 巨噬细胞吞噬能力的测定参照文献[22],简述如下:调整细胞浓度至2×105个/mL,接种至96孔板培养2.0 h后,吸去培养基。加入100μL DMEM完全培养基,37℃、体积分数5%CO2培养12 h后吸去培养基。样品组加入不同质量浓度(50、200、400μg/mL)的LPX3和LPG2。空白对照组加入等量的DMEM完全培养基,阳性对照组加入等量LPS(5μg/mL),每组6个平行。37℃孵育24 h,PBS清洗2次后加入100μL的质量分数0.1%中性红溶液。37℃孵育1 h后用PBS洗掉未吞噬的中性红。加入200μL细胞裂解液(乙醇和冰乙酸体积比为1∶1),4℃静置过夜,酶标仪测定540 nm处吸光度。计算公式如下:

式中:S为吞噬分数,%;A5组为不同质量浓度LPX3和LPG2组巨噬细胞加入中性红溶液处理后在540 nm处吸光度;A6为对照组巨噬细胞加入中性红溶液处理后在540 nm处吸光度。
1.2.6 巨噬细胞NO、IL-6和TNF-α分泌量的测定巨噬细胞NO、IL-6和TNF-α分泌量的测定参照文献[23-24],简述如下:调整细胞浓度至2×105个/mL,接种2.0 h后,吸去培养基。加入100μL DMEM完全培养基,37℃、体积分数5%CO2培养12 h,吸去培养基。样品组加入200μL相应质量浓度的LPX3和LPG2。空白对照组加入等量的DMEM培养基,阳性对照组加入等量LPS(5μg/mL),每组6个平行。37℃培养24 h后,培养液5 000 r/min离心5 min,上清液中IL-6和TNF-α的质量浓度用ELISA试剂盒检测。NO测定组每孔加入50μL的NO荧光探针。37℃孵育30.0 min后PBS清洗3次。荧光显微镜下观察并测定荧光强度,根据标准曲线计算NO分泌量。
1.3 数据统计分析
实验结果均表示为平均数±标准差。组间显著性分析采用SPSS 22.0软件,单因素分析法(ANOVA),Duncan检验,置信度为P<0.05。
2 结果与分析
2.1 LPX3和LPG2的纯化
从新鲜和干制龙眼果肉中分离纯化得到LPX3和LPG2两种多糖。LPX3和LPG2的串联凝胶柱色谱图如图1所示。结果显示,LPX3和LPG2均呈现单一对称的色谱峰且相对分子质量分布较窄,出峰时间分别为19.45 min和26.50 min,表明LPX3和LPG2具有较好的均一性。

图1 LPX3和LPG2的凝胶柱色谱图Fig.1 The gel column chromatogram of LPX3 and LPG2
2.2 LPX3和LPG2对肠系膜淋巴结细胞增殖的影响
由图2可知,与空白对照组相比,随着LPX3和LPG2质量浓度的增加(6.25~200μg/mL),肠系膜淋巴结细胞的增殖分数显著增加(P<0.05)。当LPX3和LPG2质量浓度为200μg/mL时,肠系膜淋巴结细胞的增殖分数分别为235.45%和227.60%,两者间无显著差异(P>0.05)。表明LPX3和LPG2均对小鼠肠系膜淋巴结细胞无毒性作用,且能促进其增殖。

图2 LPX3和LPG2对肠系膜淋巴结细胞增殖的影响Fig.2 Effects of LPX3 and LPG2 on the proliferation of mesenteric lymph node cells
2.3 LPX3和LPG2对巨噬细胞增殖的影响
由图3可知,与空白对照组相比,随着LPX3和LPG2质量浓度的增加(100~400μg/mL),巨噬细胞的增殖分数显著增加(P<0.05)。当质量浓度为100 μg/mL和200μg/mL时,LPX3和LPG2之间对巨噬细胞增殖的促进能力无显著差异(P>0.05)。当LPX3和LPG2质量浓度为400μg/mL时,巨噬细胞增殖分数分别为135.90%和143.70%,两者间存在显著差异(P<0.05)。结果表明,新鲜和干制龙眼多糖均对巨噬细胞无毒性作用,且具有促进其增殖的作用;在400μg/mL时,LPG2促进巨噬细胞增殖的能力更强。

图3 LPX3和LPG2对巨噬细胞增殖的影响Fig.3 Effects of LPX3 and LPG2 on the proliferation of macrophage
2.4 LPX3和LPG2对巨噬细胞吞噬能力的影响
如图4所示,与空白对照组相比,LPX3和LPG2随着质量浓度的增加(50~400μg/mL),巨噬细胞的吞噬分数显著增加(P<0.05)。在LPX3和LPG2质量浓度为400μg/mL时,吞噬分数分别为192.03%和198.28%,两者间无显著差异(P>0.05)。结果表明,LPX3和LPG2均能有效促进巨噬细胞吞噬抗原。巨噬细胞的活化在机体免疫应答过程中扮演着重要角色,吞噬能力的增强是其活化的标志之一。巨噬细胞通过吞噬清除受损细胞或外来抗原,诱导细胞分泌IL-1β、TNF-α等细胞因子调节机体免疫[25-26]。有报道显示龙眼多糖组分和硫酸化修饰的龙眼多糖组分能显著增强巨噬细胞的吞噬能力[16,27]。
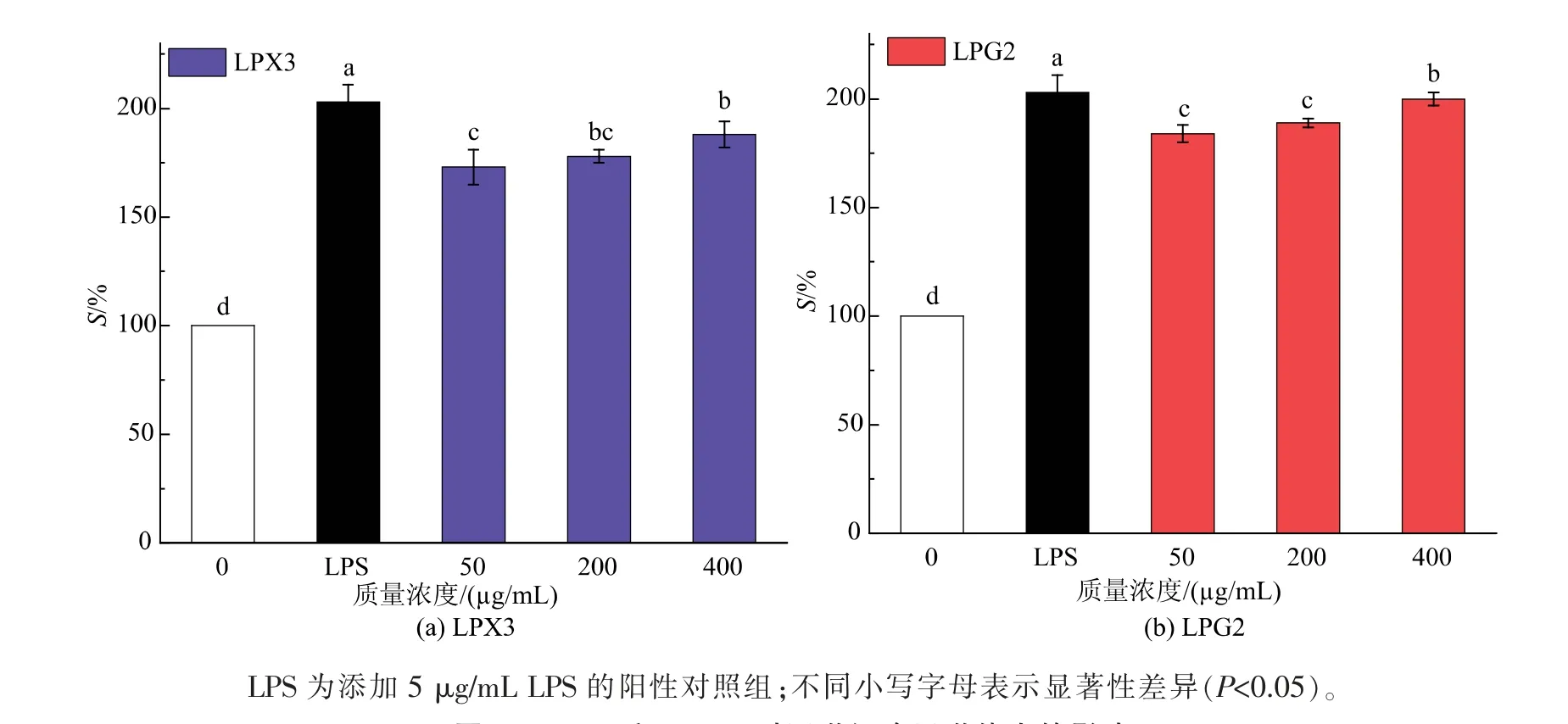
图4 LPX3和LPG2对巨噬细胞吞噬能力的影响Fig.4 Effects of LPX3 and LPG2 on macrophages phagocytosis
2.5 LPX3和LPG2对巨噬细胞分泌NO的影响
NO作为一种重要的细胞信号分子,广泛参与细胞和机体的免疫调节[28-29]。如图5所示,与空白对照组相比,NO分泌量随着LPX3质量浓度的增加而显著增加(P<0.05)。LPG2在25~200μg/mL范围内,能显著促进NO分泌(P<0.05)。当LPX3和LPG2的质量浓度均为200μg/mL时,NO分泌量分别为空白对照组的5.4倍和5.6倍,两者间无显著差异(P>0.05)。结果表明,25~200μg/mL的LPX3和LPG2引起了细胞促炎信号分子NO分泌量的显著改变,可能诱导了巨噬细胞相关信号通路的激活。同时,研究显示[30]炎症因子的过度释放会诱导机体的炎症因子风暴,对机体造成损伤,LPX3和LPG2促进巨噬细胞分泌NO的活性有待进一步研究。
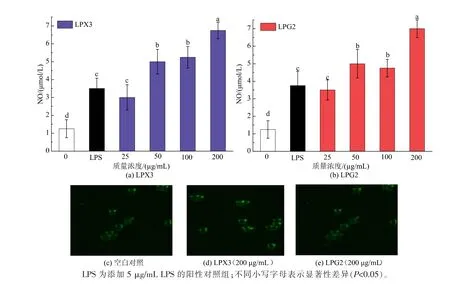
图5 LPX3和LPG2对巨噬细胞分泌NO的影响Fig.5 Effects of LPX3 and LPG2 on NO secretion by macrophages
2.6 LPX3和LPG2对巨噬细胞分泌细胞因子的影响
如图6所示,与空白对照组相比,LPX3和LPG2(25~400μg/mL)可诱导巨噬细胞分泌IL-6和TNF-α,并呈现出一定剂量关系。当质量浓度为400μg/mL时,TNF-α的分泌量分别为空白对照组的17.67倍(296.20 pg/mL)和31.54倍(528.65 pg/mL),两者具有显著性差异(P<0.05);IL-6的分泌量分别为空白对照组的18.42倍(73.69 pg/mL)和27.31倍(109.22 pg/mL),两者具有显著性差异(P<0.05)。结果表明,LPX3和LPG2均能显著促进巨噬细胞分泌TNF-α和IL-6。当质量浓度为400μg/mL时,LPG2促进巨噬细胞分泌IL-6和TNF-α的能力更强。IL-6和TNF-α在宿主防御病原体和急性应激中起着关键作用[31]。巨噬细胞IL-6和TNF-α分泌量的增加可能与细胞的激活和防御有一定关系。
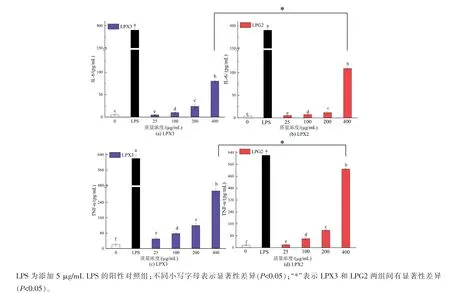
图6 LPX3和LPG2对巨噬细胞分泌IL-6、TNF-α的影响Fig.6 Effects of LPX3 and LPG2 on the secretion of IL-6 and TNF-αby macrophages
3 结 语
作者采用小鼠肠系膜淋巴结细胞和巨噬细胞模型,比较了LPX3和LPG2诱导细胞增殖和细胞因子分泌的活性。结果表明,LPX3和LPG2均能促进小鼠肠系膜淋巴结细胞增殖和激活巨噬细胞,且具有剂量依赖性的促进巨噬细胞吞噬和诱导细胞分泌IL-6、TNF-α。同时,与LPX3相比,LPG2表现出更强的激活巨噬细胞的活性。
多糖的生物活性与其结构密切相关,新鲜和干制龙眼果肉多糖的分子结构差异及其激活巨噬细胞的分子机制差异还有待进一步研究。

