不同非洲猪瘟病毒荧光PCR 检测试剂盒在检测猪肉及猪肉制品中的比较
韦 莹,陈丽芸,刘 闯,陈立军
(南宁海关技术中心,广西南宁 530021)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种急性、出血性、烈性传染病。世界动物卫生组织(OIE)将其列为须通报动物疫病。该病也是我国重点防范的一类动物疫病。目前国内外ASF 疫情防控形势复杂多变[1]。ASF 在我国暴发以来,海关系统迅速反应,对边境口岸截获的猪肉及猪肉制品实行100% ASFV 核酸检测,旨在有效监控和防控病毒传播[2]。商品化检测试剂盒因其便捷性在实验室ASFV 快速检测中被广泛应用[3]。本试验拟通过实时荧光PCR 反应,对国内外不同厂家生产的6 种ASFV 检测试剂盒性能进行比较,从而进一步了解不同生产厂家试剂对试验结果的影响,以期为同行今后开展ASFV 核酸检测提供参考。
1 材料
1.1 样品
参考OIE 推荐的ASFV 荧光定量PCR 方法[4]合成引物和探针,对口岸截获的不同类型猪肉及猪肉制品进行检测。这些猪肉及猪肉制品经多次验证确定为ASFV 强阳性、中阳性及弱阳性样本,即为本试验样本。将检测Ct 值稳定在18~21 的样品划定为强阳性样本,Ct 值稳定在27~30 的样品划定为中阳性样本,Ct 值稳定在32~35 的样品划定为弱阳性样本。将这些不同类型的样本充分均质确保均一性。用全自动核酸提取仪,对不同样本进行核酸提取。最终获得较为稳定的强阳性、中阳性及弱阳性3 种ASFV 阳性核酸样本。另1 份不同于上述强阳性、中阳性、弱阳性样品的ASFV 阳性核酸,由本实验室之前保存备用。
1.2 试剂
6 种ASFV 荧光PCR 检测试剂盒分别购自国内外不同生产厂家,均在效期内。其中国产试剂盒4 种,均选自农业农村部公布的ASFV 现场快速检测试剂名单,另外2 种为国外试剂盒。根据试剂盒产地分别将试剂盒编号为A(美国)、B(法国)、C—F(国产)。不同试剂盒适用样品范围、反应体系、扩增程序、反应时长、结果判定均各有特点,详情见表1~3。其中,4 种国产试剂盒已经过中国动物疫病预防控制中心比对评价,结果如表4。

表1 不同试剂盒适用样品范围
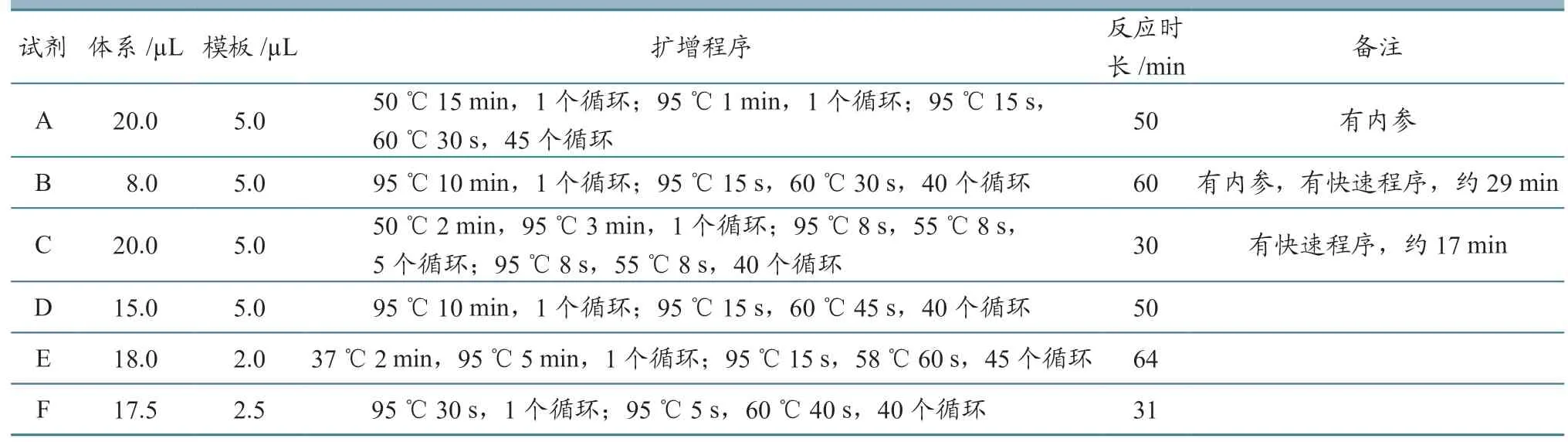
表2 不同试剂盒反应体系及时长
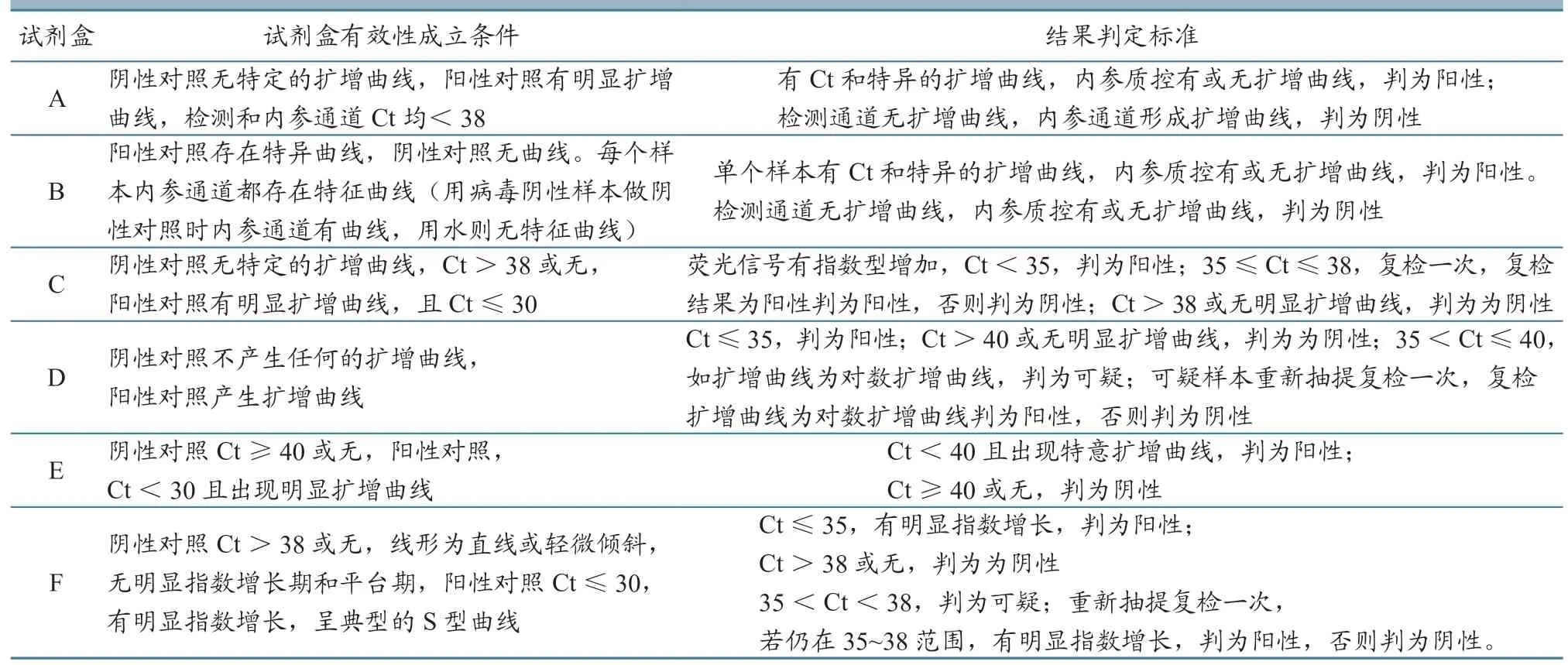
表3 不同试剂盒结果判定标准

表4 4 种国产试剂盒经中国动物疫病预防控制中心比对评价结果[6] %
1.3 仪器设备
核酸提取仪,购自西安天隆科技有限公司;高速冷冻离心机,购自长沙湘仪检测设备有限公司;冷冻研磨仪,购自上海净信实业发展有限公司;数显恒温水箱,购自常州普天仪器制造有限公司;荧光定量PCR 仪,购自美国应用生物系统(ABI)公司。
2 方法
2.1 样品性能验证
以OIE 推荐的ASFV 荧光定量PCR 方法合成引物和探针,对获得的ASFV 阳性核酸样本再次验证,发现Ct 值大小与预期相符。为验证模板DNA稳定性,4 名实验员(G—J)分别随机以抽提好的不同类型ASFV 阳性模板和阴性对照上机验证。验证结果如表5,上机曲线如图1。Ct 值大小与预期相符。
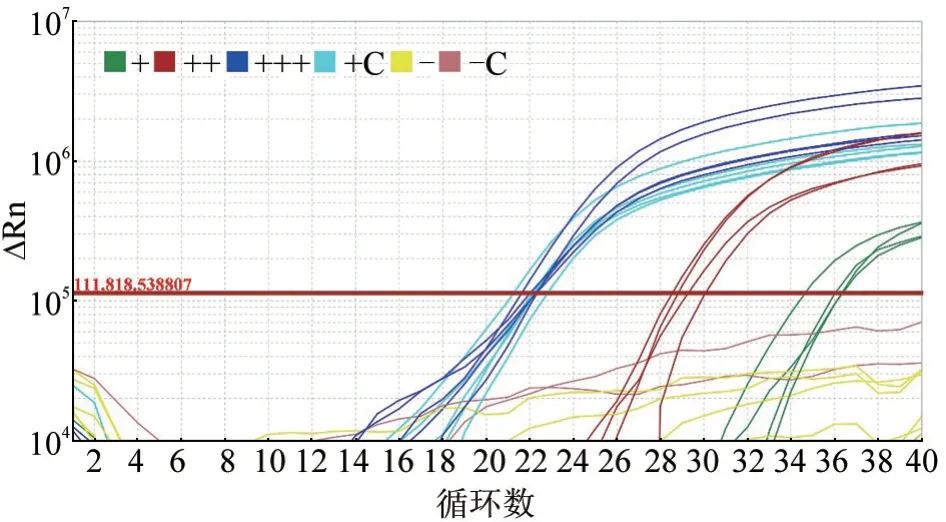
图1 不同类型ASFV 阳性模板验证结果
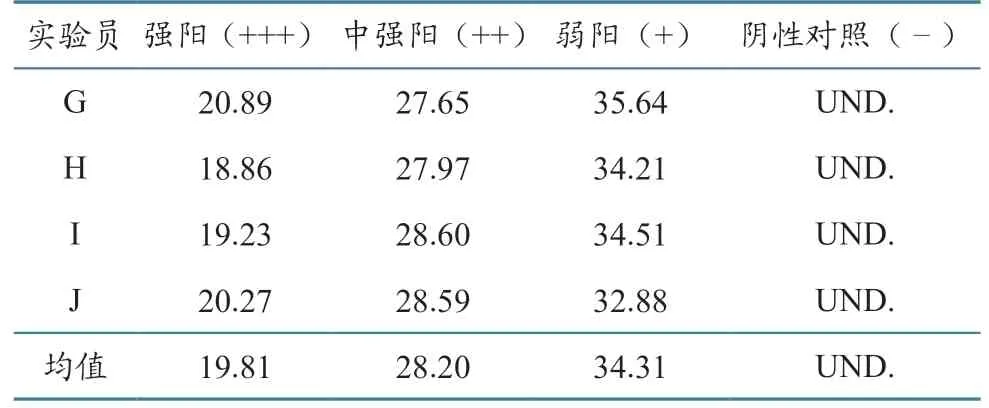
表5 3 类不同强度ASFV 阳性核酸由不同实验员验证结果(Ct 值)
2.2 荧光定量PCR 检测
以实验室留存的1 份ASFV 阳性核酸分别验证6 种试剂盒稳定性,每个试剂盒做6 个平行孔。然后以强阳性、中阳性及弱阳性3 种ASFV 核酸样品分别验证试剂盒检测情况,再将弱阳性核酸样品按1:2、1:4、1:8 稀释,设置平行孔,进一步验证试剂盒敏感性。按每个检测试剂盒说明书标识的反应体系配制反应液,并分别加入已提取的模板DNA,同时设置试剂盒阴阳性对照和空白对照。使用荧光定量PCR 仪进行扩增,各试剂盒反应程序按说明书要求设定。
2.3 数据分析
观察不同试剂盒扩增情况,分析不同试剂盒对相同核酸样品以及强阳性、中阳性及弱阳性3 种ASFV 核酸样品检测Ct 值差异。
3 结果与分析
荧光PCR 试验结果均经仪器自动分析获得。各试剂盒阴阳性对照均符合说明书标示范围,试验阴阳性质控符合要求,有效性成立。
3.1 稳定性试验
如图2 所示,使用不同试剂盒对同1 份ASFV阳性核酸样本进行6 个平行孔扩增,得到的扩增曲线轮廓大致相同,表明所用的6 种试剂盒(A—F)重复性均较好。此外,6 种试剂盒检测Ct 值统计结果(表6)显示,虽然不同试剂盒检测Ct 值均值存在差异,但同一试剂盒在重复(6 个平行孔)检测同1 份样品时Ct 值差异较小。这同样说明此6 种试剂盒扩增稳定性良好。其中D 试剂盒标准差最小,样品间差异最小。
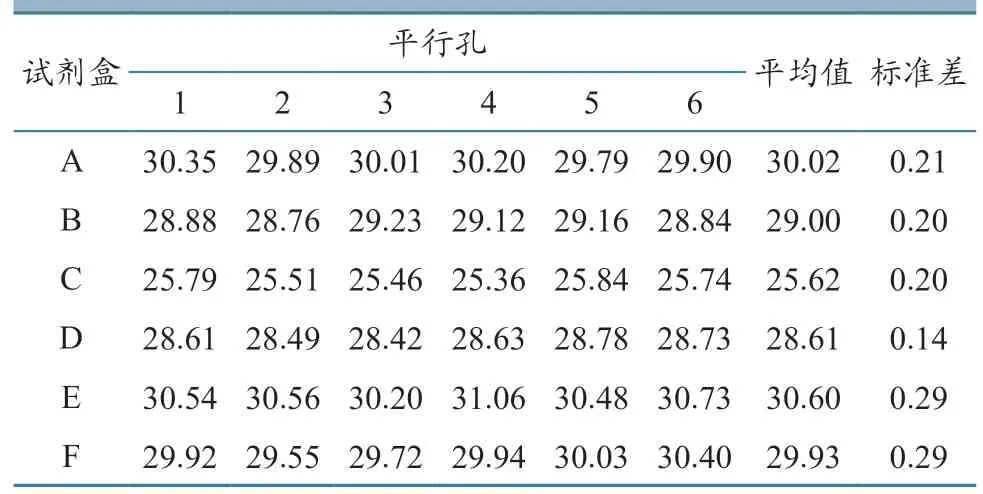
表6 相同阳性核酸不同试剂盒检测Ct 值
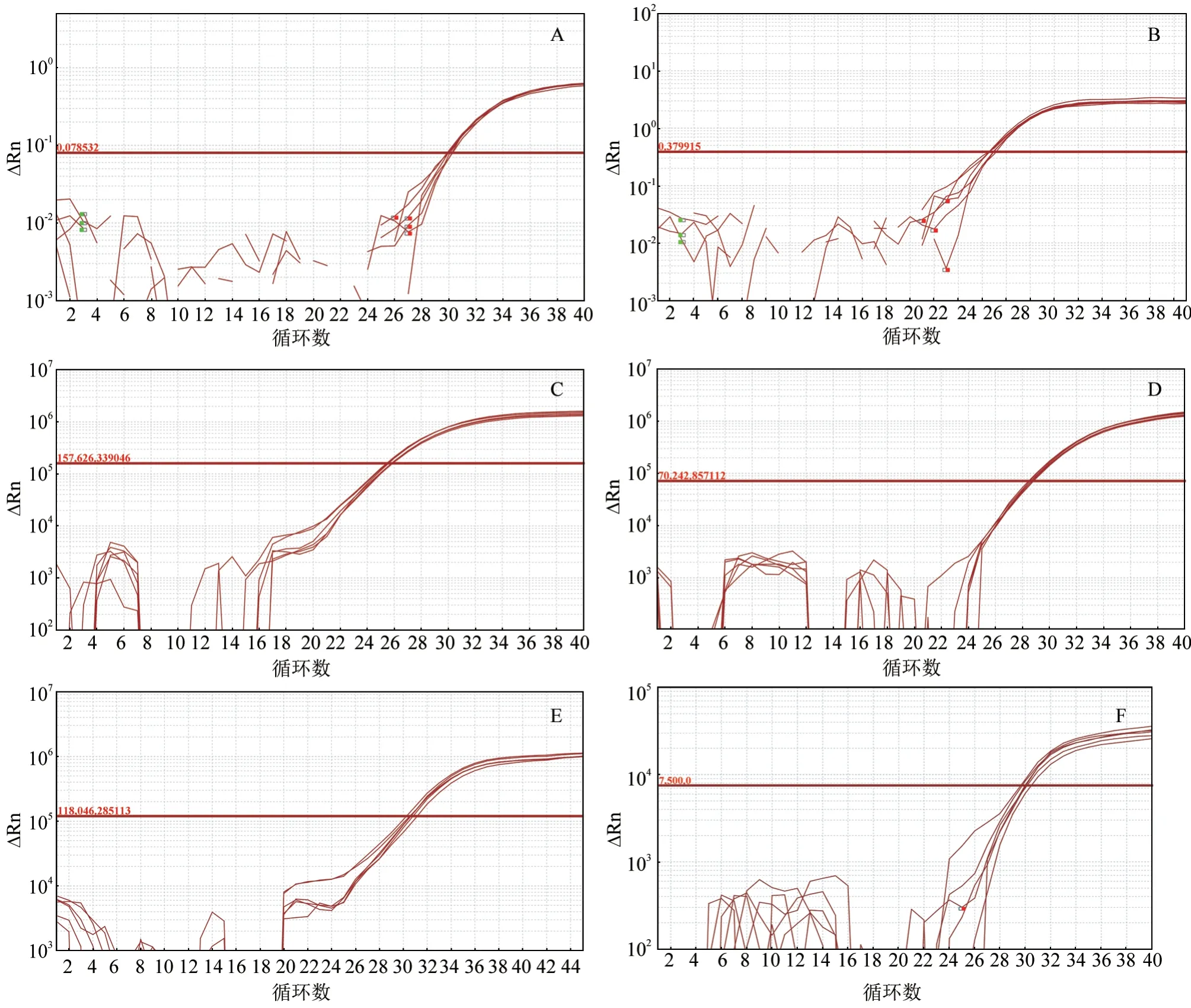
图2 6 种试剂盒稳定性试验结果
3.2 敏感性试验
以强阳性、中阳性及弱阳性3 种ASFV 样品分别验证试剂盒检测情况。结果(图3)显示,不同试剂盒扩增不同强弱的ASFV 核酸样品得到的扩增曲线轮廓大致相同,扩增曲线均呈现对数增长后趋于平稳。但不同试剂盒扩增曲线呈现不同特征,即对数期出现的时间和对数增长曲线的斜率不同。其中F 试剂盒仅对强阳性样本有扩增曲线。就本次试验扩增情况而言,A—E 试剂盒结果较为理想。
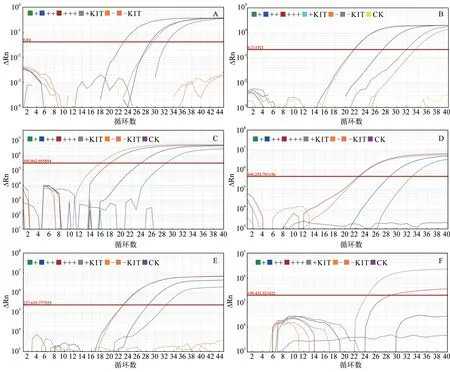
图3 不同试剂盒对不同强弱ASFV 核酸样品扩增结果
Ct 值统计结果(表7)显示:对于强阳性样品,所有试剂盒均可检出,检测Ct 值为17.93~28.86,平均值为22.81;对于中强阳性样品,Ct 值为23.86~28.85,均值为27.38;对于弱阳性样品,Ct值为28.77~32.95,均值为31.87。F 试剂盒仅成功检出强阳性样品,对中阳性和弱阳性样品均未检出,且强阳性样品检测Ct 值为28.86,与其他试剂盒差异极显著(P<0.01)。E、F 试剂盒模板加入量差异最小,分别为2、2.5 µL,但对不同强弱的阳性样本试验结果差异明显。A、B、D 试剂盒模板加入量均为5 µL,对不同强弱的阳性样本试验结果数值接近,这3 种试剂盒检测Ct 值与OIE推荐的ASFV 荧光定量PCR 方法检测Ct 值(表5)在中阳性、弱阳性样本的检测中无显著差异(P>0.05)。C 试剂盒模板加入量也为5 µL,对不同强弱的阳性样本检测Ct 值在本次比对试验中最小,其对强阳性、中阳性、弱阳性样品检测Ct 值分别为17.93、23.86、28.77,均小于OIE 推荐的ASFV荧光定量PCR 方法。由此可见,不同试剂盒的敏感性存在不同差异。
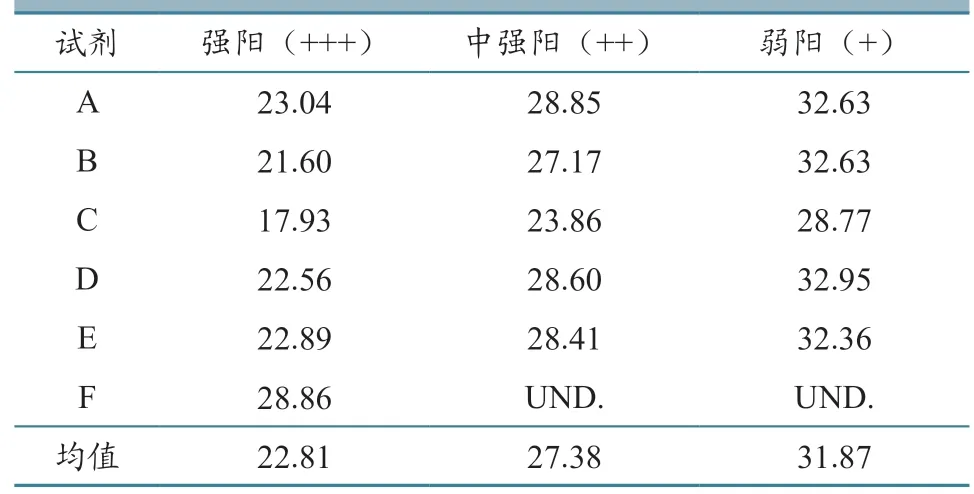
表7 不同试剂盒对不同强弱ASFV 核酸样品检测Ct 值
将弱阳性核酸样品按1:2、1:4、1:8 进行梯度稀释,设置2 个平行孔,进一步验证不同试剂盒的敏感性。结果(表8)显示,除了F 试剂盒,其他试剂盒均能检出稀释后的ASFV 弱阳性样本。
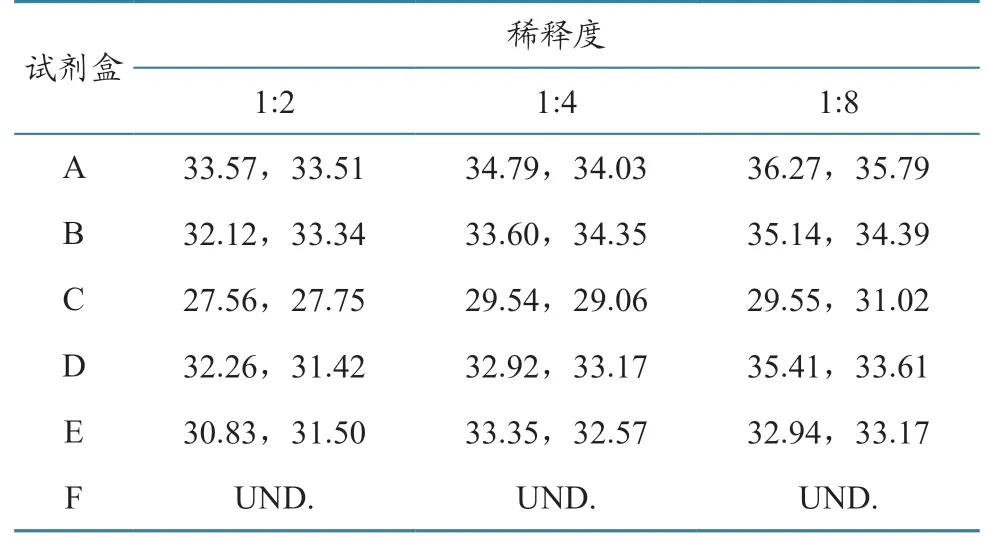
表8 不同试剂盒在不同稀释度下对弱阳性ASFV 核酸检测Ct 值
4 讨论
通过试验比对,发现大部分试剂盒均能较好检测出猪肉及猪肉制品中不同强弱ASFV 阳性核酸样本,能满足实验室检测基本需求。本次试验使用的不同强弱ASFV 阳性DNA 模板来自口岸截获的猪肉及猪肉制品混样,且样品灭活后经过多轮试验验证。试验发现,F 试剂盒虽然扩增时间较短,理论反应时间仅31 min,但不能检出本次试验的中阳性和弱阳性样本,随后经实验室再次验证,该批次试剂盒依旧未能检出中阳性和弱阳性样本。本试验中,将检测Ct 值稳定在27~30 的混合样本划定为中阳性样本,F 试剂盒检测结果呈阴性,但在使用另1 份实验室留存的ASFV 阳性核酸验证F试剂盒稳定性时,该试剂盒6 个平行孔均检出样品Ct 值,且均值为29.93(表6)。这可能与该批次试剂盒相关试剂质量或试剂盒本身引物/探针的兼容性和敏感性有关[5],也可能是混合阳性模板中某些物质的存在导致该试剂盒引物对目的基因序列无法准确识别,从而抑制基因扩增。由此可见,技术性验收在使用试剂盒前非常必要,有条件的应以弱阳性样本开展技术验证,避免因试剂问题导致的假阴性结果。
就本次扩增情况而言,A—E 试剂盒均可用于实验室ASFV 日常检测。可根据样本类型和实验室检测需求进行选择。A、B 为进口试剂盒,检测结果稳定,且可同时扩增病毒DNA 和猪内参基因。检测内参基因既可验证被检测样本猪源细胞的存在,辨别样本处理和提取是否存在问题,同时可验证荧光PCR 扩增过程中抑制因子存在与否。实际工作中如果对实验室质控要求较高,可以考虑选择这些进口试剂盒。C 试剂盒对3 种强弱的ASFV 阳性样本检测Ct 值都低于理论值和其他试剂盒检测均值,究其原因可能与试剂盒反应液中相关酶扩增效率和离子含量和活性有关,其在相同浓度DNA模板情况下扩增效率最高。该试剂盒理论反应时间较短,在仪器允许条件下可以设置快速程序。如果想以最快速度得到定性检测结果可以选择该试剂盒,但是其多次验证比对样本的Ct 值均低于理论值,所以不能单凭该试剂盒检测结果判定检测样本中实际模板浓度大小,同时,也要注意预防假阳性结果。在实际检测工作中,ASFV 样本的定性检测需要在实验室质量控制条件下多试剂盒比对或多方法比对,才能较为准确地给出判定结果。

