宁夏银北不同草田轮作模式对细菌群落组成特征的影响
王 静 程昱润 肖国举 毕江涛 张峰举 许 兴
(1.宁夏大学生态环境学院, 银川 750021; 2.宁夏大学农学院, 银川 750021)
0 引言
土壤盐碱化和次生盐碱化是土壤退化的主要形式,也是生态环境恶化的一种现象。由于土壤质量差,导致作物产量低,这已成为土壤退化中的世界难题[1]。宁夏银北地区盐碱地是我国受到土壤次生盐碱化危害的重点区域,土壤盐碱化已成为影响宁夏地区农业生产发展的重要因素。该地区由于粮食作物连作方式及化肥施用的不合理,致使土壤有机质含量降低,造成作物产量降低,从而影响了区域内农业生态系统的可持续发展。草田轮作是提高农业土壤质量的栽培耕作方式之一。国内外生产实践证明,通过合理的草田轮作可以增加作物种类、增强土壤微生物活性、增加土壤微生物群落与种群的多样性,从而有效提升盐碱化土壤环境质量,缓解连作引起的连作障碍[2-3]。土壤微生物是农业土壤生态系统的重要组成部分,几乎参与土壤中的一切生物及生物化学反应[4],在农业生态系统物质能量转化过程中起到重要作用,其群落结构和多样性主要受植物物种组成和土壤养分状况的影响。细菌是土壤微生物中分布最广、数量最多的部分,占土壤微生物总数的70%~90%,是土壤养分变化的敏感指标之一。近年来,微生物群落组成及多样性成为解释植物-微生物互作机制的热点问题。不同轮作模式对土壤微生物的影响不尽相同,合理的轮作模式对促进当地农业发展具有重要作用。农田管理(例如,肥料或杀菌剂的应用,周期性灌水和作物轮作等)、植物、土壤类型、地理距离等在很大程度上决定着细菌群落变化[5-7]。轮作可以提高作物产量、抑制土壤疾病的发生[8-9],也能引起微生物群落的变化[10],因为不同的物种分泌不同类型的根系分泌物,从而塑造土壤细菌群落结构[7]。不同轮作系统间群落组成、丰度和多样性存在显著差异[8]。了解土壤微生物群落及应对不同土地利用方式和管理系统,对选择适宜的农田管理措施、改善生态系统服务和土壤功能具有重要作用[11-12]。科学合理的轮作模式可以有效缓解因不合理的农作物搭配、耕作方式及施肥等管理措施而引起的土壤环境恶化,增强土壤微生物活性和多样性,为后续农作物生长提供健康稳定的土壤生态环境。已有研究表明,农业生产中不适宜的轮作、间作和长期的连作易引起土壤可培养细菌数量的显著下降、土壤微生物多样性的丧失以及群落结构的明显改变[13]。土壤微生物群落结构的变化会进一步影响土壤团粒结构、有效养分等理化性质以及土壤酶活性特征,进而改变农业土壤生态系统的养分循环,这不利于后续农作物的健康生长。然而,目前对这些变化机理和影响的研究相对较少[14-15]。
目前,关于紫花苜蓿草田轮作的研究报道相对较多,但大多集中在轮作对农田土壤肥力及产量的影响方面,缺乏紫花苜蓿-作物轮作系统中土壤微生物群落特征的研究,尤其是盐碱地土壤微生物群落特征。本研究针对宁夏银北盐碱地固有不良属性和该区域种植模式单一等突出问题,选择宁夏银北5种草田轮作模式,利用IlluminaHiSeq高通量测序技术,明确不同轮作模式对盐碱化土壤细菌群落多样性及组成特征的影响,阐明不同草田轮作模式下盐碱化土壤细菌群落组成差异及其与土壤环境因子盐分、pH值、养分、酶活性等的相互关系,以期为盐碱化区域土壤改良与优化种植制度提供科学支撑。
1 材料与方法
1.1 研究区概况
试验区位于宁夏回族自治区石嘴山市平罗县西大滩核心试验站,地处宁夏回族自治区银川北部平原引黄灌区,西临贺兰山东麓,东接黄河冲积平原,属于黄河中上游灌溉地区(38°45′~38°55′N,106°13′~106°26′E),是我国龟裂碱土集中分布的典型区域,属典型的温带大陆性气候。年降水量为150~205 mm,年蒸发量2 000 mm以上,年平均气温为9.5℃,大于等于0℃积温在3 350℃·d以上。一般地下水埋深1.5 m左右,地下水主要含硫酸盐、氯化物,并且普遍含有碳酸氢钠[14]。研究区土壤为典型的龟裂碱土,根据宁夏回族自治区土壤及中华人民共和国土壤分类体系[16],宁夏银北西大滩是我国龟裂碱土的典型代表,试验区龟裂碱土土层0~40 cm容重1.59 g/cm,黏粒(粒径小于2 μm)、砂粒(粒径大于50 μm)和粉粒(粒径为2~50 μm)质量分数分别为40.45%、27.05%和32.50%,为壤质粘土,基本理化性质见表1。

表1 试验区土壤基本理化性质
1.2 试验设计
在宁夏银北西大滩核心试验站,选择一块已种植4年的紫花苜蓿草地作为试验样地,2014年秋季收获后,将部分面积的苜蓿草地翻耕,并均分为4份,分别种植油葵(HelianthusannuusL.)、甜高粱(Sorghumdochna)、饲料玉米(Zeamays)(分别表示为O、S、C)及未种植作物,苜蓿表示为A,设置为苜蓿-油葵-油葵处理(AO),苜蓿-甜高粱-甜高粱处理(AS),苜蓿-饲料玉米-饲料玉米处理(AC),翻耕未种植作物地为苜蓿-休闲处理(AF),未被翻耕继续保持生长的苜蓿地作为苜蓿连作处理(AA)。油葵、甜高粱、饲料玉米分别于2014年5月2日、5月3日和5月4日播种,9月10日、9月20日、9月28日收获,次年在相同时间种植和收获,所有处理均不施肥,同时设每3个小区作为3次重复,共设置15个小区,每个小区面积30 m2(6 m×5 m),小区间距1 m,保护行宽3 m。试验采用随机区组设计,采用人工精量点播的方式播种,播种量7.5 kg/hm2,行距45 cm,株距25 cm。播种后及时覆膜,以保证出苗率,待幼苗顶土后去膜。试验期间的灌水、中耕除草及病虫害防治等均与当地大田管理方式一致。
1.3 土壤采样
在作物收获前采集耕层土壤,先用环刀法在剖面从上至下采集土样,每个处理3个重复,其余土样除去残根和石块,按照取样土层分装入自封袋,同时在自封带上注明采样日期、采样深度及土壤作物轮作顺序,样品带回实验室后,风干待测土壤化学指标;土壤微生物的采集,采用抖根法收集耕层土,将根际土壤抖至50 mL离心管中,并迅速置于冰盒中,带回实验室封存在-20℃冰箱中待测微生物;土壤容重、含水率均在现场取样测定,每个处理重复3次。
1.4 测定项目与方法
1.4.1土壤样品的理化性质测定
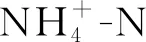
1.4.2土壤DNA提取
按照MoBio(Power Soil DNA IslationKit,MoBio,美国)说明书提示的操作步骤提取土壤总DNA,DNA提取完成后,经1%琼脂糖凝胶电泳测定DNA完整性、Mini Drop测定DNA纯度和浓度。将每个样地的15份DNA样品随机取3份等量混匀,分别制成3个平行样本,于-20℃保存、备用。
1.4.3细菌16S rDNA基因高通量测序
DNA提取完成后,进行PCR扩增及测序。细菌序列的测定采用CAPORASO等[19]的方法,扩增细菌16S rDNA V4区段,引物为515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。DNA扩增参照MAGO等[20]的方法,扩增条件为98℃预变性10 s,50℃退火30 s,72℃延伸60 s,30个循环,72℃延伸5 min。每个样品3个重复。获得扩增产物后,进一步通过2%琼脂糖凝胶电泳检测PCR产物纯化效果,测定纯化后PCR产物的浓度。高通量测序由诺禾致源Illumina MiSeq 2500平台运行(http:∥www.novogene.com/index.php)。
1.4.4DNA数据分析
所测得原始序列截去Barcode序列和引物序列后,经Flash(V1.2.7)拼接获得原始Tags数据。原始Tags经QIIME(V1.7.0,质控参数为QIIME默认值,参照http:∥qiime.org/scripts/split_libraries.html)过滤处理获得高质量Tags数据(Clean Tags),并与数据库(Gold database,http:∥drive5.com/uchime/uchime_download.html)进行比对(UCHIME Algorithm,http:∥www.drive5.com/usearch/manual/uchime_algo.html)检测嵌合体序列,最终获得有效数据(Effective Tags)。测序深度为每个文库原始reads数不少于4万条。然后以97%相似性为依据,利用UPARSE pipeline软件(V7.0.1001)将各序列聚类成为OTUs。为获得土壤样品中微生物物种的多样性信息,使用uclust软件对所得序列进行聚类,并利用RDP classifier(V2.2)软件与GreenGene数据库(http:∥greengenes.lbl.gov/cgi-nph-index.cgi)进行物种注释,统计每个样品在各分类水平上的构成。
利用QIIME(V1.8.0)计算香农-威纳指数,表示土壤样品微生物群落α多样性。相关性分析采用SPSS 19.0软件处理,利用OriginPro 8软件制图。
1.5 数据计算与分析
获得原始数据后,利用QIIME(V1.8.0)软件进行分析,包括OTUs的提取、交叠分析、聚类分析和alpha多样性分析、Beta多样性分析等。alpha多样性指数中,Chao-1和Observed species为菌群丰度指数,Chao-1指数计算公式为
(1)
式中Sobs——观察到的物种数
n1——观察到的Singletons的种类数
n2——观察到的Doubletons的种类数
Shannon指数为菌群多样性指数,计算公式为
(2)
式中H′——Shannon指数
R——样品中物种的种类数
Pi——第i个物种所占百分比
Simpson指数反映一个种群的优势度,计算公式为
(3)
采用Excel 2007软件整理数据,然后用SPSS 19.0软件进行单因素方差分析,对同一土层不同轮作模式土壤细菌组成和结构进行方差分析,通过典范对应(CCA)分析5种轮作模式下土壤细菌在属水平的相对丰度特征。
2 结果与分析
2.1 不同草田轮作模式对土壤理化性质的影响
土壤主要理化性质(表1)分析表明,所选样地原始土壤中含盐量为3.5 g/kg,pH值为9.0~10.5,碱化度为42.1%,具有盐碱地的典型特征。全磷质量比平均在0.69 g/kg左右,全氮质量比在0.76 g/kg左右,土壤较为贫瘠,孔隙度差异较大。从不同草田轮作模式对土壤样品的基本理化参数影响来看,各轮作模式下土壤样品的速效钾含量在AS、AC模式中最高,差异显著(P<0.05),pH值在AO模式中降低最显著,差异显著(P<0.05),过氧化氢酶含量在AC模式中最高,差异显著(P<0.05)(表2)。
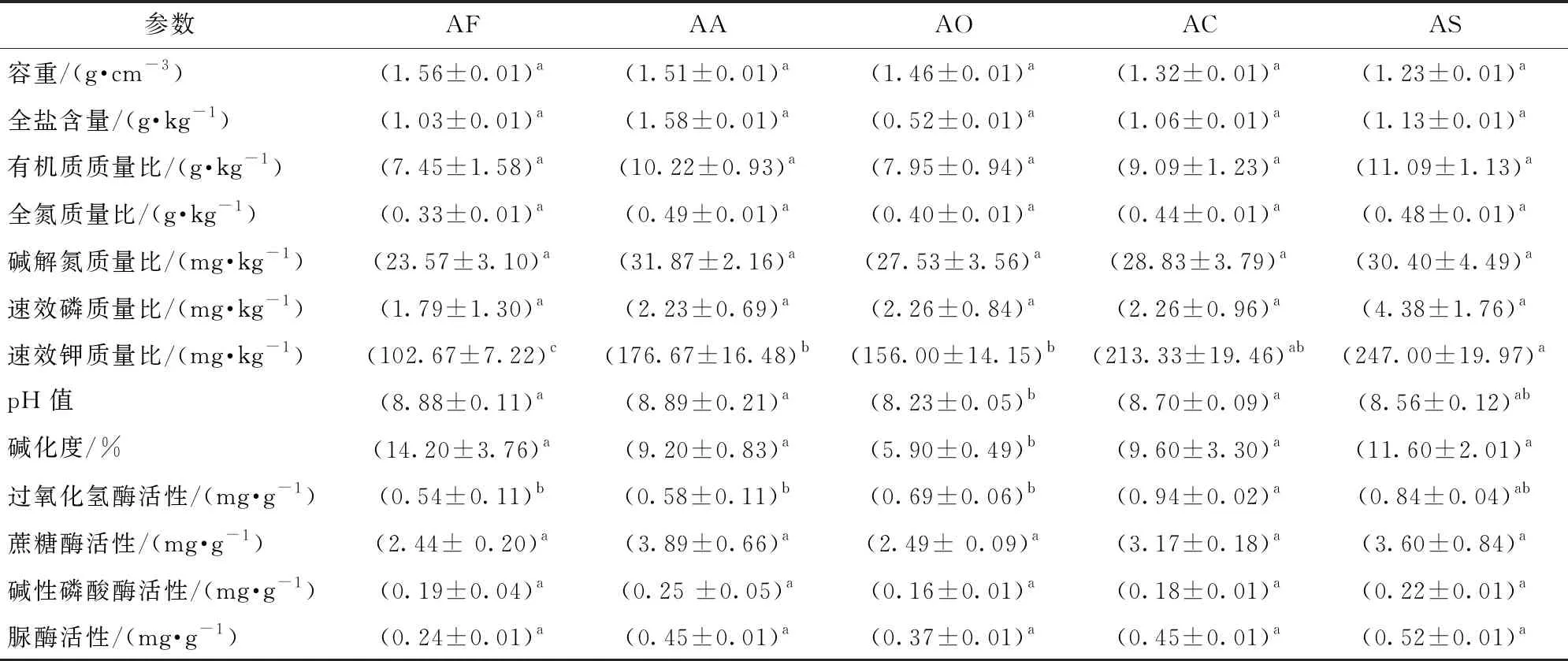
表2 不同轮作处理条件下的土壤理化性质
2.2 OTU丰度在门水平的变化
5种轮作模式的细菌16S rDNA V4区的Illumina测序共获得高质量序列15 791~925 409,有效序列50 504~67 549,然后对原始数据拼接,按相似度97%进行聚类分析得到不同轮作模式共有和特有OTUs(图1)。其中共有2 688个微生物物种(OUTs),AF模式特有物种224个,AA模式特有物种175个,AO模式特有物种160个,AC模式特有物种276个,AS模式特有物种170个。
对不同轮作模式草田土壤微生物群落组成和结构进行研究,得到每个样品在门分类水平(Phylum)上最大丰度排名前10位的物种,生成物种相对丰度柱形累加图(图2),从图中可以看出,不同草田轮作模式土壤样本中检测出10个门,分属变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)、浮霉菌门(Planctomycetes)、热微菌门(Thermomicrobia),其中还有未知菌门。优势菌门依次为变形菌门(34.49%)、放线菌门(17.02%)、酸杆菌门(10.96%)、未知菌门(10.57%)、芽单胞菌门(7.62%)、拟杆菌门(4.35%)、厚壁菌门(4.33%);优势属为节杆菌属(Arthrobacter)、拟杆菌属(Bacteroides)、产粪菌属(Faecalibacterium)、鞘氨醇单胞菌属(Sphingomonas)、Gaiella、诺卡氏菌属(Nocardioides)、Subdoligranulum、斯科曼氏球菌属(Skermanella)、Steroidobacter、热单胞菌属(Thermomonas);优势种为耐冷节杆菌(Arthrobactercryotolerans)。
2.3 不同草田轮作模式土壤细菌群落在属水平的丰度变化
基于每种模式中物种的丰度水平,筛选主要菌群进行菌群分类地位聚类(横向聚类)及样本聚类(纵向聚类),利用不同颜色表示主要菌群的相对丰度水平,绘制成热图(图3,一个样品在某个分类上的Z值为样品在该分类上的相对丰度和所有样品在该分类的平均相对丰度的差除以所有样品在该分类上的标准差所得到的值),从图中可以看出,5种不同轮作模式所聚集较多的物种均不同,AF模式为红色杆菌属(Rubrobacter)和Opitutus,AA模式聚集较多的为拟杆菌属和Subdoligranulum,AO模式聚集较多的是芽单胞菌属,AC模式聚集较多的是热单胞菌属和盐单胞菌属(Halomonas),AS模式聚集较多的是假单胞菌属(Pseudomonas)。
2.4 α多样性指数
不同草田轮作模式土壤细菌群落多样性指数Shannon、Simpson和丰富度指数Chao-1、ACE如表3所示,AS模式土壤的Shannon和Simpson指数显著低于其他模式(P<0.05),Chao-1指数变化趋势与Shannon指数基本一致。不同草田轮作模式土壤微生物群落α-多样性由大到小依次为AF、AA、AO、AC、AS,苜蓿休闲模式土壤微生物群落多样性相对较高,AS模式土壤微生物群落多样性相对较低。

表3 不同草田轮作模式土壤样品alpha多样性分析
2.5 不同草田轮作模式土壤细菌群落结构主成分分析
对不同草田轮作模式盐碱地土壤细菌群落结构进行主成分分析,主成分特征值及方差贡献率如图4所示,经主成分分析发现,草田轮作模式AF、AC与其他处理结构差异较大。
2.6 不同草田轮作模式细菌群落与环境因子的关系
为了研究不同草田轮作模式细菌群落与环境因子的关系,利用Spearman秩相关来研究12个环境因子与微生物物种丰富度(alpha多样性)之间的相互变化关系,得到两两之间的相关性和显著性P值,从图5(图中*表示差异显著(P<0.05),**表示差异极显著(P<0.01))可以看出,土壤速效钾、过氧化氢酶对土壤微生物群落结构具有重要作用,其中过氧化氢酶和速效钾分别与Gaiella呈极显著相关(P<0.01),与鞘氨醇单胞菌属(Sphingomonas)显著相关(P<0.05);过氧化氢酶和pH值分别与嗜盐囊菌属(Haliangium)呈显著相关(P<0.05),且过氧化氢酶与新鞘氨醇杆菌属呈显著相关(P<0.05),速效钾与Ramlibater和Opitutus呈显著相关(P<0.05)。
通过典范对应分析(Canonical correspondence analysis, CCA)5种轮作模式下土壤细菌在属水平的相对丰度特征发现(图6),AO模式下芽单胞菌门、疣微菌门的相对丰度较其他轮作模式显著升高(P<0.05)。在属水平上,过氧化氢酶和速效钾分别与Gaiella呈极显著相关(P<0.01),与鞘氨醇单胞菌属(Sphingomonas)显著相关(P<0.05);过氧化氢酶和pH值分别与嗜盐囊菌属(Haliangium)呈显著相关(P<0.05),且过氧化氢酶与新鞘氨醇杆菌属呈显著相关(P<0.05),速效钾与Ramlibater和Opitutus呈显著相关(P<0.05)。进一步结合土壤理化指标和微生物活性指标分析说明,AO轮作模式的过氧化氢酶活性最强,pH值降低最为显著,这与AO轮作模式中嗜盐囊菌属(Haliangium)多样性显著提高有关,说明AO轮作模式较其他模式显著改善了土壤微生态环境,增加了微生物群落多样性。
3 讨论
土壤细菌作为土壤中最重要的活性组分,不同轮作模式中各作物对土壤细菌多样性的影响不同[21]。本研究采用高通量测序技术对宁夏银北地区不同草田轮作模式下盐碱化土壤细菌群落组成特征及其影响因子进行了分析,发现后茬作物对土壤细菌群落结构有明显的影响。其他学者也发现了类似规律,如尹国丽等[22]进行了不同草田轮作模式对土壤细菌群落组成特征的研究结果也与本研究相似。通过本研究可以发现,AS模式土壤的细菌多样性显著低于其他模式,可能是由于此轮作模式下种植密度大,扰动土壤生境频繁,导致土壤微生物群落环境不稳定,致使一些特定环境的微生物失去活性。AO模式下芽单胞菌门、疣微菌门的相对丰度较其他轮作模式显著升高(P<0.05)。在属水平上,CAT和AK分别与Gaiella呈极显著相关(P<0.01),与鞘氨醇单胞菌属(Sphingomonas)显著相关(P<0.05)。结合土壤理化指标和微生物活性指标可以看出,AO轮作模式的过氧化氢酶活性最强,pH值降低最为显著,这与AO轮作模式中嗜盐囊菌属(Haliangium)多样性显著提高有关,说明AO轮作模式较其他模式显著改善了土壤微生态环境,增加了微生物群落多样性[23]。
本研究发现的各轮作顺序丰度较高的菌分别属于变形菌门、放线菌门、酸杆菌门、厚壁菌门和芽单胞菌门,这一结果与SAPP等[24]、LIU等[25]和侯梅锋等[26]对土壤细菌的研究结果一致。从优势菌株的功能看,变形菌门(Proteobacteria)广泛存在,变形菌门作为细菌中最大的一个门,有研究报道其中许多类群可以进行固氮作用,并且能够适应各种复杂的环境,因此环境条件的变化对其分布和相对丰度影响不大[25,27]。因其生理特性多种多样,可以适应多样的生态环境,包括海洋、咸水环境、碱性和酸性环境,除Betaproteobacteria外,包含所有的嗜盐细菌,在原生盐碱土和次生盐碱土中均有优势类群[28],这与本研究结果一致。放线菌是自然界分布最为广泛的微生物类群之一,参与土壤有机质转化、土壤结构形成、植物生长素和抗生素分泌[29]。酸杆菌门(Acidobacteria)是一类分布广、代谢类型丰富的土壤细菌,其遗传与代谢多样性与变形菌门和革兰氏阳性菌有着同样重要的生态学意义[30-32]。厚壁菌门是我国许多盐渍化土壤中的优势菌群[33],主要由芽孢杆菌纲(Bacilli)、梭菌纲(Clostridia)、丹毒丝菌纲(Erysipelotrichia)及一些不确定的遗传类群组成。其中芽孢杆菌纲内的物种由于大多可形成抗逆性极强的芽孢,而具有极强的环境适应性,如干旱、盐碱等环境,因此在生态系统中发挥着重要的生物学作用。有研究表明拟杆菌门对高盐环境具有较强的抗性,是盐碱土壤中的优势种群[34],在本研究中得到了证实。本研究发现5种草田轮作模式下,土壤微生物代谢活性和功能多样性随作物的生长都发生了变化,优势细菌的作用与土壤功能密切相关。宁夏银北地区盐碱化土壤以NaCO3和NaHCO3为主,土壤的pH值普遍在8.5以上。因此,该地区的高盐碱度很可能导致其耐(嗜)盐菌具有高耐盐碱能力。
从属水平分析,发现5种不同轮作模式聚集较多的物种均不同,AF模式为红色杆菌属(Rubrobacter)和Opitutus,AA模式聚集较多的为拟杆菌属和Subdoligranulum,AO模式聚集较多的为芽单胞菌属(Gemmatimonas),AC模式聚集较多的为热单胞菌属和盐单胞菌属(Halomonas),AS模式聚集较多的为假单胞菌属(Pseudomonas)。已有研究表明Gaiella是所有样本中放线菌门的主要属[35],是革兰氏阳性菌,由ALBUQUERQUE等[36]第一次描述。鞘氨醇单胞菌属(Sphingomonas)是一种新型的生物资源,Sphingomonas属的一个显著特征是降解多环或单环芳香族化合物(如苯甲酸、水杨酸等),利用这些芳香族化合物为唯一碳源进行生长[37],而苯甲酸、水杨酸及其衍生物是根系分泌物中的重要化感物质,由此看来Sphingomonas属在根际所占比例较大可能与根分泌物中芳香族化合物在根围土壤中积累有关。根据16S rDNA的序列分析并结合其他生物学性状分析,嗜盐囊菌属是嗜盐菌的一个分支,具有嗜盐菌的特性。嗜盐菌由于生理性质独特,其体内很多酶在高盐浓度下保持稳定,具有低营养需求和对高浓度盐的抗性,提高土壤养分状况,并为土壤补充肥力和水分,是土壤嗜盐酶的主要来源[38]。
由于宁夏地处干旱半干旱区,土壤含水率、pH值、有机质含量和氮元素、磷元素含量等诸多因素都影响土壤微生物的空间分布格局[39]。在宁夏银北盐碱地实行苜蓿草地作物轮作研究发现,不同轮作模式对土壤全氮影响有较大差异;碱解氮总体上呈下降趋势;苜蓿草地的作物轮作能够提高土壤氮、磷有效性。说明草田轮作提高了土壤氮、磷的有效性和活化率。试验涉及的轮作模式中苜蓿轮作油葵模式可提高土壤全氮、碱解氮、速效磷含量,轮作玉米次之,轮作甜高粱最小,不同草田轮作方式下,第2生长周期不同轮作方式下土壤养分、pH值、酶活性在不同处理间差异显著。饲料玉米、甜高粱参与轮作方式的土壤酶活性高于作物连作,苜蓿休闲及油葵参与轮作的方式,其中AO轮作模式的过氧化氢酶、蔗糖酶、脲酶、碱性磷酸酶活性最强,苜蓿与不同作物轮作方式能够提高土壤酶活性。
可见,将不同种类作物合理组合后的轮作模式能够充分全面利用土壤不同深度养分。因此,有必要科学合理地安排草田轮作顺序,确定适合当地气候条件的最佳轮作模式来维持土壤肥力平衡,保持水肥协调和可持续利用,达到增产增收。
4 结束语
变形菌门、放线菌门、酸杆菌门是所有轮作模式中的优势种类,节杆菌属是所有轮作模式的优势属。苜蓿休闲模式土壤细菌群落α-多样性相对较高,苜蓿轮作甜高粱模式土壤细菌群落α-多样性相对较低,其中土壤速效钾、过氧化氢酶对土壤微生物群落结构具有重要作用。过氧化氢酶和速效钾分别与Gaiella呈极显著相关,与鞘氨醇单胞菌属(Sphingomonas)呈显著相关,过氧化氢酶和pH值分别与嗜盐囊菌属(Haliangium)呈显著相关,且过氧化氢酶与新鞘氨醇杆菌属呈显著相关,速效钾与Ramlibater和Opitutus呈显著相关。AO轮作模式的过氧化氢酶活性最强,pH值降低最为显著,这与AO轮作模式中嗜盐囊菌属(Haliangium)多样性显著提高有关。研究发现,采用苜蓿轮作农作物模式可以提高宁夏银北地区盐碱化土壤养分及酶活性,并有效改善细菌群落多样性,其中苜蓿轮作油葵模式细菌群落多样性显著高于其他模式,碱性磷酸酶活性和pH值是影响细菌群落结构组成和多样性最显著的环境因子。

