活性多肽GRGDS 对氧糖剥夺诱导PC12 细胞损伤的保护作用及其机制研究
张 城,马剑平,沈育桦,朱文君,刘河龙,邱 彦 (上海健康医学院附属浦东新区人民医院药剂科,上海 201200)
脑卒中是人类疾病中最常见的脑血管疾病,已经成为人类死亡的第二大原因[1]。脑卒中引起的一系列并发症和后遗症给患者家庭带来了不可估量的负担。脑卒中分为缺血性脑卒中和出血性脑卒中两种,其中,缺血性脑卒中又称脑中风,是脑卒中主要的发病方式,约占脑卒中患者的83%以上[2]。目前,尚无有效的治疗药物用于脑卒中引起的损伤,尤其是对于神经损伤的治疗[3]。活性多肽GRGDS 是由甘氨酸-精氨酸-甘氨酸-天冬氨酸-丝氨酸(Gly-Arg-Gly-Asp-Ser,GRGDS)5 种氨基酸构成,主要通过形成一个β 转角的方式与其他细胞发生黏连[4],因而,能够阻断细胞外基质和细胞表面整合素的结合和黏附,可应用于组织工程或者癌症和肿瘤方面。本试验采用PC12 细胞体外模拟脑缺血模型,探讨活性多肽GRGDS 对氧糖剥夺损伤后的PC12 细胞是否具有保护作用。
1 材料
1.1 细胞株
PC12 细胞购自ATCC 细胞库,培养在含有10%胎牛血清的完全培养液中,每12 h 观察一次细胞的生长状态,每24 h 更换一次细胞培养液,待细胞长到80%进行传代。
1.2 药物与试剂
活性多肽GRGDS(上海淘普生物科技有限公司);高糖DMEM 培养液、DMEM 无糖培养液(Gibco 公司);凋亡试剂盒、蛋白质提取试剂盒(上海碧云天生物技术有限公司);抗体:β-肌动蛋白(βactin)、含半胱氨酸的天冬氨酸蛋白水解酶3(caspase 3)、活化型含半胱氨酸的天冬氨酸蛋白水解酶3(cleaved caspase 3)、磷酸化c-Jun 氨基末端激酶(P-SAPK/JNK)、Bax 蛋白(美国CST 公司)。
1.3 仪器
细胞培养箱、酶标仪(美国Thermo 公司);低温高速离心机(德国Eppendorf 公司);细胞缺氧装置(美国Billips-Rothenberg 公司);流式细胞仪(BDBiosci-ences 公司);Western blot 图像扫描仪(美国Odyssey 公司)。
2 方法
2.1 PC12 细胞氧糖剥夺损伤模型的建立
氧糖剥夺模型参照文献[5]体外模拟脑缺血模型,即OGD 模型,再根据实验过程中的实际情况稍作改造。将细胞培养在培养板中,待细胞生长至培养板底面积80%以上,将对照组的培养液换成无血清高糖完全培养液,OGD 组换成无糖培养液,活性多肽GRGDS 给药组换成加有GRGDS 药物处理的无糖培养液。将含有3 组细胞的培养板置于恒温培养箱中孵育1 h,然后将模型组和给药组的细胞置于缺氧装置中,通入混合气体(95%N2,5%CO2),使装置内的氧气完全排出,分别将细胞缺糖和缺氧2、4、6、8 h 后取出,采用MTT 法选出细胞损伤的最佳时间,进行后续试验研究。
2.2 MTT 法测定细胞活力
将PC12 细胞以2.0×105个/ml 的密度铺于96 孔板中,按照“2.1”项下方法进行操作,在缺糖、缺氧之前,将给药组细胞的培养液换成含有不同浓度的活性多肽GRGDS(10、1、0.1、0.01、0.001、0.000 1 μg/ml)的无糖培养液置于培养箱中适应1 h,OGD 组和给药组一同置于缺氧装置中缺氧4 h。缺氧过后取出培养板,在避光条件下将所有组的细胞加入每孔20 μl 提前配好的0.5%MTT 溶液(5 mg/ml),用锡箔纸包好将其放入37 ℃恒温培养箱中,继续孵育4 h 后弃掉上清液,再向每个细胞培养孔中加入150 μl 二甲基亚砜(DMSO)溶液,温室振荡5 min,用全自动酶标仪在492 nm 波长处检测每个孔中细胞的吸光值(A)。
2.3 流式细胞仪检测细胞凋亡
将PC12 细胞铺于6 孔板中,待细胞贴壁后将OGD 组中的培养液换成无糖DMEM 培养液,给药组中的培养液换成加有活性多肽GRGDS 处理的无糖DMEM 培养液,恒温孵育1 h 后置于缺氧装置中缺氧4 h,缺糖、缺氧后弃掉每孔中的细胞上清液,用磷酸盐缓冲液(PBS)清洗2 次,洗掉细胞表面残留的培养液,再用不含依地酸(EDTA)的胰蛋白酶消化液消化1~2 min。将各组细胞置于不同的离心管中,以1 200 r/min 离心5 min,弃上清液,再加入PBS,将细胞进行重悬后再离心。离心后弃掉上清液,每个离心管中加入500 μl 的1×缓冲液轻轻吹打混匀,避光条件下向各离心管中加入5 μl 的细胞凋亡检测试剂(annexin V-FITC),室温放置5 min 后,再加入5 μl 的碘化丙啶(PI)染色液。充分混匀后室温避光放置15 min,用流式细胞仪进行检测。
2.4 ELISA 检测OGD 后PC12 细胞相关炎症因子的变化
将PC12 细胞氧糖剥夺后取细胞上清液,4 ℃、300 r/min,离心15 min。离心后取上清液放入4 ℃冰箱冷藏保存,若不能及时检测,应将上清液放在−20 ℃冷冻保存。按照试剂盒中的说明书建立标准曲线,检测各组样本吸光值,并计算其浓度。
2.5 Western blot 检测相关蛋白的表达
将氧糖剥夺损伤后的各组细胞上清液弃掉,用预冷的PBS 清洗细胞表面残留的培养液,用细胞刮刀将各组细胞刮掉,置于预冷的RIPA 裂解液中裂解30 min,使细胞中的蛋白完全裂解,以12 000 r/min,离心10 min,取上清液。BCA 蛋白测定试剂盒测定蛋白浓度。各组蛋白中加入20 μl 5×蛋白上样缓冲液,100 ℃煮10 min。10%SDS-PAGE 分离蛋白,转膜,用含5%脱脂奶粉的Tris 缓冲液封闭1 h,孵育一抗4 ℃环境下过夜,回收一抗,洗膜3 次(5 min/次),室温条件下加二抗,避光孵育2 h 后洗膜。使用Western blot 图像扫描仪扫描并统计结果。
2.6 统计学分析
3 结果
3.1 活性多肽GRGDS 对OGD 损伤的PC12 细胞的保护作用
为了选择合适的缺糖缺氧时间,本实验设置了2、4、6、8 h 的时间点,结果显示,细胞生存率随着氧糖剥夺时间的增长而显著降低,与对照组相比有显著性差异(P<0.01),且缺糖缺氧4 h 细胞明显皱缩,细胞活性明显降低,细胞的损伤率达到50%,此时的损伤率有利于药物补救,更有助于细胞的恢复,因此,氧糖剥夺损伤时间为4 h 条件最佳(图1A)。活性多肽GRGDS 给药浓度为0.01 μg/ml,可显著提高缺糖缺氧4 h 后PC12 细胞的活力(P<0.01)。因此,选择缺糖缺氧4 h,给药浓度0.01 μg/ml 作为实验条件进行后续研究(图1B)。
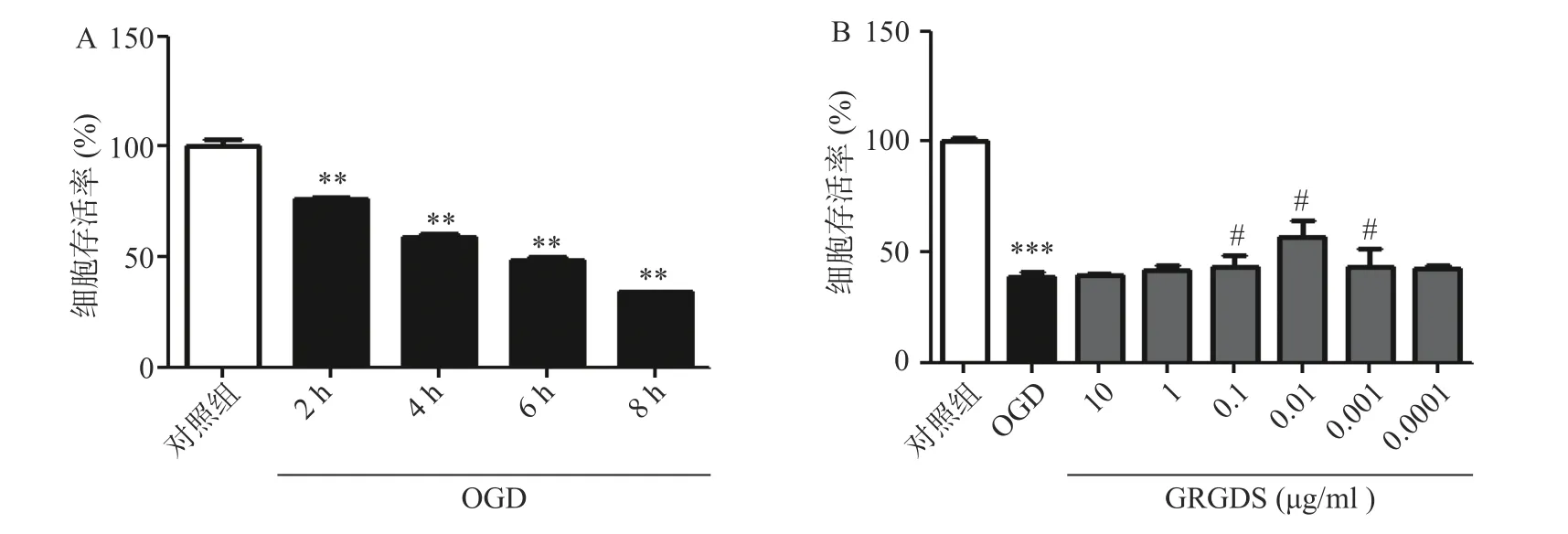
图1 活性多肽GRGDS 对OGD 后PC12 细胞的影响(n=3)
3.2 活性多肽GRGDS 降低OGD 后PC12 细胞的凋亡
将细胞以2.0×105个/ml 细胞密度铺于6 孔板中,培养16 h 后,将OGD 组细胞的高糖培养液换成无糖的DMEM 培养液,给药组细胞的高糖培养液换成给予活性多肽GRGDS 药物处理的无糖DMEM 培养液,37 ℃恒温培养箱中平衡1 h,缺氧4 h,而正常对照组细胞的培养液换成新的高糖DMEM 培养液继续培养。缺糖缺氧结束后,用流式细胞仪检测各组细胞凋亡情况。图2 结果显示,与正常对照组比较,OGD 组细胞的凋亡率显著增加(P<0.01),由正常对照组(2.26±0.61)%上升到(12.14±1.69)%。给予活性多肽GRGDS 0.01 μg/ml剂量浓度处理后,细胞凋亡率明显降低,凋亡率降至(6.94±1.45)%(P<0.01)。
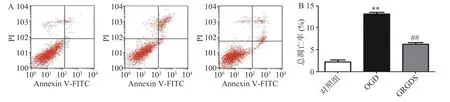
图2 活性多肽GRGDS 对OGD 后PC12 细胞凋亡率的影响(n=3)
3.3 活性多肽GRGDS 降低OGD 后PC12 细胞上清液中TNF-α 和IL-1β 的含量
正常对照组细胞上清液中TNF-α 的含量为(27.16±2.69)pg/ml,两者相比,OGD 组细胞中的TNF-α 含量明显增加(P<0.01),为(54.51±2.89)pg/ml;与OGD 比较,给予活性多肽GRGDS 0.01 μg/ml 剂量浓度处理的细胞上清液TNF-α 的含量显著降低,为(38.32±18)pg/ml(P<0.01,图3A)。正常对照组细胞上清液IL-1β 的含量为(15.4±0.11)pg/ml,OGD组细胞上清液中IL-1β 的含量为(35.99±2.25)pg/ml,两者相比,OGD 中的IL-1β 含量显著增加(P<0.01)。与OGD 比较,给予活性多肽GRGDS 0.01 μg/ml 剂量浓度处理的细胞上清液中IL-1β 的含量显著降低,为(21.84±1.18)pg/ml(P<0.01,图3B)。
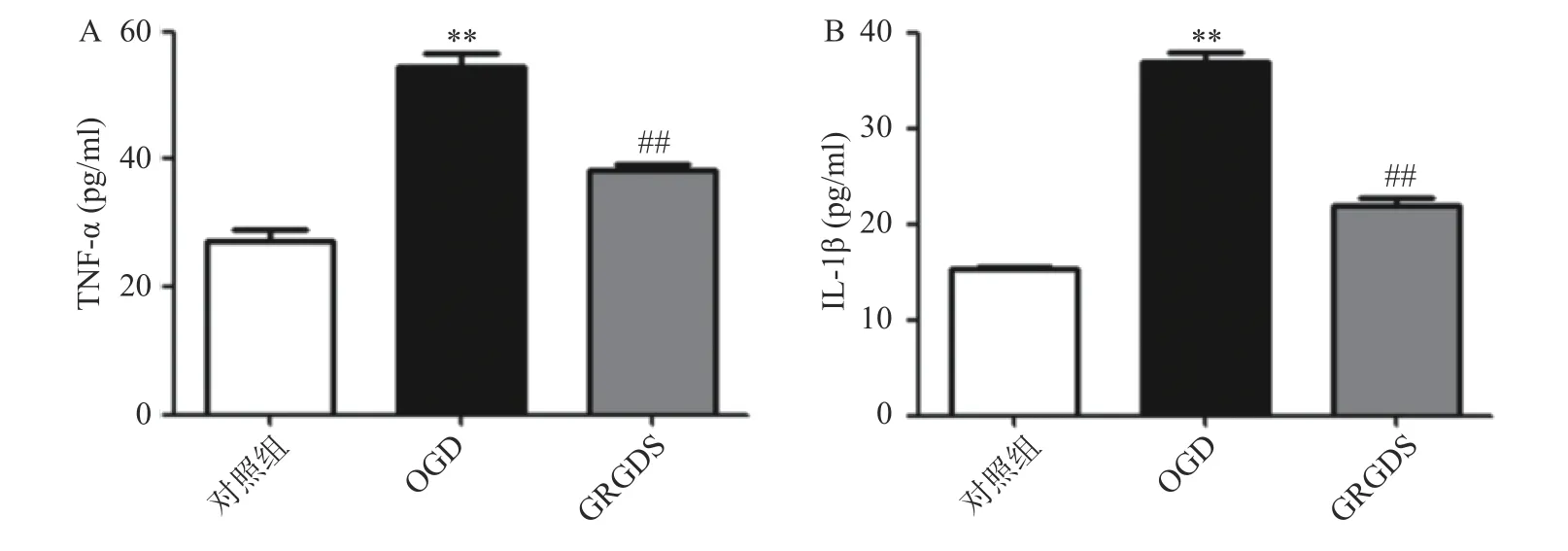
图3 活性多肽GRGDS 对OGD 后PC12 细胞上清液中TNF-α 和IL-1β 的影响(n=3)
3.4 活性多肽GRGDS 降低OGD 后PC12 细胞中p-JNK、Bax、cleaved caspase 3 蛋白的表达
本实验检测了MAPKs 信号通路中的JNK 信号通路中相关蛋白表达的影响。结果如图4 所示,PC12 细胞经过氧糖剥夺损伤后,细胞中的p-JNK、Bax、cleaved caspase 3 蛋白表达与正常对照组细胞相比均显著升高(P<0.01);而给予活性多肽GRGDS 0.01 μg/ml 剂量浓度处理后,可明显降低氧糖剥夺损伤后细胞中p-JNK、Bax、cleaved caspase 3 蛋白的表达(P<0.01)。

图4 活性多肽GRGDS 对OGD 后PC12 细胞中p-JNK、Bax、cleaved caspase 3 蛋白表达的影响(n=3)
3.5 活性多肽GRGDS 降低OGD 后PC12 细胞中加入JNK 抑制剂p-JNK、Bax 蛋白的表达
将原始浓度为10 mmol/ml 的JNK 抑制剂(SP600125)稀释成10 μmol/ml 的浓度加入到PC12细胞中,缺糖缺氧后提取细胞蛋白分别检测p-JNK 及其下游Bax 蛋白的表达情况。结果如图5所示,OGD 组细胞中p-JNK、Bax 的蛋白表达与正常对照组细胞相比都显著增加(P<0.01);给予活性多肽GRGDS 0.01 μg/ml 剂量浓度以及JNK 抑制剂处理后,p-JNK、Bax 蛋白的表达水平与OGD 组相比均明显降低(P<0.01)。
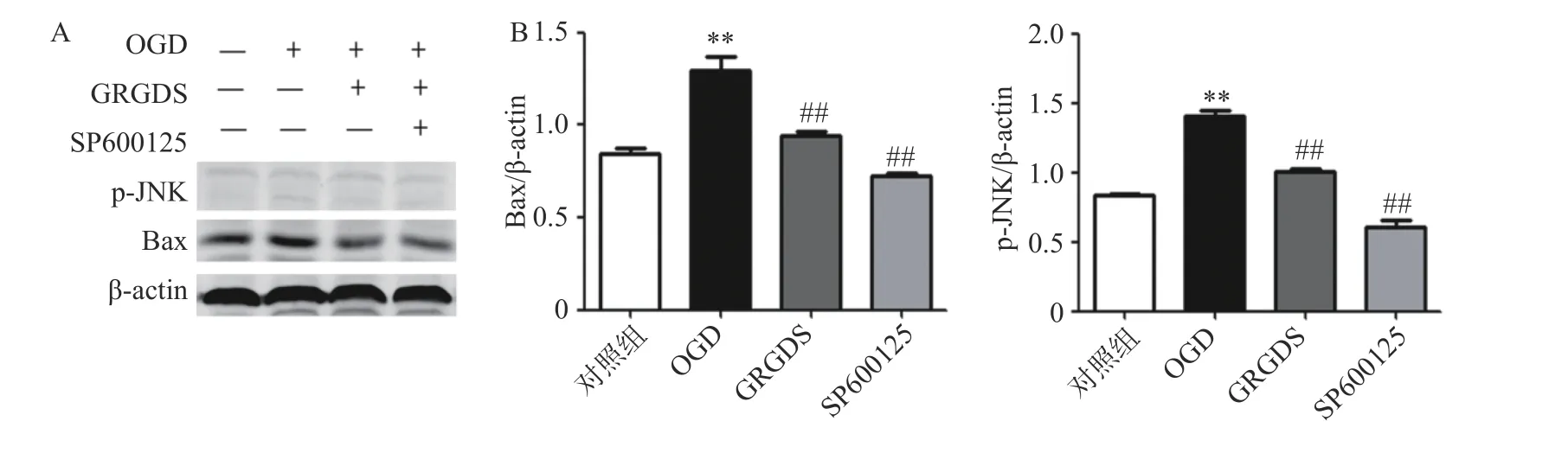
图5 活性多肽GRGDS 对OGD 的PC12 细胞加入JNK 抑制剂后p-JNK、Bax 蛋白表达的影响(n=3)
4 讨论
缺血性脑卒中是由血管阻塞引起的脑血液循环障碍诱发的神经系统损伤,致死、致残率较高,且病理机制十分复杂,目前医学上仍缺乏行之有效的治疗方法。在急性缺血的早期阶段,细胞凋亡可能是对氧糖剥夺的一种自我保护反应,有助于维护重要细胞的生存。然而,在局部缺血的大部分期间,钙超载、氧自由液和溶酶体酶的释放均会导致细胞坏死[6]。
最新研究表明,活性多肽GRGDS 可激活体内干细胞,促进细胞的增长和分化[7]。但是,活性多肽GRGDS 对于PC12 细胞凋亡引起的一系列炎症反应的作用尚未见研究报道。因此,本实验研究了活性多肽GRGDS 对氧糖剥夺损伤的PC12 细胞凋亡和凋亡反应的抑制作用,并初步探讨其可能存在的药理和药效机制。首先,建立氧糖剥夺损伤的PC12 细胞模型,同时加入不同给药剂量浓度的活性多肽GRGDS 进行处理。结果发现,活性多肽GRGDS 的不同给药剂量浓度可有效抑制氧糖剥夺PC12 细胞的损伤,并且当活性多肽GRGDS 的剂量浓度为0.01 μg/ml 时药物作用效果最佳。故确定0.01 μg/ml 浓度作为机制探讨剂量。
TNF-α 是一种促炎性多效细胞因子,研究表明,TNF-α 可以通过激活转录因子NF-κB 的机制阻止神经元的死亡或凋亡,从而诱导Mn-SOD 和Bcl-2 的表达[8]。TNF-α 在大脑发育过程中起着效应分子的作用,经常参与不同的信号通路,激活巨噬细胞和神经胶质细胞,促进神经毒素的产生,并启动神经细胞的凋亡或死亡过程[9]。IL-1β 作为一种炎症和免疫源性细胞因子,可在多个环节参与脑缺血损伤机制。研究表明,大量炎性细胞因子(IL-1β、TNF-α)参与脑缺血再灌注损伤后脑细胞的凋亡和坏死[10]。因此检测了氧糖剥夺损伤的PC12 细胞上清液,结果显示,氧糖剥夺损伤后PC12 细胞上清液中TNF-α 和IL-1β 含量显著增加,给予活性多肽GRGDS 0.01 μg/ml 剂量浓度处理后,上清液中的TNF-α 和IL-1β 含量明显降低。
本研究结果显示,经过氧糖剥夺损伤后,PC12 细胞的凋亡率明显增加,而给予活性多肽GRGDS 0.01 μg/ml 剂量浓度处理后PC12 细胞的凋亡率显著下降,这提示了活性多肽GRGDS 可能通过抑制PC12 的凋亡而发挥神经保护作用。为了进一步研究活性多肽GRGDS 是否通过抗凋亡作用发挥对PC12 细胞的保护作用,本实验试着对凋亡信号通路中的p-JNK、Bax、cleaved caspase 3 等相关蛋白的表达进行了检测。据报道,caspase 3 是细胞凋亡中的关键部分,是其信号传导的效应通路。caspase 3 可能通过线粒体、内质网和死亡受体三种途径激活体内细胞中的死亡信号。缺血性脑卒中一般会引起体内线粒体细胞色素c 的释放导致caspase 3 的表达、激活和裂解,从而促进细胞凋亡。在细胞死亡引起的凋亡过程中,cleaved caspase 3 的表达会增加[11]。研究发现,MAPK 可以参与调节多种信号通路诱导或减轻细胞凋亡,活化的JNK 会引起脑缺血应激反应的细胞凋亡,而JNK 抑制剂在脑缺血再灌注损伤后提供神经保护作用。Bcl-2 蛋白家族中的抗凋亡Bcl-2(Bcl-xL)和促凋亡Bax 蛋白之间的动态平衡在决定脑缺血期间的细胞命运中起关键作用。越来越多的证据表明,Bcl-2(Bcl-xL)/Bax 比率的增加抑制Bax 易位至线粒体并保护神经元免受细胞凋亡的损伤,而平衡向Bax 过量的转变会引起缺血诱导的神经细胞凋亡。本研究结果显示,氧糖剥夺损伤后PC12细胞中p-JNK、Bax、cleaved caspase 3 蛋白的表达水平显著升高,综合流式细胞仪检测氧糖剥夺损伤后PC12 细胞凋亡的结果,表明活性多肽GRGDS可能通过抑制凋亡信号通路中的JNK/Bax 信号通路,进而抑制氧糖剥夺损伤的PC12 细胞凋亡反应,最终发挥神经保护作用。
本研究结果表明,活性多肽GRGDS 0.01 μg/ml剂量浓度可以明显抑制氧糖剥夺损伤的PC12 细胞凋亡,降低细胞上清液中TNF-α 和IL-1β 的含量,并通过调控JNK/Bax 信号通路蛋白的表达发挥神经保护作用。活性多肽GRGDS 可能在脑缺血中对PC12 细胞引起的损伤具有一定的神经保护作用。进一步的研究还需在动物模型上进行更深一层的体内药效试验解释活性多肽GRGDS 对缺血性脑卒中的影响及其作用机制,为活性多肽GRGDS在临床上用于缺血性脑卒中的药物治疗提供良好的药理学基础。

