HBsAg<1 500 IU/mL的慢性乙型肝炎病人联合聚乙二醇干扰素α-2b治疗的疗效观察
崔甫朦,赵守松
乙型肝炎病毒(hepatitis B virus,HBV)感染是亚洲肝细胞癌(hepatocellular carcinoma,HCC)的首要病因,而乙型肝炎表面抗原(HBsAg)阳性的病人患HCC的风险显著增加[1]。2019年慢性乙型肝炎(chronic hepatitis B,CHB)防治指南中指出,对于部分适合的病人尽可能追求临床治愈目标,既停止治疗后仍保持HBsAg阴性(伴或不伴抗-HBs出现)、HBV DNA检测不到、肝脏生物化学指标正常、肝脏组织病变改善[2]。核苷(酸)类似物(NAs)治疗后获得病毒学应答的病人,再序贯或联合干扰素治疗,更容易达到临床治愈这一目标[3];HBeAg清除且HBsAg<1 500 IU/mL的病人接受聚乙二醇干扰素α-2b(Peg-IFNα-2b)序贯治疗有较高的HBsAg清除机会[4-5],提示HBsAg低水平是追求临床治愈目标的优势人群。本研究通过对NAs治疗后达到HBsAg<1 500 IU/mL的CHB病人联合Peg-IFNα-2b治疗方案行疗效分析,分析联合治疗与NAs单药治疗在HBsAg清除方面的差异。现作报道。
1 资料与方法
1.1 一般资料 选择2018年1月至2019年3月就诊于我院肝病科门诊的CHB病人。纳入标准:(1)符合2015年《慢性乙型肝炎防治指南》[6]中慢性HBV感染标准,且HBsAg<1 500 IU/mL;(2)目前正在应用NAs药物,应用时间>6个月。排除标准:(1)同时合并感染甲、丙、丁、戊型肝炎病毒或自身免疫性肝病,HIV感染等疾病;(2)有干扰素应用禁忌证或干扰素过敏者。
1.2 方法 符合纳入标准的病人了解治疗方案后,随机分为NAs联合Peg-IFNα-2b(厦门特宝生物工程股份有限公司,每支180 μg)治疗组26例和NAs治疗组29例。疗程48周,联合组方案为NAs+Peg-IFNα-2b(180 μg,皮下注射,1次/周),NAs组方案为继续病人原NAs治疗计划。根据血常规情况调整Peg-IFNα-2b剂量,治疗期间病人出现以下临床事件则提前终止Peg-IFNα-2b治疗:(1)死亡;(2)出现肝功能衰竭或肝硬化失代偿等Peg-IFNα-2b治疗禁忌证;(3)严重药物不良反应。
1.3 观察指标 分别于治疗前,治疗12、24、36、48周检测病人血常规、肝功能、CHB血清学指标(HBsAg、HBsAb、HBeAg、HBeAb)。检测方法:使用BECKMAN COULTER AU5800型全自动生化分析仪检测肝功能;使用罗氏E411型全自动电化学发光免疫分析仪进行CHB血清学指标检测;使用安普利Anadas9850型全自动核酸检测分析系统进行病毒学指标检测。
1.4 疗效判断 根据48周治疗结束时病人检测指标定义应答,应答组:HBV DNA低于检测上限(<50 IU/mL),HBsAg消失(<0.05 IU/mL),HBeAg血清学转换(<1.0 COI);无应答组:HBsAg未清除(≥0.05 IU/mL)。病毒学突破:HBV DNA在治疗过程中比最低值升高超过1 lg IU/mL。
1.5 统计学方法 采用Mann-Whitneu U检验、χ2检验和Fisher′s确切概率法。
2 结果
2.1 人口学及基线特征 最终分析共纳入53例病人,联合组26例,NAs组29例。联合组2例因不良反应严重而退出治疗,未纳入最终分析。2组病人基线特征及丙氨酸氨基转移酶(ALT)差异无统计学意义(P>0.05)(见表1),均具有可比性。
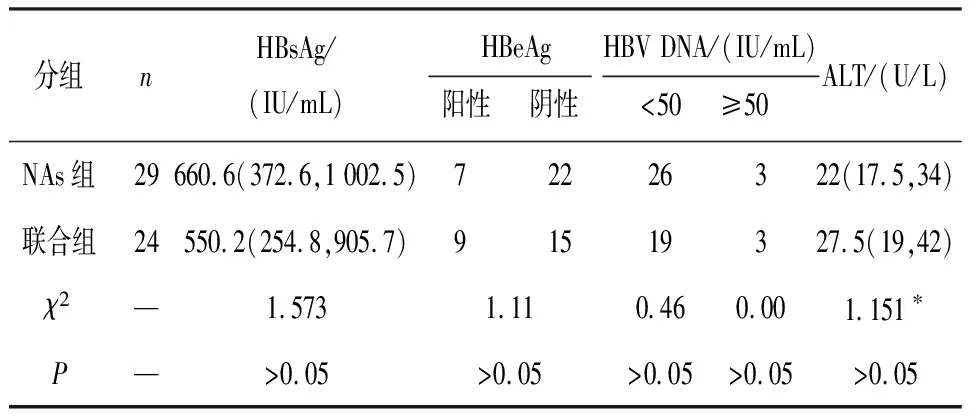
表1 2组基线特征比较[ n;M(IQR)]
2.2 2组疗程结束应答率比较 48周疗程结束,联合组HBsAg清除率为33.3%(8/24),明显高于NAs组(0.0%),差异有统计学意义(P<0.01),HBsAg转换率2组差异无统计学意义(P>0.05)。联合组有44.4%病人获得HBeAg转换(4/9),高于NAs单药治疗组,但样本量过小,未进行统计分析。

表2 2组疗程结束疗效对比[ n;百分率(%)]
2.3 HBsAg动态变化 联合组病人在12、24、36、48周HBsAg水平及48周末HBsAg下降绝对值均低于NAs组,差异均有统计学意义(P<0.01),但24周末联合组HBsAg下降绝对值2组差异无统计学意义(P>0.05);48周末,联合组有8例应答,16例无应答;动态分析HBsAg水平,应答组12周、24周、36周HBsAg水平低于无应答组,差异有统计学意义(P<0.05~P<0.01),但2组48周时HBsAg水平及HBsAg下降的绝对值差异无统计学意义(P>0.05)(见表3)。
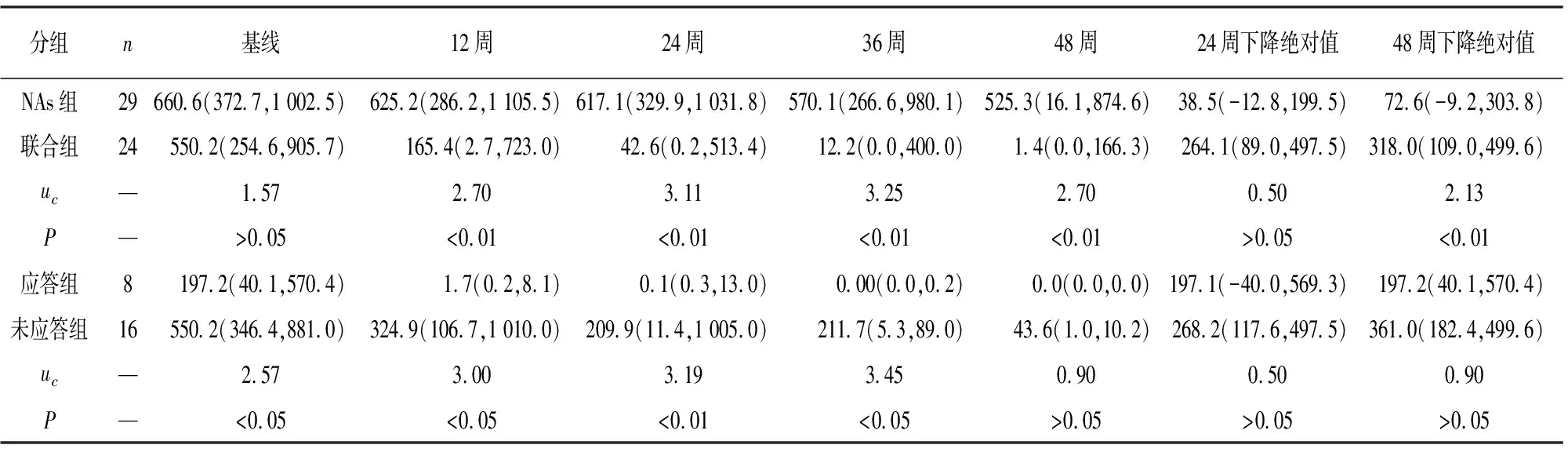
表3 HBsAg水平比较[M(IQR);IU/mL]
2.4 ALT动态变化定义 ALT波动为治疗过程中ALT水平较入组时升高超过1倍正常值上限。联合组及NAs组基线ALT水平无明显差异,治疗过程中联合组ALT波动率为50.0%,明显高于NAs组ALT波动率(7.1%)(χ2=6.13,P<0.05)。比较应答组与无应答组ALT变化情况,结果提示基线ALT异常的病人应答率明显高于ALT水平正常的病人(80% vs 21%,χ2=6.92,P<0.05)。
2.5 HBsAg清除预测因素 48周后只有联合组病人存在应答,应答组与未应答组在性别、年龄、基线、HBV DNA、HBeAg水平方面的差异无统计学意义(P>0.05),应答组HBsAg水平低于未应答组,差异有统计学意义(P<0.05)(见表4)。进一步分析基线HBsAg水平对HBsAg清除的影响,以联合组病人基线HBsAg水平绘制受试者工作特征曲线,基线HBsAg水平对联合Peg-IFNα-2b治疗后HBsAg清除具有预测价值,曲线下面积0.828,截断值为327 IU/mL,敏感度为75%,特异度为87.5%。

表4 应答组与未应答基线特征比较[ n;M(IQR)]
2.6 停药后持续应答 所有病人48周疗程结束后继续随访,有12例随访时间不足24周。1例获得HBsAg清除的病人在停药13周时出现HBsAg复阳,但未出现病毒学突破。随访过程中联合组有2例病人分别于治疗结束第13周、15周出现病毒学突破。
2.7 不良反应 联合组有2例病人因无法耐受不良反应退出治疗,24例完成48周疗程病人中有4例病人因骨髓抑制而暂时停用Peg-IFNα-2b(16.7%),其他常见的不良反应有:骨髓抑制包括白细胞降低10例、中性粒细胞降低11例、血小板降低10例,流感样症候群、发热各19例,乏力、皮疹各3例;治疗过程中因血常规异常而暂时停针4例,因出现严重不良反应而退出治疗2例。NAs组因缺乏检测指标无法得知是否存在骨髓抑制,治疗期间未报告其他不良反应。治疗期间所有不良反应均随停药、调整药物剂量和对症治疗而消失,无死亡病例出现。
3 讨论
本研究结果表明,NAs治疗后HBsAg<1 500 IU/mL的病人联合Peg-IFNα-2b治疗48周HBsAg清除率可达33.3%、转换率可达12.5%,明显高于NAs单药治疗。所有病人随用药时间延长HBsAg水平呈均下降趋势,但联合组的HBsAg下降幅度明显高于NAs组,这与张珊等[7-9]研究结果相似,虽然NAs单药治疗可以长期保持HBV-DNA阴性,但降低血清HBsAg的效果不理想,联合治疗对于恢复机体免疫应答以及清除病毒方面有明显优势,并且既往曾接受NAs治疗现基线HBsAg低水平的病人联合PEG-IFN可以提高HBsAg清除率。PEG-IFN治疗前的基线HBsAg<1 500 IU/mL,有更高的HBsAg的清除机会[4-5,10]。本研究通过对联合组病例的分析得出基线HBsAg<327 IU/mL对48周疗程结束时HBsAg清除有预测作用,提示基线HBsAg水平越低获得HBsAg清除的概率越高。
既往有研究[11-12]表明,HBeAg持续处于高水平状态可以预测PEG-IFN治疗的无应答。但本研究中HBeAg定量对于HBsAg的清除无显著的影响,该结论与HAN等[4]研究结果一致,考虑和HBeAg阳性病人基线HBeAg定量较低有关(中位数2.83 COI)。
本研究还发现,治疗过程中加用Peg-IFNα-2b后ALT升高的病人明显多于NAs组,考虑治疗过程中ALT的升高可能与加用Peg-IFNα-2b诱导出现的免疫清除有关,治疗期间出现ALT的升高,是机体对IFN免疫应答的表现。在2017年欧洲肝病学会指南中也指出治疗过程中曾出现一过性的ALT波动可能预示更好的抗病毒疗效[12]。对于联合组中应答组与无应答组病例,我们研究发现基线ALT水平高于正常上限的病人获得HBsAg血清清除的可能性更高(80% vs 21%),这与既往的研究[12-13]结果一致。
48周用药结束,继续随访时,应答组有1例病人于停用Peg-IFNα-2b后第13周时出现HBsAg复阳,但HBV DNA持续低于检测下限。无应答组有2例病人分别于停用Peg-IFNα-2b后第13周、15周出现了病毒学突破。既往有研究[14-15]表明,即使HBsAg清除,病人的肝细胞中仍可检出HBV DNA和cccDNA,而肝细胞内未完全清除的cccDNA是导致停药后复发的根源。本研究中联合组有62.5%病人曾出现骨髓抑制,16.7%病人因严重骨髓抑制而暂时停药,因此即使达到血清HBsAg清除,仍需要长期监测病毒学、生化学等指标,及时发现药物不良反应并处理,避免出现HBV再激活、HCC等肝脏事件的发生。
对于48周治疗无应答病人,由于有NAs的维持治疗,随访发现病人HBsAg未因停用Peg-IFNα-2b而有显著变化。多项研究[5,16]指出,延长疗程可增加NAs序贯/联合Peg-IFNα方案HBsAg的清除率,部分研究中干扰素停药后存在后续效应[5],停药随访的过程存在新增HBsAg清除的病例。因此本研究会对病人继续随访,同时扩大观察的样本量,以获得更多关于联合治疗的数据。
本研究尚存在一定问题,因为Peg-IFNα-2b治疗不良反应较多,部分病人难以耐受、体外注射用药不便、Peg-IFNα-2b价格相较NAs昂贵等原因导致应用人群有限,最终入组样本量较少;随访时间较短,病人的预后需要更长的随访时间和进一步的观察;因样本数量较少,且部分病人既往应用不止一种NAs药物,所以未对病人既往用药史进一步进行详细分层;现阶段cccDNA主要通过肝组织活检来实现,而肝活检为有创性操作,难以普及推广,所以无法得知肝脏内cccDNA是否得到清除,同时也不能得知病人肝脏组织病变是否有所改善。

