食品中4,4’-二硝基均二苯脲残留量的 前处理方法比较
◎ 谭美龄,蒋忠岑
(重庆市万州食品药品检验所,重庆 404000)
4,4’-二硝基均二苯脲(DNC)是抗球虫药尼卡巴嗪的残留标志物和抗球虫效果的主要活性成分[1],长期摄入尼卡巴嗪含量超标的食品会对身体产生危害。本文分别采用Oasis®PRiME HLB固相萃取法[2]、国家标准方法GB/T 29690—2013[3]以及QuEChERS法[4]对鸡蛋和鸡肉进行前处理,采用超高效液相色谱-串联质谱(UPLC-MS/MS)对DNC的残留量进行测定[5]。从净化效果、目标物损失情况、基质效应、回收率及精密度和实际应用能力这几个方面对DNC的3种前处理方法的适用性进行了比较,为尼卡巴嗪的相关分析研究提供参考。
1 材料与方法
1.1 材料与试剂
鸡蛋、鸡肉,采样于超市和农贸市场。
标准物质:DNC(Lot:C0005423,纯度为99.7%),北京曼哈格;DNC-D8(Lot:30213203,纯度为99.7%),德国WITEGA。
甲醇、乙腈(均为色谱纯),德国Merck公司;正己烷、无水硫酸钠等(均为国产分析纯),重庆川东化工公司;CNW®PSA(硅胶键合乙二胺基-N-丙基)、CNW®LC-C18(硅胶键合十八烷基40~63 μm),上海安谱实验科技股份有限公司。
1.2 仪器与设备
DIONEX UltiMate-3 000液相色谱系统-串联TSQ Quantum Access Max三重四极杆质谱仪(配ESI离子源),美国Thermo Fisher Scientific公司;SIGMA 3-15型台式高速离心机,德国SIGMA实验室离心机公司;Reeko AutoEVA-60全自动平行浓缩仪,睿科集团股份有限公司。
1.3 试验方法
1.3.1 标准溶液的配制
称取DNC标准物质0.010 02 g置于10 mL容量瓶中,用二甲基甲酰胺溶解配制成DNC标准储备溶液(998.994 μg·mL-1);称取 DNC-D8标准物质 0.010 00 g置50 mL容量瓶中,用二甲基甲酰胺配制成DNC-D8标准储备溶液(199.4 μg·mL-1)。分别移取上述溶液,用甲醇稀释成DNC标准工作溶液(998.994 ng·mL-1)和DNC-D8标准工作溶液(9.97 μg·mL-1)。按照最终定容内标浓度为 100 ng·mL-1,外标浓度为 2 ng·mL-1、5 ng·mL-1、10 ng·mL-1、20 ng·mL-1、40 ng·mL-1、60 ng·mL-1、80 ng·mL-1和 100 ng·mL-1,采用 75% 甲醇水溶液进行稀释配制。
1.3.2 样品制备
(1)方法1。采用GB 29690—2013方法,其中加入 10 μL DNC-D8标准工作溶液(9.97 μg·mL-1),最终用75%甲醇水溶液复溶至1 mL。
(2)方法2。称取2 g样品,加入100 μL DNC-D8标准工作溶液(9.97 μg·mL-1)和10 mL 80%乙腈水溶液,涡旋混合1 min,超声10 min,8 000 r·min-1离心10 min。取4 mL上清液过Oasis®PRiME HLB(6 mL,200 mg)小柱,收集滤液并吸取1 mL于氮气下(<40 ℃)吹至近干,将残余物用75%甲醇水溶液复溶至1 mL。
(3)方法3。称取2 g样品,加入4 mL水,涡旋混合1 min。加入100 μL DNC-D8标准工作溶液(9.97 μg·mL-1)和 10 mL 乙腈,涡旋混合 30 s。加入4 g硫酸镁(MgSO4)及陶瓷子,涡旋混合1 min,8 000 r·min-1离 心 10 min。 取 3 mL 上 清 液, 加 入400 mg MgSO4、70 mg PSA、20 mg C18,涡旋混合1 min,8 000 r·min-1离心 5 min。取 1 mL 上清液于氮气下(<40 ℃)吹至近干,将残余物用75%甲醇水溶液复溶至1 mL。
1.3.3 仪器分析条件
色谱柱:XBridge®BEH C18 2.5 μm 2.1 mm×100 mm Column XP;流动相A:甲醇;流动相B:5 mmol·L-1乙酸铵水溶液;梯度洗脱:0~1 min,流动相A为20%并保持1~2 min,流动相A从20%线性增加至90%,并保持至6 min。6.0~6.1 min,流动相A从90%线性回至20%,并保持至8 min;流速:0.20 mL·min-1;进样量:5 μL;柱温:40 ℃
离子源:ESI-;检测方式:选择反应监测扫描(SRM);电喷雾电压:-2 500 V;雾化器蒸发温度:300 ℃;毛细管温度:350 ℃;鞘气:241.32 kPa;辅助气:68.95 kPa;离子吹扫气:0 kPa;DNC定量离子对:300.991>137.008,DNC定性离子对:300.991>107.097;透镜电压:-24 V;碰撞能量:-22 V(定量)/-40 V(定性);DNC-D8定量离子对:309.156>141.020,透镜电压:-43 V;碰撞能量:-18 V。
2 结果与分析
2.1 净化效果
净化能力越强,杂质干扰越小。对于鸡蛋样品,净化效果为方法2>方法3>方法1;对于鸡肉,净化效果为方法3>方法2>方法1。方法1是国标方法,前处理采用乙腈提取的同时沉淀蛋白、正己烷脱脂净化,其提取液与正己烷分界面较浑浊,在目标化合物附近存在一定程度的色谱峰干扰,杂质容易污染色谱和质谱系统,除杂能力有限。方法2是采用80%乙腈水提取,PRiME HLB净化的方法,该法能有效去除鸡蛋、鸡肉中的蛋白、脂肪、磷脂和色素[2]。方法3是采用乙腈提取,PSA、C18分散固相萃取净化的方法,除杂能力优于方法1,样品提取液较清亮,但对于鸡蛋样品来说,除磷脂能力不及方法2。
2.2 目标物损失情况
采用3种方法分别处理加标样品溶液(1 ng·mL-1),目标物损失大小依次为方法2(33%)>方法3(16%)>方法1(14%)。方法2中PRiME HLB小柱的净化效果虽好,但是容易吸附DNC和DNC-D8,特别对于鸡蛋样品中目标物的吸附更明显,容易造成检出限偏高。方法3中QuEChERS法所用的提取盐和净化吸附剂对DNC及其内标物的存在一定的吸附,不及方法1中的国标方法检出限低。
2.3 基质效应
通过比较DNC在鸡蛋和鸡肉中的响应情况,考察基质效应,计算公式为:

3种方法的回收率、精密度和基质效应见表1。在3种不同方法处理条件下,鸡蛋和鸡肉均表现为弱基质增强效应(|ME|<20%),对离子化的增强效果不明显[6]。其中,采用方法2处理鸡蛋所产生的基质效应最低,方法3处理鸡肉所产生的基质效应最低。
2.4 回收率及精密度
采用3种方法对鸡蛋和鸡肉进行加标回收试验[7],见表1。方法2的回收率最低且不稳定,主要由于小柱填料对目标物的吸附影响太大;方法1的RSD均小于5%,稳定性最高;方法3的回收率在83.2%~96.8%,相比其他方法损失最小。
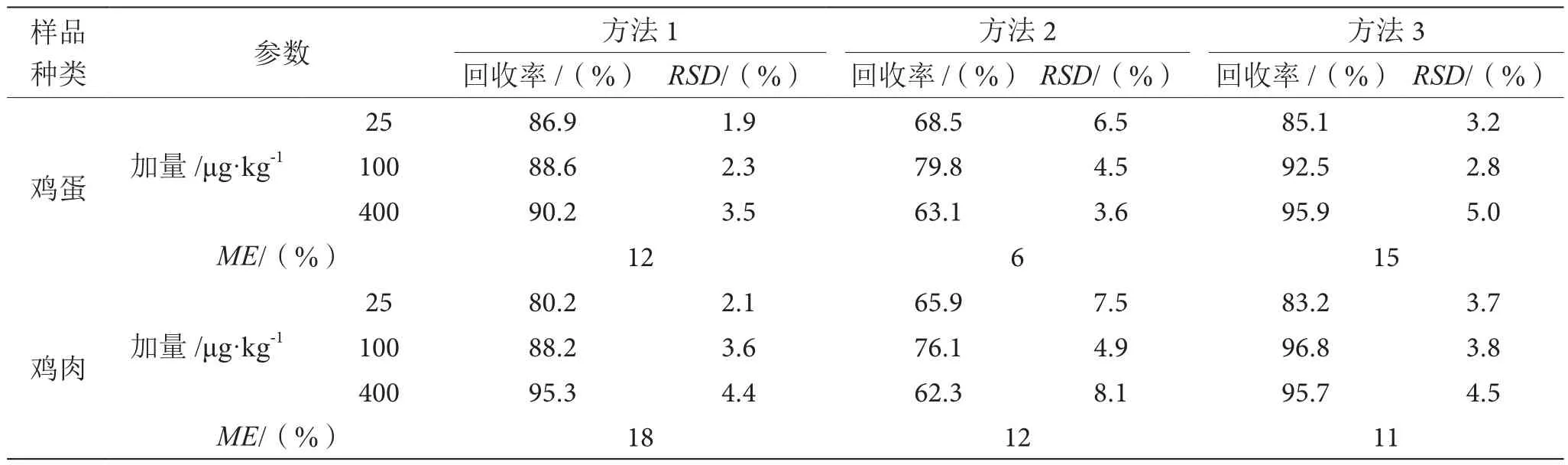
表1 3种方法的回收率、精密度和基质效应表
2.5 实际应用能力
本研究对100组鸡肉进行试验,见表2。3种方法的试剂使用量均不大,对环境和操作人员的影响较小,准确度和精密度均符合相关法规的要求。方法1采用有机试剂来提取加净化,一步到位,用时较短,成本最低。方法2的净化效果最好,色谱峰最干净,用时最短,但是回收率偏低,目标物损失较大,检出限偏高,实验成本较大。方法3耗时相对较长,但是回收率高且稳定,成本合适。
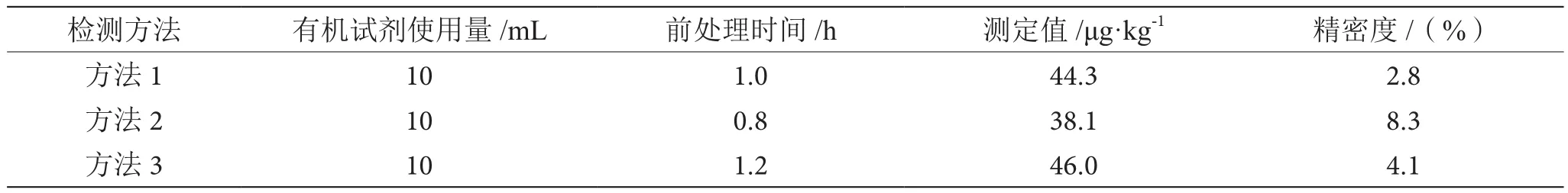
表2 3种方法的实际能力表
3 结论
综合3种方法对鸡肉和鸡蛋中4,4’-二硝基均二苯脲残留量的检测分析,3种方法各有所长,应结合具体实际情况来采用不同的前处理方法,达到相应的实验目的。方法1稳定性最好,检出限最低,成本最低,但净化效果略差,基质效应较大。方法2的净化效果最好,基质效应最弱,但方法回收率较低,稳定性较差,损失较大。方法3回收率最高,净化效果和稳定性较好。在保证检测结果准确性的基础上,为提高检测效率,降低成本,方法1和方法3更适合于实验室中大批量样品的快速定性定量分析。

