实时剪切波弹性成像和超声造影技术单独及联合诊断在乳腺癌中的应用价值
巩海燕 周文斌 邓晶 栗翠英 杜丽雯 王慧
南京医科大学第一附属医院1超声科,2乳腺外科(南京210029)
乳腺癌是女性最常见的恶性肿瘤之一,占女性癌症病死率的首位。研究表明,对乳腺癌易感人群开展筛查,以期早期发现、诊断、治疗,是提高乳腺癌患者生存率与临床治愈率的关键[1]。临床上,超声检查因其无创伤、无辐射、操作简便等优势已成为乳腺疾病临床诊疗的重要检查手段[2]。但由于乳腺病变临床病理特征具有多样性,且超声图表现复杂多变,乳腺肿瘤良恶性病变的超声图结果在一定程度上存在交叉重叠的现象,易造成临床漏诊、误诊的情况,使得常规超声诊断的应用具有一定局限性[3]。近年来,随着医疗技术的不断发展,实时剪切波弹性成像(SWE)和超声造影(CEUS)技术已逐渐成熟,并被广泛应用于临床肿瘤疾病的诊断中[4-6]。目前有关SWE 和CEUS 技术单独及联合诊断在乳腺癌中的应用价值研究较少,基于此,本研究选取我院收治的行SWE 以及CEUS 检查的乳腺肿瘤患者112 例,评估SWE 以及CEUS 图像对乳腺癌的诊断效能,现报告如下。
1 资料与方法
1.1 一般资料选取2015年4月至2018年12月我院收治的112 例乳腺肿瘤患者(共计112 个乳腺肿块),根据病理学检查结果分为良性肿块组65 例,恶性肿块组47 例。良性肿块组:年龄25 ~70 岁,平均(48.56±9.32)岁,肿块直径5 ~35 mm,平均(22.64±5.62)mm;恶性肿块组:年龄28 ~75 岁,平均(50.23 ± 8.76)岁,肿块直径4 ~38 mm,平均(23.22 ± 6.40)mm。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经院伦理委员会审核批准,所有患者均签署知情同意书。纳入标准:(1)20 岁≤年龄≤80 岁;(2)单发肿瘤患者;(3)常规超声检查确定乳腺有肿块,并经病理诊断为乳腺肿瘤患者;(4)患者在病理活检前均行SWE 以及CEUS 检查;(5)临床病例资料完整患者。排除标准:(1)有超声造影检查禁忌证者;(2)有精神病史者;(3)乳腺肿瘤复发患者;(4)合并严重妊娠期并发症或严重心、肝、肾功能不全患者。
1.2 方法
1.2.1 SWE 检查患者取平卧位,使用法国声科影像研发的Super Sonic Aixplorer 超声诊断仪系统检查乳腺整体情况。先在二维超声模式下确定患者乳腺肿块位置、形状等基本特征。启用诊断仪SWE 模式,不施压状态下固定探头至肿块最大径线切面,嘱患者屏气5 ~10 s,待图像稳定后,定帧、留图,取样框尽可能覆盖整个病灶周边正常乳腺组织。启动Q-BOXTM 功能,测定并记录取样框内肿块的最大弹性模量值、最小弹性模量值、平均弹性模量值。判定标准[7]:平均弹性模量值≥41.43 kPa 即为恶性病变。
1.2.2 CEUS 检查采用意大利百胜公司生产的MyLab Twice 彩色多普勒超声诊断仪进行CEUS 检查。将诊断仪调至超声造影模式。嘱患者保持静卧,经肘部浅静脉快速注射造影剂2.4 mL,随后冲注生理盐水5 mL,注射开始时即实时存贮动态图像,保存整个造影过程。保持探头在最佳切面(影像清晰切面平整),静置观察1 min 后移动探头观察其他切面至造影剂消失。对CEUS 图像进行定量分析,观察并记录达峰时间、峰值强度、明显减退时间。乳腺肿块重点分析病灶大小、边缘、形状、分布以及内部增强等特点。根据乳腺病灶超声造影评分标准[8]对乳腺肿块进行良恶性分级,其中4 ~5 分为恶性,1 ~3 分为良性。
1.2.3 超声乳腺影像报告和数据系统(BI-RADS分级)诊断标准[9]恶性征象:(1)病灶≥2 cm ;(2)内部回声不均匀;(3)边界不清晰且形态不规则;(4)存在微钙化灶;(5)纵径/横径>1 cm;(6)血流信号为Ⅱ~Ⅲ级。1 个恶性征象评为4A 类;2 个恶性征象评为4B 类;3 个及以上恶性征象评为4C类。
1.3 统计学方法使用SPSS 20.0 软件对数据进行统计分析。计量资料采用均数±标准差表示,采用受试者工作特征(ROC)曲线下面积(AUC)分析各参数的诊断价值,以P<0.05 为差异有统计学意义。
2 结果
2.1 病理检查结果112 例乳腺肿瘤患者中,病理检查结果显示良性肿瘤患者65 例,其中包括乳腺纤维腺瘤38 例,纤维囊性乳腺病13 例,乳腺炎10 例,乳腺导管内乳头状瘤4 例;恶性肿瘤患者47 例,包括乳腺浸润性导管癌36 例,乳腺导管内癌6 例,乳腺髓样癌3 例,黏液癌2 例。
2.2 常规超声诊断结果65 例良性肿块中,经BIRADS 分级:45 例表现为边界完整、形态规则、有包膜且回声均匀,20 例为4B 或4C 类;47 例恶性肿块中,经BI-RADS 分级:5 例4A 或4B 类,42 例4C 类。
2.3 良恶性乳腺肿瘤患者SWE定量指标比较恶性肿块组平均弹性值、最大弹性值明显高于良性肿块组(P<0.05);且两组患者最小弹性值比较,差异无统计学意义(P>0.05),见表1。
表1 良恶性乳腺肿瘤患者SWE 定量指标比较Tab.1 Comparison of quantitative indicators of real-time shear wave elastography in patients with benign and malignant breast tumors ±s,kPa
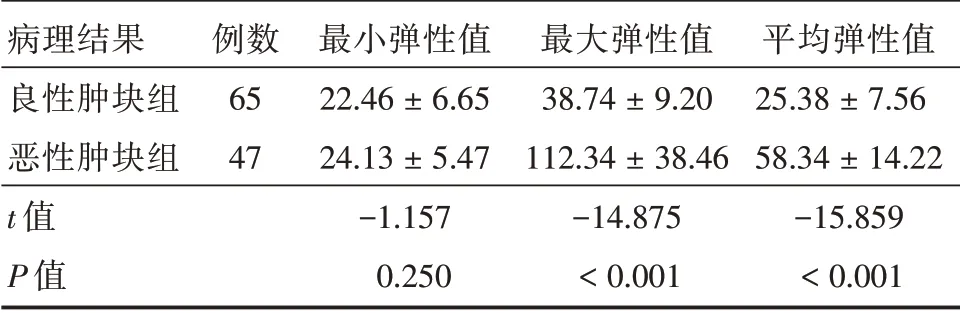
表1 良恶性乳腺肿瘤患者SWE 定量指标比较Tab.1 Comparison of quantitative indicators of real-time shear wave elastography in patients with benign and malignant breast tumors ±s,kPa
病理结果良性肿块组恶性肿块组t 值P 值例数65 47最小弹性值22.46±6.65 24.13±5.47-1.157 0.250最大弹性值38.74±9.20 112.34±38.46-14.875<0.001平均弹性值25.38±7.56 58.34±14.22-15.859<0.001
2.4 良恶性乳腺肿瘤实时CEUS 定量指标比较恶性肿块组峰值强度、明显减退时间明显高于良性肿块组(P<0.05),且达峰时间明显低于良性肿块组(P<0.05),见表2。
表2 良恶性乳腺肿瘤实时CEUS 定量指标比较Tab.2 Comparison of quantitative indexes of benign and malignant breast tumors in real-time contrast-enhanced ultrasound ±s
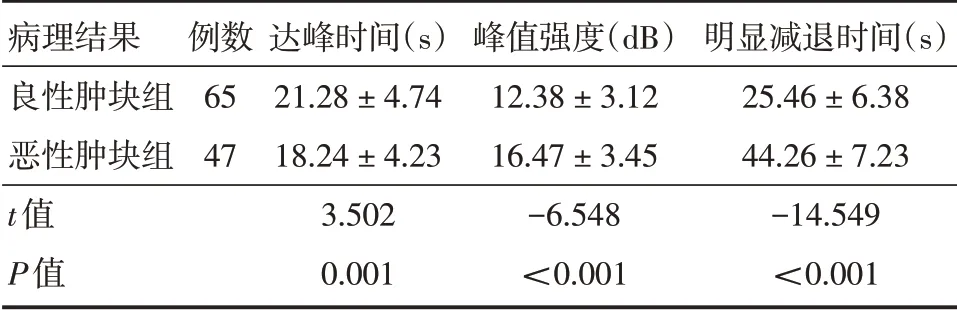
表2 良恶性乳腺肿瘤实时CEUS 定量指标比较Tab.2 Comparison of quantitative indexes of benign and malignant breast tumors in real-time contrast-enhanced ultrasound ±s
病理结果良性肿块组恶性肿块组t值P值例数65 47达峰时间(s)21.28±4.74 18.24±4.23 3.502 0.001峰值强度(dB)12.38±3.12 16.47±3.45-6.548<0.001明显减退时间(s)25.46±6.38 44.26±7.23-14.549<0.001
2.5 两种技术单独及联合检测的结果分析以病理诊断结果为金标准,SWE 检测结果恶性38 例(67.85%),良性47 例(83.92%);CEUS 检测结果恶性40 例(74.07%),良性51 例(87.93%);SWE、CEUS联合检测结果恶性43例(84.31%),良性57例(93.44%),见表3。

表3 两种技术单独及联合检测的结果分析Tab.3 Analysis of the results of the two technologies alone and combined detection 例
2.6 两种技术单独及联合检测的ROC曲线分析以病理结果为金标准,SWE 与CEUS 单独及联合检测诊断乳腺癌的AUC 值分别为0.766、0.818、0.896,见表4、图1。
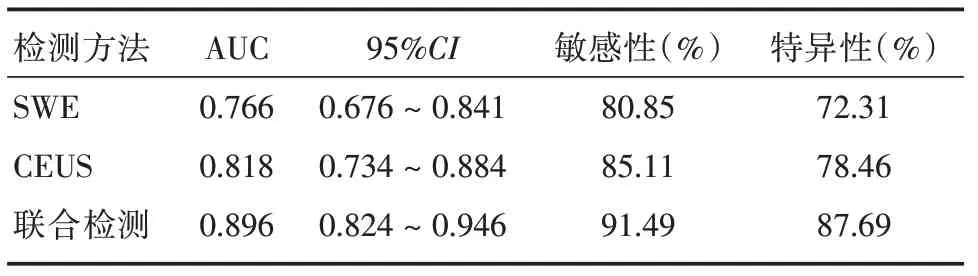
表4 两种技术单独及联合检测的ROC 曲线分析Tab.4 ROC curve analysis of the two technologies alone and combined detection

图1 两种技术单独及联合检测的ROC 曲线Fig.1 ROC curves of the two technologies individually and jointly
3 讨论
乳腺癌的发生、发展相对隐匿,多数患者被确诊时乳腺癌已发展为进展期,甚至已发生局部侵袭或远处转移,此时患者预后差,病死率较高。目前,国际上首选的乳腺癌筛查方法为乳腺钼靶X线摄影检查,但中国女性大多数为致密型乳腺,而钼靶摄影对致密型乳腺敏感性较低,无法清晰显示乳腺病灶的边缘,易出现漏诊、误诊的现象[10]。近年来,随着超声技术的不断发展,SWE、CEUS 被广泛应用于临床恶性肿瘤的诊断中,具有一定的诊断效能。为寻找更为准确、有效的乳腺癌诊断技术,本研究以乳腺组织病理检查为金标准,探讨SWE、CEUS 单独及联合对乳腺良恶性病灶的鉴别诊断价值。
SWE 通过构造独特的探头品片向组织发射声辐射脉冲波,间接通过施加外力而使组织发生形变,在组织不同深度连续聚焦形成“马赫椎”现象,从而产生剪切波,并测得剪切波在组织中的传播速度,从而得到组织的弹性模量——杨氏弹性模量值[11-15]。杨氏模量数值越大,表示组织硬度越大[16]。本研究结果发现,恶性肿瘤患者平均弹性值明显高于良性肿瘤患者。乳腺癌恶性肿瘤癌灶会向周围正常组织浸润,且其浸润性生长速度较快,细胞分裂增殖所需营养物质需求较大。一旦乳腺癌灶组织处血液供养不及时,肿瘤细胞因胞内组织代谢停止而死亡,导致肿物内部发生坏死,癌灶组织坏死后周围正常组织会分裂增殖成大量纤维细胞,并通过趋化作用聚集于癌灶组织坏死区以完成纤维性组织修复,因此乳腺癌灶处组织纤维组织含量较多,弹性较差,去除外力后返回原始状态缓慢,杨氏模量值较高,组织硬度较大。
张欢等[17]通过向患者肘静脉注射微泡造影剂,CEUS 微血管成像能够动态的显示患者病灶微血管内造影剂的分布状态及血管分布情况。因此,对患者进行CEUS 微血管成像检查,可实时、持续地掌握病变组织和正常组织的血流灌注情况,实现良恶性肿瘤的鉴别诊断[18]。本研究结果显示,恶性肿瘤患者峰值强度、明显减退时间明显高于良性肿瘤患者,达峰时间明显低于良性肿瘤患者,说明恶性肿瘤病灶组织处造影剂进入及灌注速度更快,肿瘤组织滋养血管内血容量更高。恶性肿瘤细胞生长较为迅速,癌灶组织对氧气、糖类等物质需求较大,故恶性肿瘤细胞会产生并释放大量血管生成因子,刺激肿瘤周边及内部生成大量幼稚细小、分布杂乱的新生血管,以满足其自身组织代谢对营养物质的需求。因此,乳腺癌癌灶组织内新生血管较多,造影剂进入病灶血管丰富区灌注速度更快,达峰时间较短,峰值强度更强,明显减退时间更长。而乳腺良性肿瘤则与乳腺恶性肿瘤相反,组织内穿行血管较少,造影剂分布均匀,达峰时间较长,峰值强度较低,明显减退时间更快。
另外,在本研究中,以病理诊断结果为金标准,SWE 漏诊9 例,误诊18 例,CEUS 漏诊7 例,误诊14 例,联合检测时漏诊4 例,误诊8 例;且据ROC 曲线分析,SWE 与CEUS 单独及联合诊断乳腺癌的AUC 值分别为0.766、0.818、0.896,说明SWE、CEUS 单独诊断虽具有一定的诊断效能,但仍存在一定局限性;相较于单独诊断,SWE 与CEUS 联合检测在乳腺癌中诊断效能更高,出现误诊、漏诊情况较少。SWE 以彩色弹性成像为基础,肿块表面凹凸不平或存在曲率较大的肿块,弹性图像容易发生变形,导致图像出现失真的情况,单独诊断时存在局限性[19];另据沈若霞等[20]的研究显示,因患者全身循环情况以及分析软件的不同等因素,导致CEUS 单独应用于恶性肿瘤的定量诊断时结果可能存在一定误差,两种技术单独应用的局限性与本研究结果类似。此外,石波等[21]的研究表明,SWE 与CEUS 联合诊断甲状腺小结节伴微钙化的AUC 值明显高于两种方法单独诊断,差异有统计学意义,说明SWE 与CEUS 联合诊断可提高甲状腺小结节伴微钙化临床诊断效能,其结果与本研究结果一致。
综上所述,SWE 和CEUS 技术均对乳腺癌具有一定的诊断价值,且两者联合应用对乳腺癌的诊断价值更高,有助于为临床评估乳腺癌的病情及选取治疗方案提供参考依据。但鉴于本研究纳入病例数量有限,所收集的临床数据可能存在一定的偏差,因此,还需后期扩大样本量,针对本研究SWE 和CEUS 技术联合检测仍存在误诊漏诊情况作更深入研究,进一步论证本研究论点。

