氯吡格雷联合阿司匹林精准用药与脑卒中患者短期预后的关系
王嘉晶 况杰 涂江龙 彭晨 陈积标 殷淑娟 张晓林 易应萍
南昌大学第二附属医院1信息处,3神经内科(南昌330006);2南昌大学公共卫生学院,江西省预防医学重点实验室(南昌330006)
脑卒中是一种复杂的神经系统疾病,具有高致残率[1]。其中急性缺血性脑卒中(AIS)占60%~80%,复发后致死和致残的风险是首发卒中的9.4 倍,严重影响了患者的生活质量[2]。治疗AIS 的常规抗血小板药物主要是氯吡格雷和阿司匹林,但是部分患者存在氯吡格雷或阿司匹林抵抗[3-4]。
氯吡格雷能有效抑制血小板聚集,预防卒中病情恶化和复发[5]。CYP2C19基因型与氯吡格雷的血小板抑制程度密切相关,携带CYP2C19*2、*3 失功能等位基因者的血小板抑制率要低于未携带者[7]。亚洲人群发生氯吡格雷抵抗的频率较高[8]。此外,约5%~65%的患者存在阿司匹林抵抗,该类患者对阿司匹林的抗血小板作用不敏感[9-10]。既往研究显示,氯吡格雷或阿司匹林抵抗会显著影响卒中预后[9-11]。目前尚无氯吡格雷联合阿司匹林精确抗血小板用药的效果研究[12]。
本研究采用多中心随机对照试验设计,旨在评估精准抗血小板用药对AIS 患者的短期疗效和用药安全性,为该病的精准抗血小板治疗提供循证依据和参考,从而改善患者预后,减轻家庭和社会负担。
1 资料与方法
1.1 研究设计本研究为多中心、随机对照临床研究,于2019年5月1 日 至2020年6月30 日在 江西省14 家医院(含7 个市区)的神经内科进行了病例招募,在第90 天进行随访。本临床研究经南昌大学第二附属医院伦理委员会审核批准后开始实施,所有患者均自愿参与,并签署知情同意书。临床试验注册:中国临床试验注册中心(注册号:ChiCTR-1900026492)。
1.2 研究对象
1.2.1 入组标准(1)年龄18 ~85周岁;(2)确诊患有缺血性脑卒中(动脉粥样硬化性脑梗死)[13];(3)发病急性期内(2周)[14];(4)NIHSS评分≤15分[15]。
1.2.2 排除标准(1)癌症患者;(2)心源性脑梗死、小血管病变性脑梗死、其他病因型脑梗死以及不明原因型脑梗死患者;(3)胃溃疡以及十二指肠溃疡病患者;(4)近2 周内溶栓患者以及一些必须抗凝或者双联抗血小板(行PCI 术)的患者;(5)出血性脑卒中、混合性脑卒中和瘤卒中者;(6)合并有严重的心、肺、肾、肝脏系统疾病者;(7)对阿司匹林过敏者;(8)目前参与有关研究性药物或医疗器械的任何临床试验的患者。
1.2.3 样本量估算缺血性脑卒中患者的90 d 复发率:干预组为6.7%,对照组为12.4%[12]。检验效能1-β = 0.90,检验水准α = 0.05。根据公式,算得每组各需要417 例,共需要834 例。假设90 d 失访率为15%,设计效应值为1.25[16],因此得到研究所需最低样本量为1 199 例。
1.2.4 随机分组分组采用了随机种子数法,筛选合格的患者按1∶1 比例随机分至研究组和对照组。
1.3 疗效及安全性评估本研究在患者出院后第90 天开展了随访,记录疗效、安全性指标。疗效指标是卒中复发事件(经CT/MRI 确认有新发病灶)和mRS 评分(预后不良:mRS 评分≥3 分;预后良好:mRS 评分≤2 分)[17]。安全性指标是与服用抗血小板药物相关的出血事件,包括致死性出血事件(颅内、腹腔、胃肠道出血等)以及轻微出血事件(血尿症,口腔、鼻腔出血等),参照国际出血事件分类ICD-9 编码。
1.4 CYP2C19 基因检测、尿11-dhTxB2 检测CYP2C19 含有三个单核苷酸多态性位点,包括CYP2C19*2、CYP2C19*3 和CYP2C19*17,本研究使用飞行质谱法对研究组患者进行了基因位点测序,分为CYP2C19*1、*2、*3、*17四类基因型。既往临床研究显示,携带*2 或*3 失功能等位基因患者对氯吡格雷存在抵抗[3,12]。患者根据CYP2C19 基因型可以分为4 种(氯吡格雷)代谢型:(1)超快代谢型:*1/*17,*17/*17;(2)正常代谢型:*1/*1;(3)中等代谢型:*1/*2,*1/*3;(4)弱代谢型:*2/*2,*2/*3,*3/*3[12]。
尿11-dhTxB2是TXA2的稳定代谢产物,其在血浆和尿液中的水平不受体外血小板活化影响,是反映人体内血小板活化状态和阿司匹林代谢功能的理想指标。本研究通过尿11-dhTxB2的浓度筛选阿司匹林耐药性,11-dhTxB2/尿肌酐≥1 500 pg/mg 定义为阿司匹林抵抗,反之则不存在。
1.5 干预措施患者在入院后21 d 内均进行氯吡格雷联合阿司匹林抗血小板治疗。在研究组患者入组后第1 ~7 天,采集5 mL 静脉血,进行CYP2C19 基因型检测;在患者规律服用阿司匹林第8 天,采集随机尿2 ~5 mL,进行尿11-dhTxB2 检测。待研究组患者入院21 d 后,医生会根据检测结果对患者进行精准抗血小板用药:若患者仅存在阿司匹林抵抗,则调整为氯吡格雷单抗治疗(75 mg/d);若患者仅存在氯吡格雷抵抗,则调整为阿司匹林单抗治疗(100 mg/d);若患者均不抵抗,则服用阿司匹林100 mg/d 或氯吡格雷75 mg/d[13];若患者均抵抗,则建议医生使用替代药物(替格瑞洛180 mg/d 或西洛他唑200 mg/d)。本研究的对照组患者按临床指南进行常规抗血小板治疗。
1.6 统计学方法使用Stata 14.0 软件。若计量资料符合正态分布,以均数±标准差表示,比较采用t检验;若为偏态分布,以M(P25,P75)表示,比较采用Wilcoxon 秩和检验。计数资料采用例(%)描述,比较采用χ2检验。同时采用意向性分析数据集、符合方案数据分析集对两组的疗效、安全性进行分析。P<0.05 为差异有统计学意义。
2 结果
2.1 研究病例基本情况本研究招募了1 472 例符合入组标准的患者,其中研究组722 例,对照组750 例。在入组患者中,有45 例患者脱落,1 428 例患者进入随访流程。在入组后第90 天开展了随访,总失访率约为3.1%(44/1428),对照组约为3.2%(23/723),研究组约为3.0%(21/705),两组失访率的差异无统计学意义(P>0.05)。此外,有15 例患者因自觉恢复良好、不方便买药等原因停止了服用抗血小板药物,劝说无果从而终止研究,其中研究组6 例,对照组8 例。本研究最终随访成功并记录1 370 例患者,其中研究组678 例,对照组692 例,作为符合方案集。具体入组流程见图1。
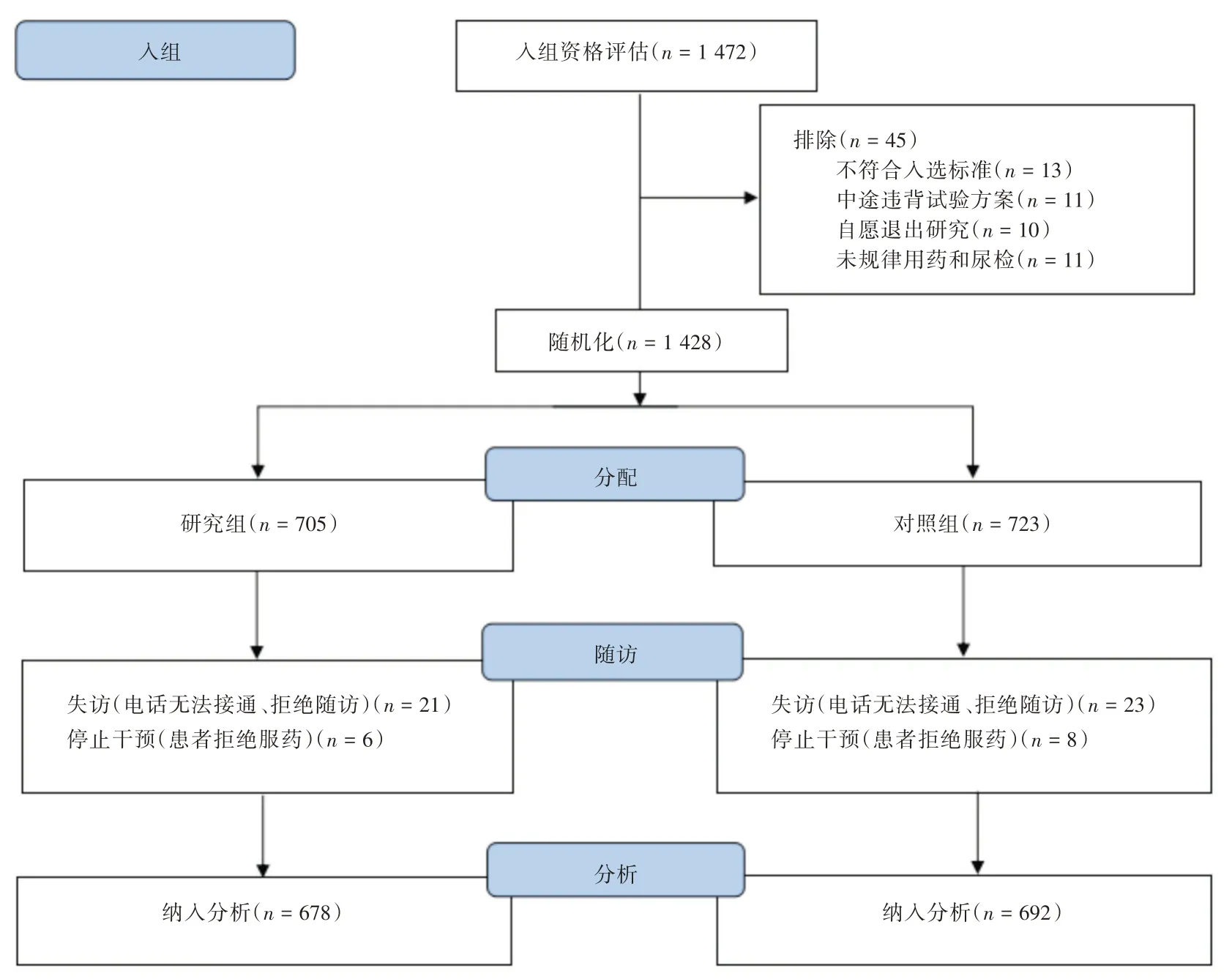
图1 研究入组流程图Fig.1 Study enrollment flowchart
2.2 研究组患者的CYP2C19 基因型、阿司匹林抵抗分布频率在研究组患者中,携带中等代谢型基因的患者占比最多,达48%(337/705);其次是正常代谢型基因者,占比为39%(273/705);再次是携带弱代谢型基因者,占比为13%(91/705);携带超快代谢型基因的患者最少,占比不到1%,仅有4 例。本研究存在氯吡格雷抵抗的患者占61%(428/705),见图2。此外,存在阿司匹林抵抗的患者达9.4%(66/705),远低于氯吡格雷抵抗的频率。
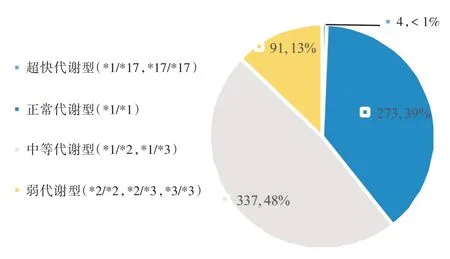
图2 研究组患者的CYP2C19 基因型分布频率Fig.2 CYP2C19 genotype distribution frequency of patients in the experimental group
2.3 研究组和对照组患者的基线特征比较研究组和对照组的基线资料比较差异均无统计学意义(P>0.05),具有均衡可比性。见表1-2。
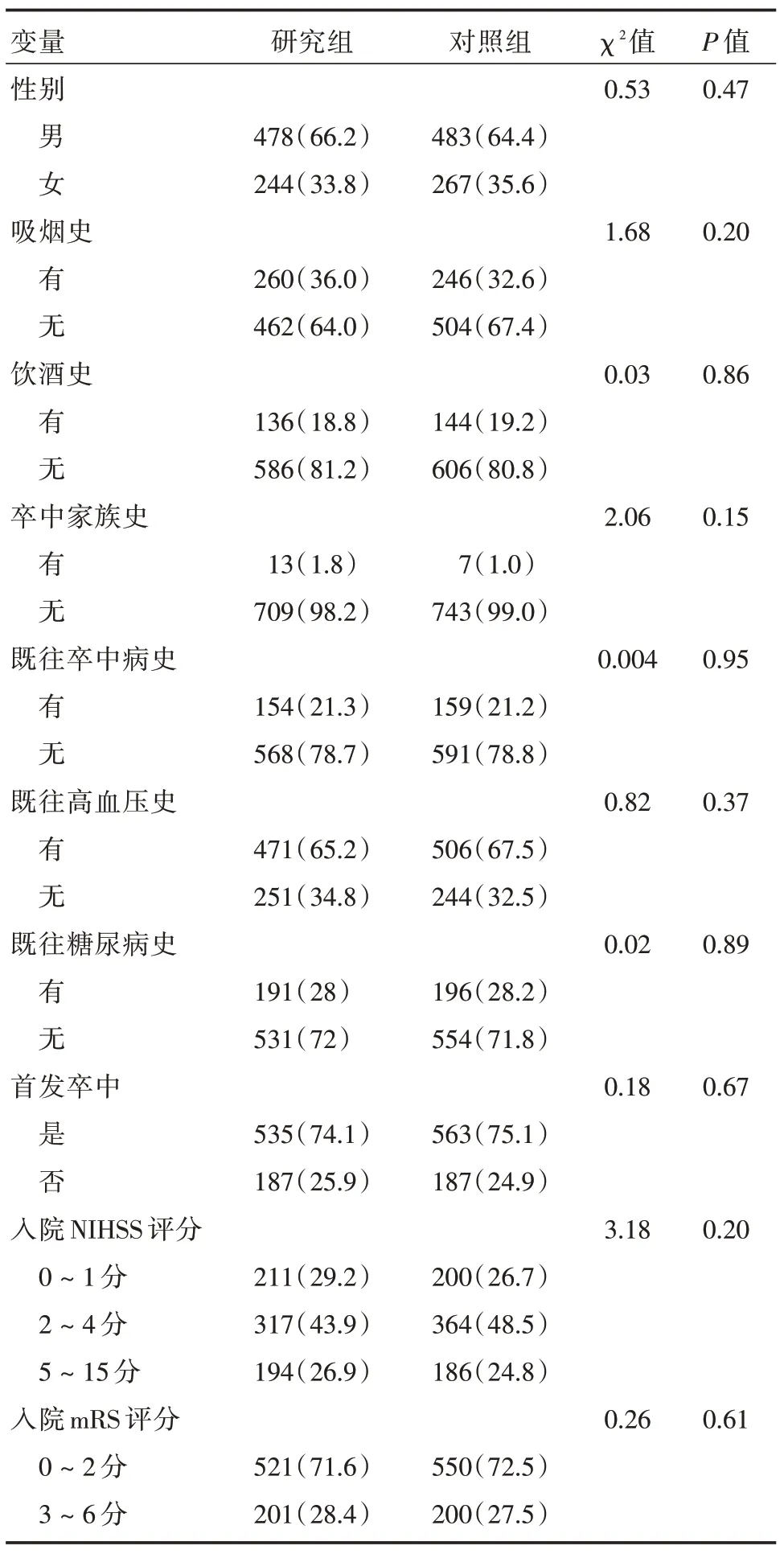
表1 两组的基线资料对比Tab.1 Comparison of baseline data 例(%)
2.4 疗效分析
2.4.1 精准抗血小板用药对短期复发的影响本研究的疗效分析采用符合方案集。研究结果显示,研究组患者的复发率为4.1%(28/678),对照组患者的复发率为4.5%(31/692),差异无统计学意义(P= 0.75),精准抗血小板用药对AIS 患者短期复发的概率没有显著影响。
2.4.2 精准抗血小板用药对短期预后的影响研究结果显示,研究组的预后不良发生率17.7%(120/678),对照组的预后不良发生率为23.6%(163/692),差异具有统计学意义(P= 0.007),精准抗血小板用药可以有效改善AIS 患者的短期预后,促进功能恢复。本研究的意向性分析(ITT)结果和符合方案集分析(PP)结果一致,见图3。
2.5 安全性分析本研究患者的短期出血事件发生率约为2.6%(35/1 346),其中包括脑出血3 例,消化道出血7 例,皮肤黏膜出血7 例,口腔/鼻腔出血18 例。研究组出血事件发生率约为2.4%(16/664),对照组的发生率约为2.8%(19/682),差异无统计学意义(P=0.67)。精准抗血小板用药对AIS患者的短期安全性无显著影响。
3 讨论
本研究的研究组患者中携带CYP2C19*2 或*3基因的患者占比达61%,存在阿司匹林抵抗的频率为9.4%。精准抗血小板用药治疗对AIS 患者短期复发的影响差异无统计学意义(P= 0.75),但是可以有效改善短期预后(P= 0.007),总体上可以有效促进AIS 患者的功能恢复,降低致残率。同时,精准抗血小板用药对出血事件的发生率没有显著影响(P= 0.67),没有增加出血风险,安全性较高,适合在临床上推广使用。
表2 两组的基线资料对比Tab.2 Comparison of baseline data ±s
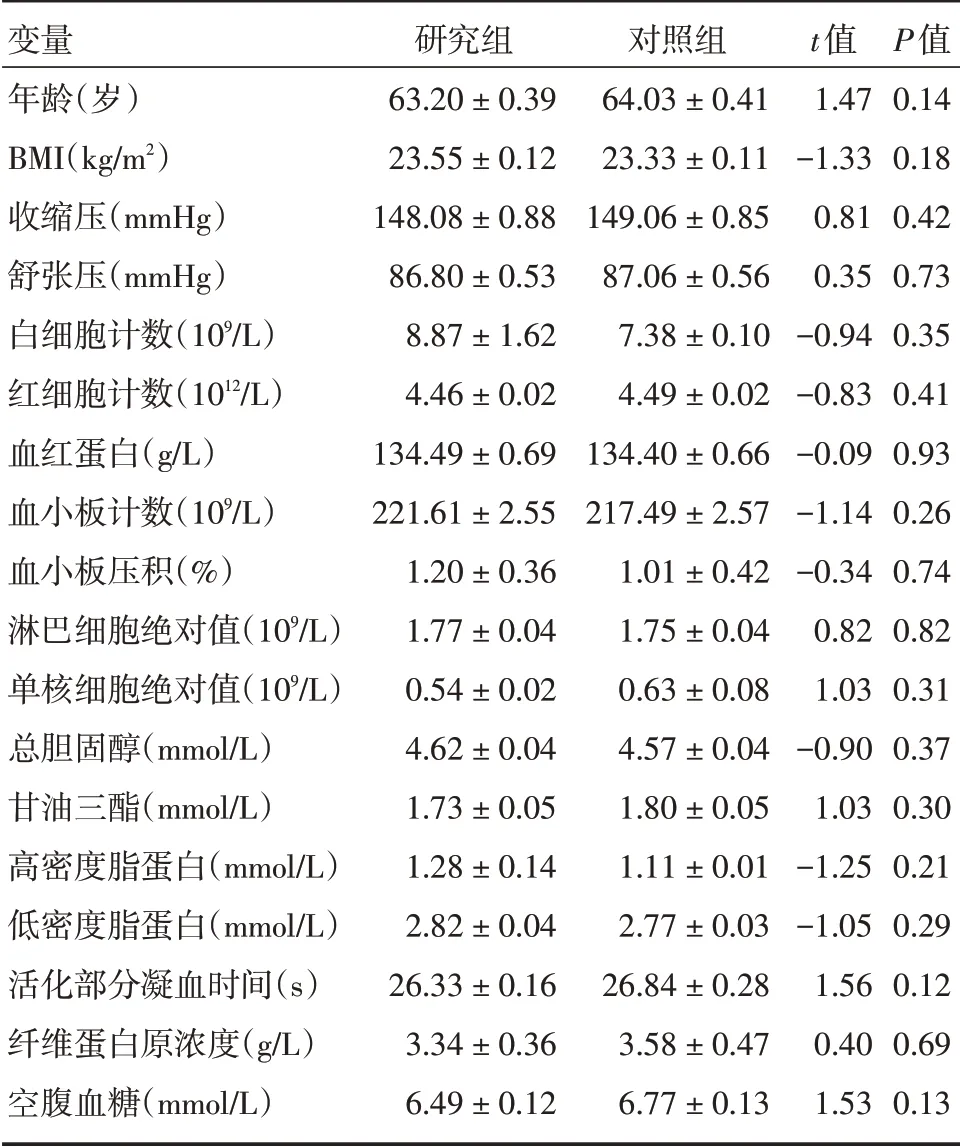
表2 两组的基线资料对比Tab.2 Comparison of baseline data ±s
变量年龄(岁)BMI(kg/m2)收缩压(mmHg)舒张压(mmHg)白细胞计数(109/L)红细胞计数(1012/L)血红蛋白(g/L)血小板计数(109/L)血小板压积(%)淋巴细胞绝对值(109/L)单核细胞绝对值(109/L)总胆固醇(mmol/L)甘油三酯(mmol/L)高密度脂蛋白(mmol/L)低密度脂蛋白(mmol/L)活化部分凝血时间(s)纤维蛋白原浓度(g/L)空腹血糖(mmol/L)研究组63.20±0.39 23.55±0.12 148.08±0.88 86.80±0.53 8.87±1.62 4.46±0.02 134.49±0.69 221.61±2.55 1.20±0.36 1.77±0.04 0.54±0.02 4.62±0.04 1.73±0.05 1.28±0.14 2.82±0.04 26.33±0.16 3.34±0.36 6.49±0.12对照组64.03±0.41 23.33±0.11 149.06±0.85 87.06±0.56 7.38±0.10 4.49±0.02 134.40±0.66 217.49±2.57 1.01±0.42 1.75±0.04 0.63±0.08 4.57±0.04 1.80±0.05 1.11±0.01 2.77±0.03 26.84±0.28 3.58±0.47 6.77±0.13 t值1.47-1.33 0.81 0.35-0.94-0.83-0.09-1.14-0.34 0.82 1.03-0.90 1.03-1.25-1.05 1.56 0.40 1.53 P值0.14 0.18 0.42 0.73 0.35 0.41 0.93 0.26 0.74 0.82 0.31 0.37 0.30 0.21 0.29 0.12 0.69 0.13
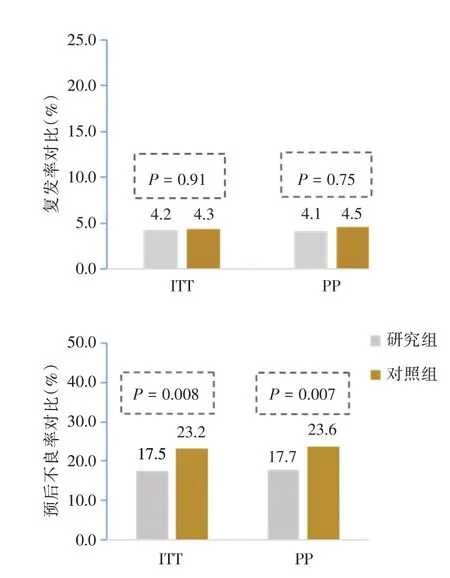
图3 对疗效的意向性分析(ITT)和符合方案集分析(PP)结果对比Fig.3 Comparison between results of intentional analysis(ITT)and per-protocol analysis(PP)
本研究中氯吡格雷、阿司匹林抵抗的频率与既往研究相近[11-12]。同时,在既往针对氯吡格雷精准用药的研究中,研究组(调整氯吡格雷用药)患者的预后不良发生率显著低于对照组患者(P<0.05)[18]。本研究结果与既往研究一致,但进一步扩大了样本量、增加了阿司匹林抵抗和结局指标,在江西省的AIS 患者人群中探索了精准抗血小板用药的疗效和安全性。本研究对氯吡格雷和阿司匹林同时进行抵抗性检测和调整用药,有利于在临床上辅助精准医疗决策,改善AIS 患者的疾病预后。
本研究结果具有一定的临床指导意义:在对AIS 患者的临床治疗中,应适当推广氯吡格雷和阿司匹林抵抗筛查检测,建议综合考虑患者的经济和疾病情况来决定是否做筛查检测。检测前需确保患者规律服用阿司匹林达7 d 及以上,避免尿11-dhTxB2 检测假阴性。针对存在氯吡格雷或阿司匹林抵抗的患者,建议开展精准抗血小板用药治疗。患者出院后需加强院外随访,保证药物依从性,谨防出血事件。
本研究存在局限性:研究病例均来自江西省的三级甲等综合性医院,医疗技术水平和患者依从性较高,未能反映江西省卒中患者的总体情况,应进一步扩展病例来源,选取二级、一级医院作为研究单位。
综上所述,精准抗血小板用药治疗可以有效改善AIS 患者的短期预后,建议医生对存在氯吡格雷或阿司匹林抵抗的AIS 患者开展精准用药,以改善这类患者的临床预后。建议下一步研究可以探索精准用药对一年或更长时间内的复发、预后、出血、抑郁、血小板聚集率等综合指标的影响。

