胃癌伴左锁骨上淋巴结转移患者的临床病理特征及预后
丁平安 杨沛刚 田园 胡奕炀 郭洪海 刘洋 张志栋 王冬 李勇 赵群
河北医科大学第四医院外三科(石家庄050011)
我国进展期胃癌患者比例高,转移性胃癌约占新发胃癌病例的40%[1-2]。淋巴结转移是胃癌转移的主要途径,也是影响胃癌患者预后最重要的因素之一。有文献报道,进展期胃癌的淋巴结转移率高达70%左右,在终末期可经胸导管向左锁骨上淋巴结转移,此类患者已失去手术治疗机会,预后较差[3-4]。既往有关胃癌伴左锁骨上淋巴结转移的文献报道较少,本研究通过回顾性分析286 例胃癌伴左锁骨上淋巴结转移患者的临床资料,探讨其疾病预后相关因素,以为胃癌伴左锁骨上淋巴结转移患者的诊治策略提供参考依据。
1 资料与方法
1.1 一般资料纳入标准:(1)经胃镜咬检病理证实为癌,术前未接受过抗肿瘤治疗;(2)术前浅表淋巴结B 超检查提示左锁骨上淋巴结肿大,同时穿刺病理证实为胃癌转移;(3)术前经全腹及胸部CT 排除远处其他脏器转移;(4)接受过腹腔镜探查及腹腔脱落细胞学检测,同时临床病历资料完整;(5)可获得详细的随访资料,有明确的起始时间、终点时间和终点状态。本研究符合《赫尔辛基宣言》原则及相关伦理要求。
1.2 研究方法检索河北医科大学第四医院外三科自2010-2019年录入的胃癌数据库,筛选出经超声引导穿刺病理证实为左锁骨上淋巴结转移,收集患者性别、年龄、肿瘤位置、肿瘤组织学类型、肿瘤大小、Borrmann 分型、浸润深度(cT 分期)、胃周淋巴结转移情况(cN 分期)、血清中肿瘤标志物CEA、AFP、CA19-9、CA72-4 表达情况、末次随访时间、疾病进展时间以及死亡时间等。
1.3 治疗方法及结果判定
1.3.1 治疗方法所有患者均在全身麻醉下进行腹腔镜探查术,根据探查结果决定下一步治疗。若腹腔镜探查后为P0CY0,则术后进行以氟尿嘧啶类为主的转化治疗,化疗方案包括:XELOX、SOX、FLOT、FOLFOX;若腹腔探查后为P0CY1及P1CY1,则先行3 次HIPEC 治疗(腹腔注药均为紫杉醇注射液,剂量75 mg/m2),休息2 周后进行全身性化疗,化疗方案选择与P0CY0组相同。
1.3.2 腹腔镜探查术[5]左右膈顶→肝脏表面、脾脏→壁层腹膜→盆腔→大网膜、小肠及系膜→横结肠系膜→局部病灶。探查内容:肝表面有无转移灶,壁层腹膜、小肠及横结肠系膜、大网膜和盆腔Douglas 窝有无转移灶,腹盆腔有无原发性腹水,胃周是否存在肿大淋巴结,癌灶是否侵透浆膜。必要时以抓钳触及胃壁是否僵硬,对可疑组织可进行钳取送检病理学检查。腹腔冲洗脱落细胞学检查:以500 mL 灭菌0.9%氯化钠溶液分别冲洗左右膈顶、腹盆腔壁层腹膜、小肠及横结肠系膜,冲洗过程中避免直接冲洗局部病灶。取头高脚低位,使用吸引器分别于Douglas 窝、肝下及脾窝收集冲洗液,立即送检病理科,细胞学检查有无脱落的癌细胞。
1.3.3 腹腔脱落细胞学结果判定病理科2 名专业医师阅片,胃癌腹腔脱落细胞染色的阳性结果主要包括:核大深染,核浆比例失调;核染色质致密、粗糙,分布不均,排列紊乱;核膜增厚,出现中断或皱折;核仁增多等。腹腔细胞学检测结果阳性者记录为CY1,阴性记录为CY0。
1.3.4 腹膜转移组织结果判定完整切除可疑腹膜转移组织,病理诊断均由2 名病理科医师阅片后予以证实。若活检组织经HE染色及免疫组化提示来源于消化道,则定义为P1,阴性则定义为P0。
1.4 随访所有患者经门诊、住院和电话随访等方式收集随访资料。随访时间自发现胃癌伴左锁骨上淋巴结转移开始,截至死亡终点或2020-01-01。2年内每月电话随访1 次,每6 个月门诊复查1 次。2年后每3 个月电话随访1 次,每6 个月门诊随访1 次。随访时间为1~52 个月,中位随访时间为9 个月,失访9 例,随访率为96.85%。
1.5 统计学方法采用SPSS 21.0 对数据进行统计学处理。计数资料采用χ2检验,计量资料采用t检验。采用Kaplan-Meier 法绘制生存曲线,单因素生存分析采用Log-rank 检验,多因素生存分析采用Cox 回归模型。以P<0.05 为差异有统计学意义。
2 结果
2.1 临床病理特征符合入组标准的胃癌伴左锁骨上淋巴结转移患者286 例,占同期收治胃癌患者总数2.62%。其中男157 例(54.90%),女129 例(45.10%);中位年龄59 岁,其中≤50 岁185 例(64.69%),>50 岁101 例(35.31%);病灶部位位于贲门79 例(27.62%),胃体69 例(24.13%),胃窦91例(31.82%),全胃47 例(16.43%);病灶≥5 cm 者192例(67.13%),<5 cm者94例(32.87%);Borrmann分型为Ⅰ~Ⅱ型103 例(36.01%),Ⅲ~Ⅳ型183 例(63.99%);肿瘤浸润深度:cT2期15 例(5.24%),cT3期68 例(23.78%),cT4a期121 例(42.31%),cT4b期82例(28.67%);淋巴结转移:cN0期有41例(14.34%),cN+期有245 例(85.66%);高-中分化腺癌65 例(22.73%),低-未分化腺癌221例(77.27%)。血清中肿瘤标志物AFP 升高者22 例(7.69%),CEA 升高者65 例(22.73%),CA19-9 升高者69 例(24.13%),CA72-4升高者75例(26.22%)。
2.2 治疗情况286 例胃癌伴左锁骨上淋巴结转移患者中277 例(96.85%)获得随访,全组277 例患者均进行了腹腔镜探查分期术及腹腔脱落细胞学检测,发现P0CY0167 例(60.29%),P0CY169 例(24.91%),P1CY141 例(14.80%)。167 例P0CY0患者中共149 例(89.22%)患者接受化疗,中位化疗周期数为4 个(95%CI:1.3 ~6.9 个月),余18 例患者均对症综合治疗。69 例P0CY1患者及41 例P1CY1患者腹腔镜探查及腹腔脱落细胞学检测结束后,其中53 例(76.81%)P0CY1患者及32 例(78.05%)P1CY1患者在HIPEC 治疗结束后接受化疗,其中位化疗周期数分别为5 个(95%CI:1.6 ~8.4 个月)、6 个(95%CI:1.9 ~9.7 个月),余患者均给予保守治疗。全组患者经转化治疗后行手术治疗者31 例(11.19%),其中行R0 切除者10 例(3.61%),R1 切除者11 例(3.97%),R2 切除者10 例(3.61%)。见图1。
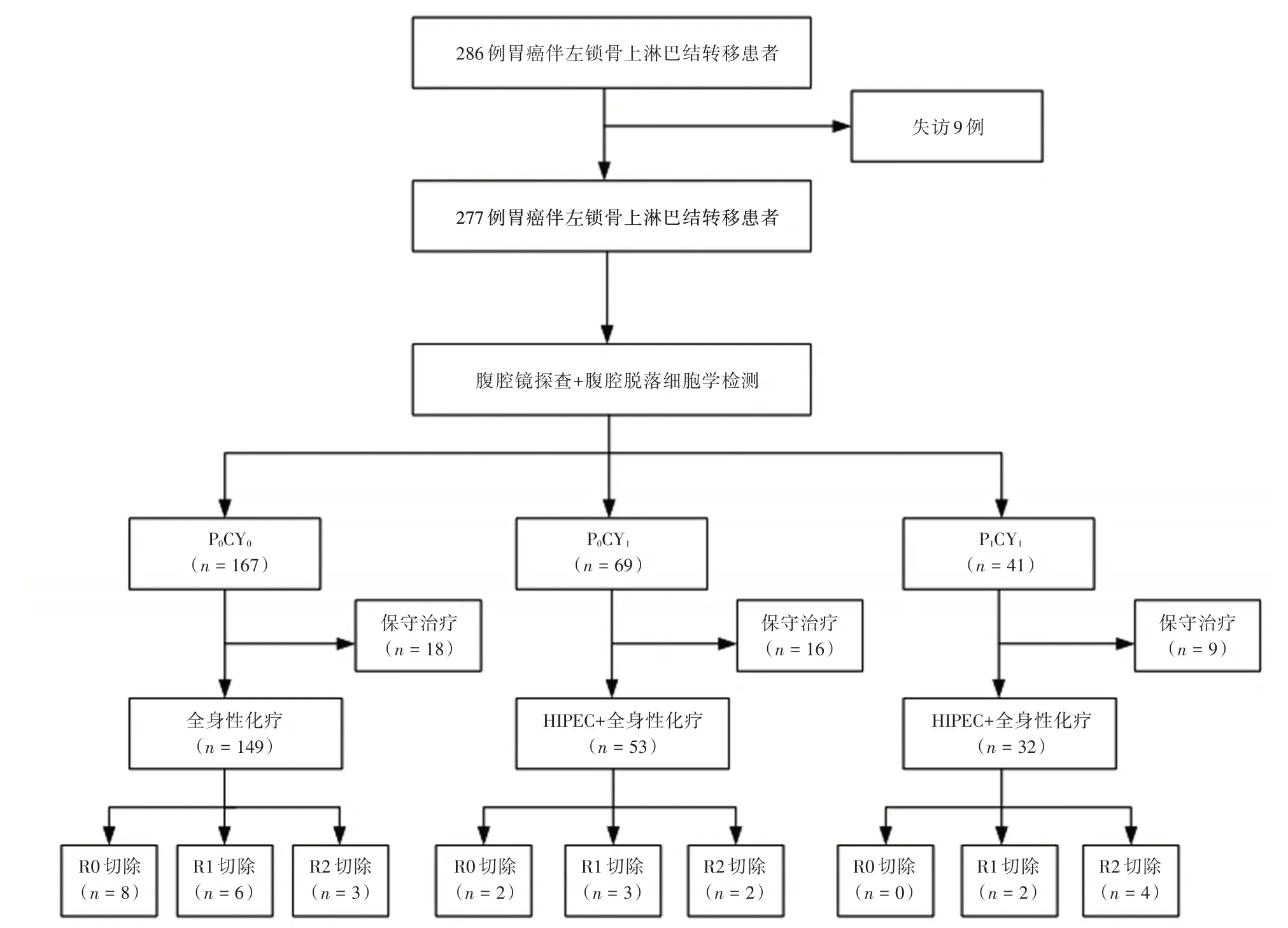
图1 286 例胃癌伴左锁骨上淋巴结转移患者诊治情况Fig.1 Diagnosis and treatment of 286 cases of gastric cancer with left supraclavicular lymph node metastasis
2.3 生存情况277例(96.85%)获得完整随访资料的胃癌伴左锁骨上淋巴结转移患者,其2年OS 为51.26%、2年PFS 为42.24%;其中经腹腔镜探查为P0CY0患者2年OS、PFS分别为61.68%、42.03%,而探查发现为P0CY1、P1CY1患者2年OS 分别为42.03%、27.03%,2年PFS 分别为28.99%、10.81%,三组之间2年OS、PFS 差异有统计学意义(均P<0.05),见图2A、3A。根据治疗方式的不同进行亚组分析发现,P0CY0患者行全身性化疗者2年OS、PFS 分别为65.77%、61.74%,明显优于保守治疗患者2年OS、PFS(均P<0.05),见图2B、3B;P0CY1、P1CY1患者中行HIPEC+全身性化疗者2年OS 分别为49.06%、28.13%,2年PFS分别为33.96%、21.88%,均较保守治疗患者2年OS、PFS 明显延长(均P<0.05),见图2C-D、3C-D。随访期间共有156 例出现病情进展,其中出现肝转移32例(20.51%),腹膜转移39 例(25.00%),局部病变进展67 例(42.95%),肺转移26 例(16.67%),骨转移12 例(7.69%)。

图2 胃癌伴左锁骨上淋巴结转移组患者2年总生存曲线Fig.2 2-year overall survival curve of patients with gastric cancer with left supraclavicular lymph node metastasis
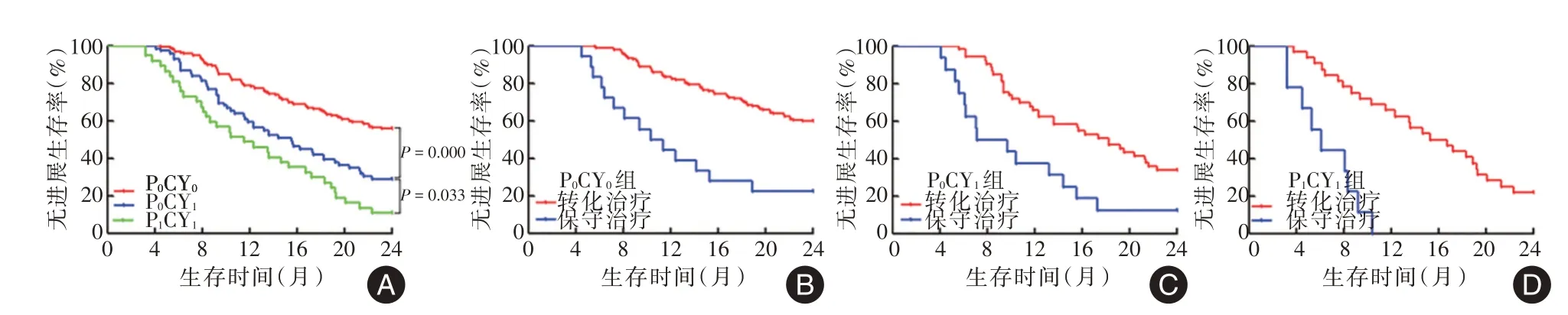
图3 胃癌伴左锁骨上淋巴结转移组患者2年无进展生存曲线Fig.3 2-year progression-free survival curve of patients with gastric cancer with left supraclavicular lymph node metastasis
2.4 影响生存预后的单因素及多因素分析单因素分析结果显示,肿瘤直径大小、浸润深度cT 分期、Borrmann 分型、肿瘤组织学类型、淋巴结转移情况、血清肿瘤标志物CEA、CA19-9、CA72-4 值表达情况、是否合并腹腔脱落细胞学阳性及腹膜转移、是否接受转化治疗(包括全身性化疗或全身性化疗+HIPEC 化疗)、是否行R0 手术治疗与胃癌伴左锁骨上淋巴结转移患者的预后有关联,差异有统计学意义(均P<0.05),而与患者性别、年龄、肿瘤病灶部位、血清肿瘤标志物AFP 表达情况无关(均P>0.05),见表2。Cox 回归多因素分析结果显示,肿瘤组织类型为低分化-未分化类型(P=0.014)、浸润深度为cT4a~cT4b期(P=0.002)、肿瘤标志物CEA 表达阳性(P= 0.024)和合并腹腔脱落细胞学阳性及腹膜转移(P= 0.001)是影响胃癌伴左锁骨上淋巴结转移患者预后的独立危险因素,而接受转化治疗(包括全身性化疗或全身性化疗+HIPEC 化疗)(P= 0.001)及行R0 手术治疗是影响患者预后的保护性因素(P= 0.001),见表3。
3 讨论
由于胃癌早期缺乏明显的临床症状,大多数患者就诊时已处于中晚期[6]。对于胃癌患者初期诊治中,均应进行锁骨上淋巴结超声检查,通过回顾性分析本中心近10年录入的胃癌数据库发现胃癌同时性伴左锁骨上淋巴结转移患者有286 例,占同期收治胃癌患者总数2.62%。当胃癌合并左锁骨上淋巴结转移时,临床分期已处于Ⅳ期,失去了根治性手术机会,是一种特殊类型的胃癌。有研究显示,晚期胃癌易发生腹膜种植转移、血性转移及淋巴转移,一旦转移,预后极差,胃癌腹膜转移患者的中位生存期一般为4 ~6 个月[7-8]。曹亮等[9]报道53 例胃癌肝转移患者5年生存率仅为11.3%。钟华强等[10]报道97 例胃癌骨转移患者的中位生存期为6.3 个月。本研究结果显示,胃癌伴左锁骨上淋巴结转移患者中位生存期为13.7 个月,晚期转移性胃癌的预后不容乐观。
既往相关研究表明[11],在乳腺癌伴左锁骨上淋巴结转移患者中,肿瘤组织学类型差,ER 及HER2 状态的表达是影响其预后的危险因素。同样在食管癌及肺癌等也有类似的相关报道[12-13],但是关于胃癌伴左锁骨上淋巴结转移患者预后的危险因素分析现无相关文献报道。本研究中多因素分析显示,肿瘤组织学类型差、局部病灶大小≥5 cm、肿瘤标志物CEA 及CA19-9 的阳性表达、同时合并腹膜转移或发生腹腔脱落细胞学阳性均是影响胃癌伴左锁骨上淋巴结转移患者预后的危
险因素。与分化程度较高的胃癌相比,低分化及未分化胃癌伴左锁骨上淋巴结转移患者生存期更短,与既往相关报道一致[14-15]。有文献报道[16],血清中癌胚抗原CEA,是一种富含多糖的蛋白复合物,对胃癌的预后具有意义,与进展低分化腺癌相关,亦与肿瘤大小、浆膜面浸润、淋巴结转移相关,而糖类抗原CA19-9 是一类含黏液成分的大分子糖蛋白,与肿瘤大小、淋巴结转移及浸润深度相关,是胃癌患者独立判定预后的指标,血清中高水平的CA19-9 提示胃癌患者生存期缩短,可与其他指标联合应用提示胃癌的腹膜复发、腹腔种植,本研究中多因素分析显示血清中CEA 及CA19-9 的阳性表达是胃癌伴左锁骨上淋巴结转移患者预后不好的危险因素。同时胃癌伴左锁骨上淋巴结转移患者往往合并腹腔转移,本研究中277 例患者在全身性化疗前进行了腹腔镜探查分期术及腹腔脱落细胞学检测,探查发现发生腹腔脱落细胞学阳性者(CY1)69 例,合并腹膜转移(P1)41 例,同时与P0CY0患者相比,三者之间预后具有明显差异,发生腹膜转移或腹腔脱落细胞学阳性均是影响预后的危险因素。因此对于胃癌伴左锁骨上淋巴结转移确诊患者,除了进行全腹及胸部增强CT 扫描外,需再次进行腹腔镜探查分期术。这将对于合并CY1 或P1 的患者提供更多的治疗方案,例如HIPEC 治疗或NIPS 治疗,这将提高转化成功的几率,进而提高患者的生存时间。
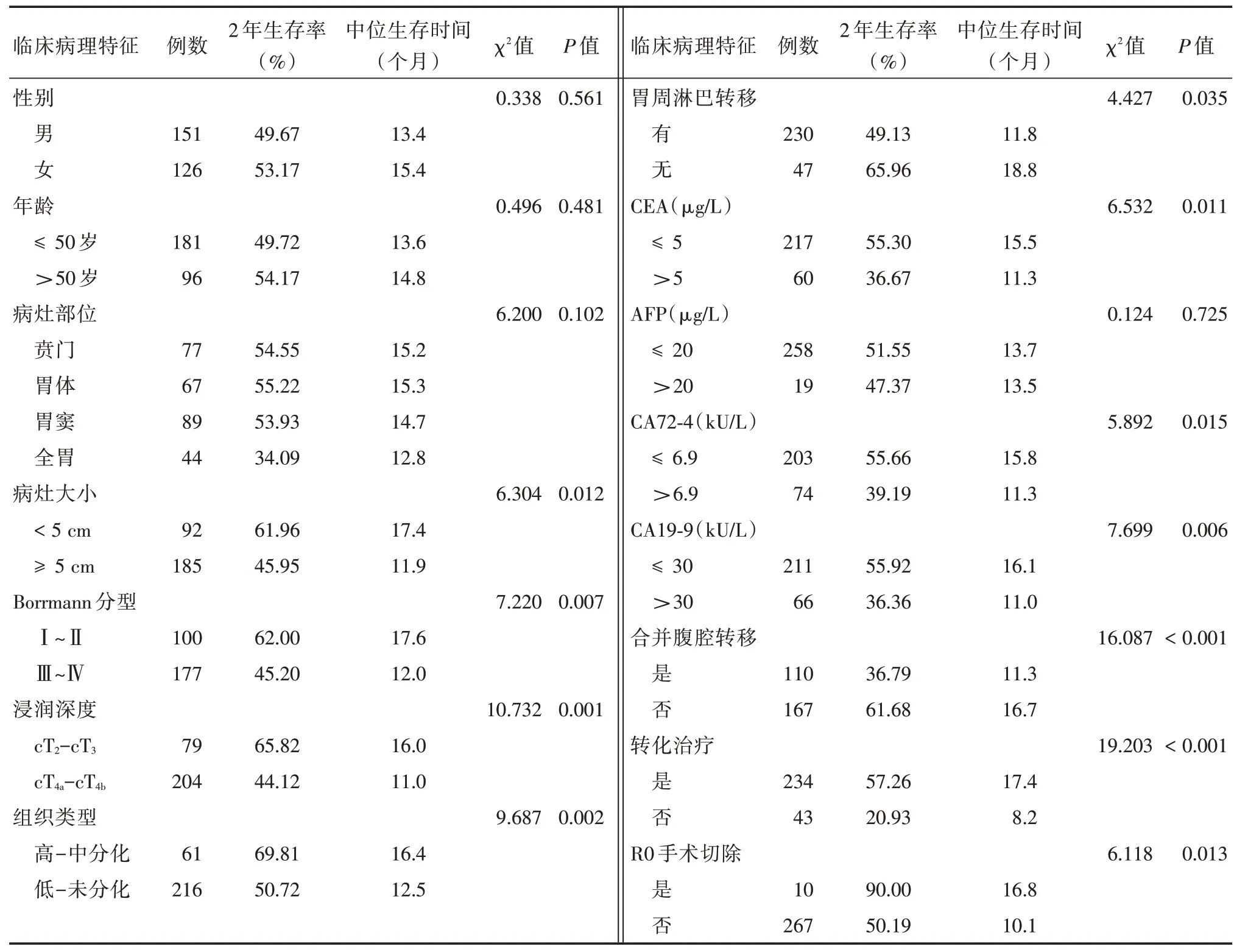
表2 影响277 例胃癌伴左锁骨上淋巴结转移患者预后的单因素分析Tab.2 Single factor analysis of the prognosis of 277 cases of gastric cancer with left supraclavicular lymph node metastasis

表3 影响277 例胃癌伴左锁骨上淋巴结转移患者预后的Cox 回归多因素分析Tab.3 Multivariate analysis of Cox regression affecting the prognosis of 277 cases of gastric cancer with left supraclavicular lymph node metastasis
本研究初步探讨了影响胃癌伴左锁骨上淋巴结转移患者预后的相关危险因素,但还存在一定的不足。首先,本研究为单中心研究,样本量较少,可能造成研究结果出现偏倚;其次,本研究为非前瞻性对照研究,而是一项回顾性研究。因此期待通过多中心、大样本和前瞻性研究来进一步证实,为胃癌伴左锁骨上淋巴结转移患者的临床诊治策略提供更好的参考依据。
综上所述,胃癌伴左锁骨上淋巴结转移患者的预后差。肿瘤组织学类型差、肿瘤标志物CEA的阳性表达、同时合并腹膜转移或发生腹腔脱落细胞学阳性均是影响患者预后的危险因素。临床上应高度重视,定期随访,尽量做到早发现、早治疗,同时在进行全身性化疗前应进行腹腔镜探查分期术及腹腔脱落细胞学检测,明确腹腔是否同时合并转移。胃癌伴左锁骨上淋巴结转移患者可从转化化疗中得到生存时间上的获益,故需要积极治疗,力争改善患者预后。

