腰退行性病变与TRALL基因之间关系的研究△
徐世民,王炳武,张晓霞,刘伟强,于明东,苏保辉,高加智
(山东省潍坊市人民医院脊柱外科,261041)
腰椎间盘退行性病变(lumbar degenerative dis⁃ease,LDD)是临床常见疾病,它是由腰椎间盘的生理结构退行性病变引起腰椎间盘突出、椎管狭窄等病理改变,导致患者出现腰痛、下肢麻木、大小便障碍等临床症状[1]。据统计,全球每年有2.66亿人患有LDD,发病率为3.63%[2],超过一半的人在生活中会受到腰背痛的影响[3]。随着对腰椎间盘退变认识的进展,包括影像学检查和干预试验等被应用到不同的方面,以推测LDD的病因[4,5]。腰椎间盘的退变具有很强的遗传性,细胞行为和细胞外基质的结构是否完整均由遗传信息所决定[6]。因此,本研究从此角度出发,探讨LDD与TRAIL基因之间的相关性及TRAIL基因的临床意义。
1 材料与方法
1.1 研究对象
腰椎间盘髓核取自人体。其中,2019年7月—2020年7月手术治疗的腰椎间盘突出症60例患者为退变组,男32例,女28例,年龄32~64岁;同期因腰椎创伤手术,但椎间盘无退变的60例患者为未退变组,男49例,女11例,年龄26~57岁。将取出的髓核分成两部分,一部分用于制作石蜡切片,一部分用于髓核细胞的分离培养。本研究已预先通过本院伦理委员会批准并书面同意,所有研究对象均签署知情同意书。
1.2 组织化学染色
1.2.1 染色
髓核组织固定、脱水、浸蜡后制备蜡块,切5μ的石蜡切片。切片脱蜡、复水后行组化染色。
Tunel(TdT-mediated dUTP Nick-End Labeling)法检测细胞凋亡,用50 μl末端脱氧核苷酸转移酶(TdT)和450 μl地高辛标记的dUTP液混匀,而阴性对照组仅加50 μl地高辛标记的dUTP液,阳性对照组先加入100 μl DNase1,15~25℃反应10 min,后面步骤同处理组。玻片干后,加50 μl TUNEL反应混合液,在湿盒中37℃反应1 h。加3%BSA室温作用20 min后,分别在3%BSA和50 μl POD转换液中孵育30 min,并加入DAB底物。苏木素复染后梯度酒精脱水。镜下观察凋亡细胞,细胞核内有黑棕色颗粒的为阳性细胞。
1.2.2 免疫组化
肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor related apoptosis inducing ligand,TRAIL)免疫组化染色,采用DAB法,复水,消除内源性过氧化物酶活性,加入一抗TRAIL,4℃过夜,加入生物素标记的二抗,DAB显色,苏木精复染,脱水、透明、封片。镜下见TRAIL阴性的细胞胞浆染色呈浅蓝色,而阳性的细胞呈现胞膜褶皱,着色较深,且细胞浆出现黄色颗粒样物质。
1.3 体外试验
1.3.1 细胞分离与培养
将退变髓核有消化酶消化后,用10%胎牛血清(美国Invitrogen公司)的DMEM培养基(美国Gibco公司)进行沉淀,记为原代(P0)。加入0.25%胰蛋白酶(美国Gibco公司)2 ml,当细胞突起回缩、变圆、细胞间隙变大,按1∶4传代接种到新的培养皿中,细胞计数并调整细胞密度。
1.3.2 细胞体外分组与处理
P1细胞分为4组,分别为空白对照组(control组)、TRAIL-siRNA转染组(siTRAIL组)、TNF-α处理组(TNF-α组)和TNF-α处理+TRAIL-siRNA转染组(TNF-α+siTRAIL组)。
空白对照组:细胞常规培养,不行其它干预。
TRAIL-siRNA转染组:将髓核细胞用0.25%胰蛋白酶消化并计数后接种于6孔板,以DMEM培养基稀释 10 μl Lipofectamine 2000~250 μl,加入 0.05 nmol的TRAIL siRNA至250 μl DMEM培养基,终浓度为200 nmol/L。1×PBS缓冲液冲洗采用荧光定量PCR检测髓核细胞中TRAIL的表达,以确定转染效率。
TNF-α处理组:细胞接种于6孔板,加入浓度为100 ng/ml的TNF-α的低糖DMEM培养基,持续培养2 d。
TNF-α处理+TRAIL-siRNA转染组:将髓核细胞用浓度为100 ng/ml的TNF-α处理,培养2 d后,用0.25%胰蛋白酶消化并计数后接种于6孔板,加入Li⁃pofectamine 2000和TRAIL siRNA DMEM培养基,终浓度为200 nmol/L。1×PBS缓冲液冲洗采用荧光定量PCR检测髓核细胞中TRAIL的表达,以确定转染效率。
1.3.3检测指标
MTT细胞增殖检测:将细胞以每孔5×103个细胞接种到培养板。培养48 h后,加新鲜配置的MTT溶液 (5 mg/ml) 20 μl/孔,继续孵育 4 h。上清液吸除,每孔中加150 μl DMSO,室温,摇床振荡10 min。490 nm波长,测定各孔光吸收值。
流式细胞检测:将贴壁细胞用标记溶液FITCAnnexin V和PI溶液标记,使用BD FACSAria流式细胞仪(美国Beckman Coulter公司)检测。在散点图上,正常的活细胞显示在左下象限,不被FITC-An⁃nexin V和PI染色,即FITC-/PI-;凋亡早期的细胞显示在右下象限,它仅被FITC-Annexin V染色,即FITC+/PI-;凋亡晚期和坏死的细胞显示在右上象限,它们既可以被FITC-Annexin V染色又可以被PI染色,即FITC+/PI+。
Western blot检测:P1细胞提取的组织蛋白与5×SDS上样充分搅匀,将蛋白加热变性后,用SDS聚丙烯酰胺(美国Amresco公司)凝胶电泳,丽春红染色后,剪出目的蛋白条带。加入二抗溶液和ECL化学发光试剂混合,在Biorad凝胶成像系统中曝光,观察蛋白条带情况并拍照。
1.4 统计学方法
2 结果
2.1 髓核组织化学检测
两组髓核Tunel组化染色结果见图1a,1b。退变组髓核内细胞稀疏,可见染色质边集化的TUNEL染色阳性细胞,呈黑棕色(图1a),而未退变组腰椎间盘内髓核细胞数量较多,呈蓝色,散在分布少许的TUNEL染色阳性细胞(图1b)。退变组中凋亡阳性细胞率为48.92%,末退变组中凋亡阳性细胞率为5.23%,组间比较差异有统计学意义(P<0.05)。
TRAIL免疫组化染色见图1c,1d,退变组TRAIL阳性细胞多见,呈现胞膜褶皱,着色较深,胞浆出现黄色颗粒样物质(图1c)。未退变组TRAIL阳性细胞较少,而阴性细胞多见,胞浆染色呈浅蓝(图1d)。

图1 组织化学染色结果(×400) 1a:退变组Tunel染色,髓核细胞减少,可见较多Tunel染色阳性(黑棕色) 1b:未退变组Tunel染色,可见大量髓核细胞,呈蓝色,散布少许Tunel阳性细胞 1c:退变组TRAIL染色,可见较多TRAIL阳性细胞,细胞呈现胞膜褶皱,着色较深,且细胞浆出现黄色颗粒样物质 1d:未退变组TRAIL染色,以TRAIL阴性细胞为主,胞浆染色呈浅蓝色
退变组TRAIL阳性率为49.11%,未退变组TRAIL阳性率为12.25%,两组间的差异有统计学意义(P<0.05)。
Pearson相关分析表明,髓核细胞的TRAIL阳性率与TUNEL凋亡细胞阳性率之间呈正相关(r=0.917,P<0.001)。
2.2 体外试验结果
2.2.1 MTT检测
将TRAIL-siRNA转染至退变髓核细胞中,用100 ng/mL的TNF-α处理转染或未转染的髓核细胞,然后MTT法检测细胞增殖情况,结果见图2。相较于空白对照组,TRAIL-siRNA转染组细胞的生长速度(100.75±5.72)%,差异无统计学意义(P>0.05),TNF-α处理细胞的增殖速度为(49.19±2.89)%,显著降低且差异有统计学意义(P<0.05),而TRAIL-siRNA转染+TNF-α处理组细胞的活性无明显变化(P>0.05),提示沉默TRAIL的表达能显著改善TNF-α诱导的细胞活性抑制。
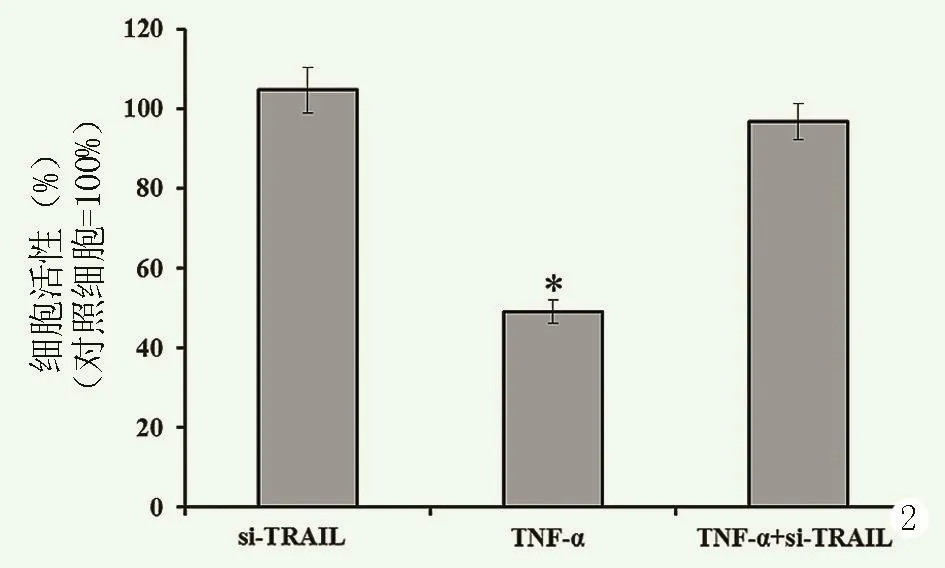
图2 siRNA沉默TRAIL表达对退变髓核细胞活性的影响,*与对照组相比,P<0.05
2.2.2 流式细胞检测
采用流式细胞术检测细胞凋亡情况,结果见图3。相较于未转染细胞,TRAIL-siRNA转染退变髓核细胞凋亡无明显改变(P>0.05),TNF-α处理组细胞的凋亡率明显升高(P<0.05)。TRAIL-siR⁃NA转染+TNF-α处理组细胞的凋亡率较未转染组显著增加(P<0.05),但较TNF-α处理组显著降低,提示沉默TRAIL的表达可抑制TNF-α诱导的细胞凋亡。

图3 siRNA沉默TRAIL表达对退变髓核细胞凋亡的影响
2.2.3 Caspase-3的Western blot检测
采用分光光度法Western blot检测退变髓核细胞中Caspase-3活性和表达情况,结果见图4。相较于未转染细胞,TRAIL-siRNA转染组退变髓核细胞中Caspase-3活性和表达无明显变化(P>0.05),TNF-α处理组细胞中Caspase-3的活性和表达明显升高(P<0.05),而TRAIL-siRNA转染+TNF-α处理组细胞Caspase-3的活性和表达无明显变化(P>0.05),提示沉默TRAIL的表达可抑制TNF-α诱导的Cas⁃pase-3激活和表达。
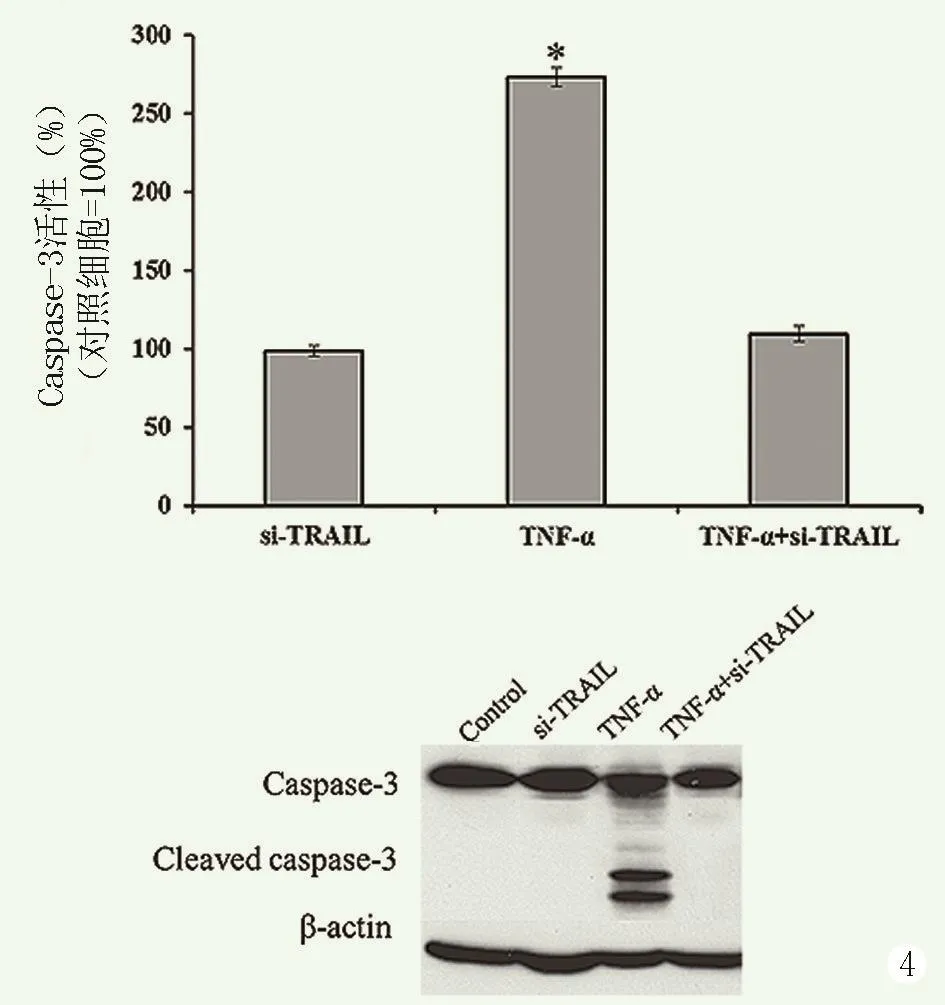
图4 siRNA沉默TRAIL表达对退变髓核细胞中Caspase-3活性和表达的影响
3 讨论
腰椎间盘在特定范围内有着较好耐受性,而负荷超过一定程度就会对椎间盘发生结构的改变,进而出现椎间盘退变[7]。目前LDD的治疗方法有药物治疗(如非甾体抗炎药)、物理治疗和手术治疗、改善椎间盘变性的药物治疗、椎间盘变性的生物治疗以及干细胞治疗[8,9]。既往研究已认识到老化与退化的过程类似,但仍未明确两者之间的具体关系。
细胞生理状态的改变可导致细胞凋亡,腰椎间盘的凋亡与其退变联系紧密[10]。细胞凋亡使椎间盘的渗透压、pH值、氧分压等因子出现异常,引起椎间盘内代谢产物的淤积,进而发生椎间盘的退变[11]。本研究对髓核细胞TUNEL染色观察显示:对照组腰椎间盘髓核内细胞较多,平均凋亡阳性细胞率明显低于病例组,提示细胞凋亡是椎间盘髓核细胞减少的原因。TRAIL基因受多种因素的调节,包括反转录因子、表观遗传学因素和单核苷酸多态性和功能不同的亚型[12]。TRAIL蛋白可以被检测为跨膜型蛋白和可溶性蛋白[13]。TRAIL通过与5个同源受体的复杂配体-受体系统的相互作用发挥其生物效应,在正常生理条件下可以以不同的亲和力结合配体[14]。TRAIL受体系统的第5个受体是骨保护素,最初发现通过与NF-κB配体受体激动剂相互作用作为破骨细胞生成调节[15]。TRAIL基因对细胞凋亡存在不同细胞传递不同信号的特点,主要涉及到死亡受体复合物DISC、凋亡蛋白及凋亡抑制蛋白[12]。TRAIL介导的细胞选择性的凋亡涉及转化/感染细胞,非肿瘤细胞基本不受影响,并因此成为科学研究的热点[16,17]。国外实验证明,在正常细胞/组织中可能有其他的作用,也能促进存活/增殖,干扰多种细胞类型的分化,甚至能激活肿瘤细胞中的促生存信号通路[18]。多种异常刺激可以增加髓核细胞中的炎性因子(如IL-1β和TNF-α)表达,从而引起髓核细胞合成代谢与分解活性的失衡,加速了椎间盘退变。同时也有研究证实,高水平的TNF-α可以激活内源性和外源性途径中的Caspase-3蛋白发挥凋亡作用,因此本研究选择TNF-α作为诱导髓核细胞凋亡的刺激性因子[19,20]。
本次研究结果发现,TRAIL阳性率与TUNEL凋亡细胞阳性率成正比且经TNF-α处理后细胞增殖明显降低,细胞凋亡显著升高,Western blot检测结果显示TNF-α处理组细胞的Caspase-3蛋白含量明显高于其他组。此外本次研究发现,TRAIL-siRNA转染+TNF-α处理组细胞的活性、凋亡率及Caspase-3蛋白水平与对照组无明显差异,提示siRNA沉默TRAIL表达可抑制TNF-α诱导的细胞凋亡,并可显著抑制TNF-α诱导的Caspase-3激活和表达。由此本次研究认为,TRAIL和Caspase-3蛋白通过参与髓核细胞的凋亡而引发腰椎间盘退变。TRAIL是一种凋亡分子,能与死亡受体特异性结合后选择性诱导细胞凋亡。Caspase-3蛋白具有剪切DNA蛋白片段的功能,是调控细胞凋亡的关键因子。Eerenbeemt等[16]研究发现,TRAIL可激活死亡受体而启动外源性凋亡途径诱导髓核细胞凋亡,与本次研究结果相一致,并认为抑制TRAIL基因的表达使ERK通路失活可成为临床治疗IDD的潜在治疗靶点。与先前研究相一致的是,caspase-3在内源性(线粒体)细胞凋亡中发挥重要作用,短期抑制cas⁃pase-3可用于治疗损伤诱导的椎间盘退行性病变。
综上所述,髓核TRAIL阳性表达细胞率与凋亡细胞率呈正相关,TRAIL沉默能显著提高TNF-α对细胞活性的抑制作用并可显著抑制TNF-α诱导的髓核细胞凋亡及Caspase-3的活化和表达。

