采用Box-Behnken设计优化玫瑰花酵素发酵工艺及其抗氧化活性的测定
夏国灯,严 成, ,李林柯,李 坪,段旻燕,吴映川
(1.西南科技大学生命科学与工程学院,四川绵阳 621010;2.丽江程玫生物科技有限公司,云南丽江 674100;3.丽江程海沁香玫瑰庄园有限公司,云南丽江 674100)
酵素是以动植物、菌类等为原料,利用现代发酵技术发酵得到的含有特定生物活性成分的产品,其主要成分为酶、菌催化类以及抗氧化活性物质。其具有抗氧化[1]、促进新陈代谢、解酒护肝、预防心血管疾病[2]、抗糖尿[3]、预防衰老以及神经退行疾病[4]等功能。酵素是一种很特殊的复杂性蛋白质,在人体内担任新陈代谢各种化学变化最重要的媒介体[5]。酵素存在于所有活细胞中,它启动了细胞的活力,使细胞展现出种种生命现象。但人体自身只能制造补充部分酵素,其余大部分需要依靠食物不断补充,近些年来,随着食用酵素产品被越来越多的被人们认知,各种食用酵素产品层出不穷。但目前关于酵素的研究以及在市场上出现的酵素产品,以果蔬为原料制作的为主,很少有关于花卉酵素的研究。
玫瑰,又被称为刺玫花、穿心玫瑰、徘徊花、赤蔷薇等,是世界名花之一,属蔷薇科植物[6]。我国是玫瑰花的故乡,玫瑰花在我国的发展历史悠久,广泛分布于北京、山东、甘肃、云南、四川等地,是我国重要特产经济植物[7−8]。玫瑰花中含有丰富的花色苷、黄酮、多酚、多糖等活性物质,具有排毒养颜、行气活血、抗氧化、抗菌、抗病毒、利胆解毒之功效[9]。目前,我国的玫瑰花主要应用于精油的提取[10−12]、玫瑰花酱的制作、玫瑰花饼干的制作、玫瑰花茶的制作等。在目前已有玫瑰花酵素的工艺研究中,大多以酵母菌复合其他菌种为发酵菌种,多以SOD酶活力为单一指标进行优化,且多以专利形式出现[13−14]。针对玫瑰花酵素科学性、系统性的研究以论文形式的鲜有报道。
本试验以玫瑰花为原材料,应用现代微生物发酵技术,选用乳酸菌对玫瑰花进行发酵,研制出玫瑰花酵素,促进玫瑰花深加工产品发展,丰富我国酵素的市场,为工业化生产提供一些数据支持和理论依据。
1 材料与方法
1.1 材料与仪器
玫瑰花(法国墨红)云南丽江程玫生物技术有限公司;安琪牌果蔬酵素发酵剂(麦芽糊精、植物乳杆菌N13、保加利亚乳杆菌(Lactobacillus bulgaricus)、瑞士乳杆菌(Lactobacillushelveticus)、肠膜明串珠菌膜亚种(L.mesenteroidessub sp.mesenteroides)、嗜热链球菌(Streptococcus thermophilus))湖北安琪酵母股份有限公司;白糖、乳糖 食品级市售;没食子酸标准品、抗坏血酸、2,4,6-三(2-吡啶基)三嗪(TPTZ2,4,6-tris(2-pyridyl)-s-triazine)、1,1-二苯基-2-三硝基苯肼(DPPH,2,2-diphenyl-1-picrylhydrazyl radical)、芦丁标准品 均为色谱纯,上海源叶生物科技有限公司;2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐(ABTS,2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)、福林酚、碳酸钠、亚硝酸钠、氢氧化钠、硝酸铝、邻苯三酚、盐酸、乙二胺四乙酸二钠、过硫酸钾 均为分析纯,购于阿拉丁。
HH-8 型数显恒温水浴锅 常州市金坛华特实验仪器有限公司;UV 5800PC型紫外分光光度计 上海元析仪器有限公司;PH-030 型干燥/培二用箱上海齐欣科学仪器有限公司;THZ-82A型数显气浴恒温振荡器 常州普天仪器制造有限公司;UV1901型紫外可见分光光度计 四川亿科实验设备有限公司;台式离心机 上海安亭科学仪器厂;PHS-25 型pH计 上海越平科学仪器制造有限公司。
1.2 实验方法
1.2.1 工艺流程
1.2.2 操作要点
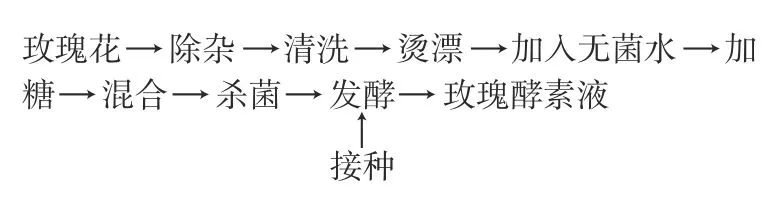
1.2.2.1 玫瑰花预处理 将玫瑰花用无菌水冲洗干净后,晾干水分,用沸水烫漂2 min后,取出晾干水分。
1.2.2.2 玫瑰花发酵基质制备及发酵 分别称取预处理过的玫瑰花14 g、白糖17.8 g、乳糖4 g、量取无菌水150 mL到灭菌发酵罐,采用食品级碳酸钙调整发酵基质pH 5.4,密封。发酵基质放入80 ℃水浴锅中,密封后巴氏杀菌30 min。在发酵基质温度降到33 ℃条件下接种1 g发酵剂到玫瑰花发酵基质中发酵72 h。待发酵结束后滤除玫瑰花花瓣,即得玫瑰花酵素液。
1.2.3 单因素实验 主要选择发酵温度、发酵时间、接种量、初始pH四个工艺参数进行单因素实验,具体方法如下:
1.2.3.1 发酵温度的确定 玫瑰花14 g,乳糖4 g,白糖17.80 g,无菌水150 mL,接种量为1 g,初始pH 4.4,分别在27、30、33、36、39 ℃条件下发酵72 h。研究其对玫瑰花酵素液中SOD酶活力以及多酚含量的影响。
1.2.3.2 发酵时间的确定 玫瑰花14 g,乳糖4 g,白糖17.80 g,无菌水150 mL,接种量为1 g,初始pH 4.4,发酵温度33 ℃,分别发酵24、48、72、96、120 h。研究其对玫瑰花酵素液中SOD酶活力以及多酚含量的影响。
1.2.3.3 接种量的确定 玫瑰花14 g,乳糖4 g,白糖17.8 g,无菌水150 mL,初始pH 4.4,发酵温度33 ℃,接种量分别为0.4、0.7、1、1.3、1.6 g发酵72 h。研究其对玫瑰花酵素液中SOD酶活力以及多酚含量的影响。
1.2.3.4 初始pH的确定 玫瑰花14 g,乳糖4 g,白糖17.80 g,无菌水150 mL,接种量为1 g,发酵温度33 ℃,分别在初始pH为2.4、3.4、4.4、5.4、6.4条件下发酵72 h。研究其对玫瑰花酵素液中SOD酶活力以及多酚含量的影响。
1.2.4 响应面优化 根据单因素实验结果,对玫瑰花酵素发酵时间、发酵温度、接种量、初始pH这4 个因素进行四因素三水平Box-Benhnken Design试验,以玫瑰花酵素SOD酶活力以及多酚含量的综合评分(综合评分=(SOD酶活力+总酚含量分值)/2,其中SOD酶活力最大为100 分,按线性分配相应分值;多酚含量最大值为100 分,按线性分配相应分值)为响应值,以得到玫瑰花酵素的最佳发酵工艺,响应面试验各因素水平如表1 所示。
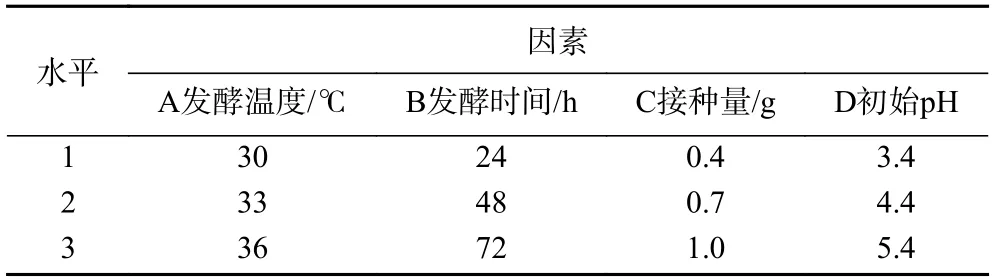
表1 Box-Behnken实验因素和水平设计Table 1 Factors and level of Box-Behnken experiment design
1.2.5 指标测定
1.2.5.1 SOD酶活力的测定 参考国家标准GB/T 5009.171-2003。
1.2.5.2 总酚含量的测定 参照文献[15]的方法略作改动,测定总酚含量。准确移取25 μL样品于50 mL比色管中,加入25 mL蒸馏水和2.5 mL福林酚,摇匀静置3 min后加入饱和碳酸钠溶液10 mL,用蒸馏水定容,静置30 min。于765 nm波长处测定吸光度,以没食子酸质量浓度对吸光度作标准曲线。得到回归方程:Y=68.714X+0.011(X为没食子酸标准品浓度,单位为mg/mL;Y为吸光度,R2=0.9991)总酚含量以每毫升样品中总酚类化合物相当于没食子酸的质量表示(mg/mL)。
1.2.5.3 黄酮测定 采用亚硝酸钠法测定黄酮含量[16]。取样品50 μL于25 mL比色管中,加入1 mL 5%NaNO2溶液,混匀,在室温下静置6 min,加入1 mL 10%AlNO3溶液,摇匀静置6 min后加入8 mL 4%NaOH溶液,用60% 乙醇定容至刻度线,混匀,室温下反应15 min,在510 nm处测得吸光度值。根据芦丁浓度和吸光度值绘制标准曲线。标准曲线方程:y=11.012x−0.0021,(式中y为吸光度的大小,x为标准品芦丁溶液的浓度,单位为mg/mL,R2=0.999)总黄酮含量以每毫升样品中黄酮类化合物相当于芦丁的质量表示(mg/mL)。
1.2.5.4 花色苷含量测定 采用消光系数法[17]对玫瑰花酵素中花色苷进行测定。将发酵得到的玫瑰花酵素用紫外分光光度计在400~800 nm波长范围内扫描,以蒸馏水为参比,确定玫瑰花酵素花色苷的最大吸收波长。根据式(1)计算玫瑰花酵素中花色苷含量:
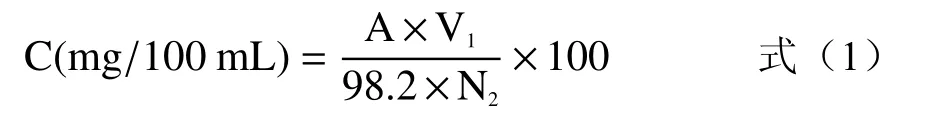
式中:C(mg/100 mL):玫瑰花酵素花色苷含量;A:最大吸收波长处的吸光度值;V1:定容体积(mL)×稀释倍数;V2:样品体积(mL);98.2:花色苷平均消光系数。
1.2.5.5 可滴定酸测定(以乳酸计)参考GB/T 12456—2008《食品中总酸的测定》。
1.2.5.6 pH测定 采用pH计测定。
1.2.6 抗氧化活性测定
1.2.6.1 对DPPH自由基清除作用的测定 参照文献[18−19]方法略作改动。加入3.2 mL 0.10 mmol·L−1的DPPH工作液于试管中,加入蒸馏水稀释的玫瑰花酵素溶液0.8 mL,玫瑰花酵素体积分数分别为:0、0.05%、0.1%、0.15%、0.2%、0.25%、0.3%、0.35%、0.4%、0.45%,混匀后,于25 ℃避光反应30 min,在517 nm波长下测定其吸光度。按式(2)计算DPPH自由基清除率(%)。
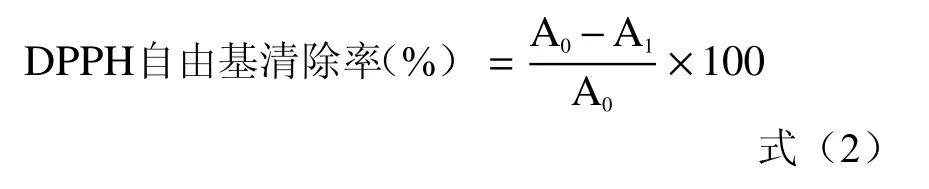
式中:A0:DPPH溶液的吸光度;A1:玫瑰花酵素+DPPH溶液的吸光度。
1.2.6.2 对ABTS自由基清除作用的测定 参照文献[20−21]方法略作改动。取3 mL ABTS+·工作液于试管中,加入蒸馏水稀释的玫瑰花酵素溶液0.3 mL,玫瑰花酵素体积分数分别为:0、0.05%、0.1%、0.15%、0.2%、0.25%、0.3%、0.35%、0.4%、0.45%,将其充分混匀后,在25 ℃下避光反应10 min,在732 nm波长处测定样品的吸光度。按式(3)计算ABTS自由基清除率(%)。
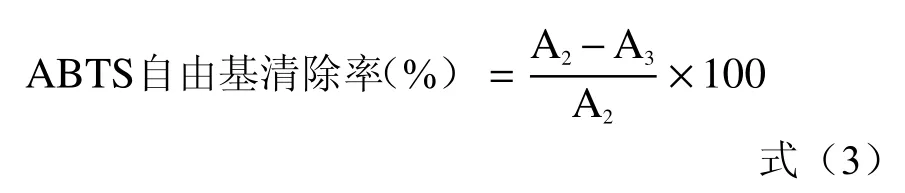
式中:A2:空白(蒸馏水)+ABTS溶液的吸光度;A3:玫瑰花酵素+ABTS溶液的吸光度。
1.2.6.3 总抗氧化的测定 参照方敏[22]李加兴[23]等的方法略作改动。取蒸馏水稀释的玫瑰花酵素溶液0.1 mL于25 mL比色管中,玫瑰花酵素体积分数分别为:0、0.05%、0.1%、0.15%、0.2%、0.25%、0.3%、0.35%、0.4%、0.45%,与6 mL FRAP溶液混合,在37 ℃水浴30 min,然后在593 nm处测定吸光度值。
1.3 数据处理
每次试验均进行3 次重复操作,试验数据处理、统计分析和图标绘制采用Excel、Design-Expert 8.06、SPSS 20 和Origin软件。
2 结果与分析
2.1 单因素实验结果
2.1.1 发酵温度对SOD酶活力及总酚含量的影响 如图1 所示,随着发酵温度的不断上升,SOD酶活力以及总酚含量呈先上升后下降的趋势,在33 ℃均达到最高,SOD酶活力为90.87 U/mL,总酚含量为5.97 mg/mL。当温度>33 ℃时,SOD酶活力与总酚含量均呈现大幅下降趋势。这可能是由于发酵温度较低时,代谢物SOD酶及总酚含量较低,发酵速度慢;随着发酵温度继续增加,乳酸菌内酶的活性受到高温的抑制,因此减缓其新陈代谢[24],使SOD酶活力及总酚合成率下降。发酵温度对玫瑰花酵素SOD酶活力以及总酚含量的影响具有显著性(P<0.05)。因此,选择33 ℃为最佳的发酵温度。
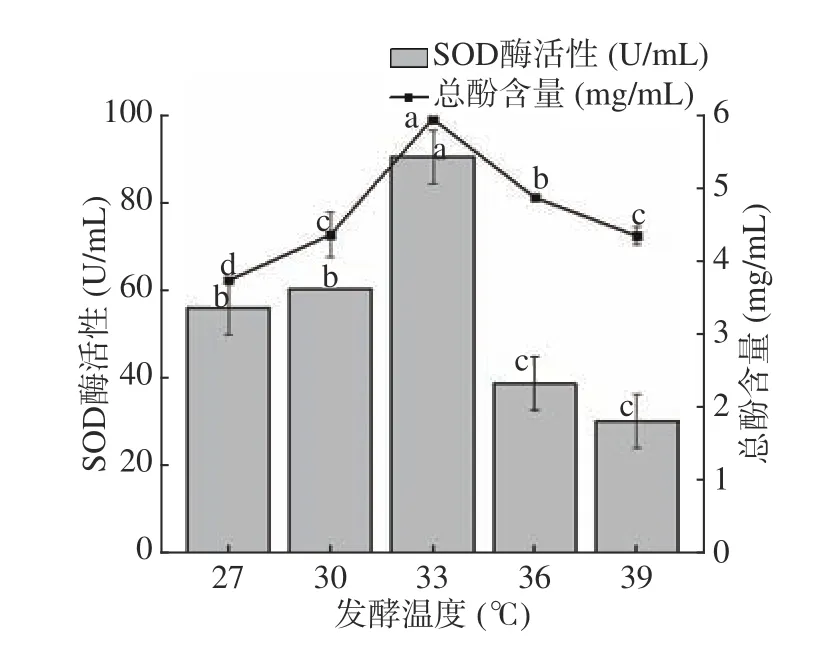
图1 发酵温度对酵素SOD酶活力以及总酚含量的影响Fig.1 Effect of fermentation temperature on enzyme SOD activity and total phenol content
2.1.2 发酵时间对SOD酶活力和总酚含量的影响 如图2 所示,在一定时间范围内随着发酵时间的增加,SOD酶活力与总酚含量增加,在48 h时SOD酶活力最高,且总酚含量最大。之后再延长时间,SOD酶活力与总酚含量均呈下降趋势。SOD酶活力下降的原因可能是在48 h内乳酸菌处于生长代谢旺盛期,48 h后随着乳酸菌的密度增高和衰老转而消耗营养产物,使得次级代谢产物减少,SOD酶活力降低[25]。延长发酵时间可能加速了总酚的氧化分解,导致48 h后总酚含量的下降。发酵时间对玫瑰花酵素SOD酶活力以及总酚含量的影响是显著的(P<0.05)。因此,选择48 h为最佳发酵时间。
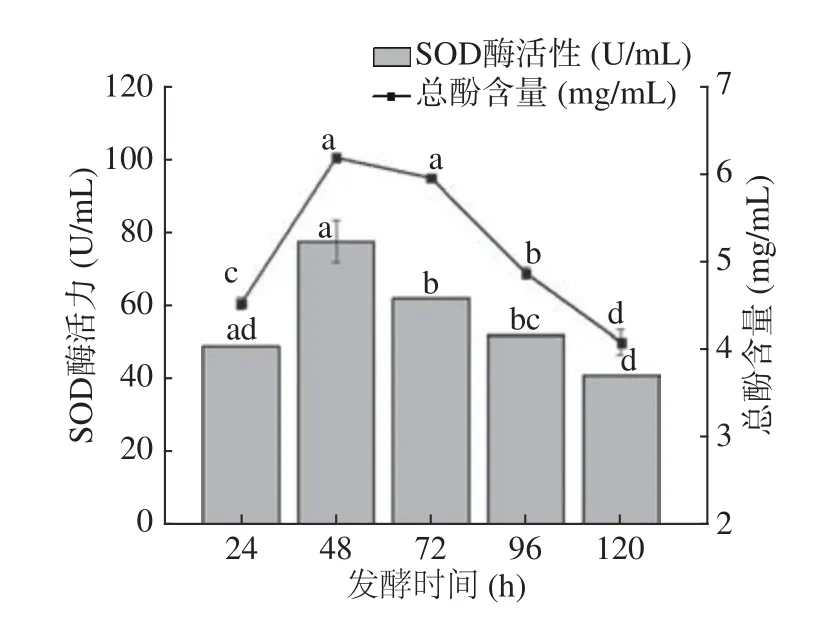
图2 发酵时间对玫瑰花酵素SOD酶活力以及总酚含量的影响Fig.2 Effect of fermentation time on the activity of fermented rose SOD and total phenol content
2.1.3 接种量对SOD酶活力与总酚含量的影响 如图3 所示,随着接种量的增加,SOD酶活力先增加后减少,总酚含量呈逐渐减少的趋势。当接种量为0.7 g时,SOD酶活力达到最大值,为93.91 U/mL,总酚含量为5.31 mg/mL。当接种量>0.7 g时,SOD酶活力逐渐降低。这可能是由于接种量过大,菌体正常代谢消耗的营养物质过多,导致发酵产物减少[26]。接种量对玫瑰花酵素SOD酶活力与总酚含量的影响具有显著性(P<0.05)。综合考虑,选择接种量0.4~1 g进行下一步试验。
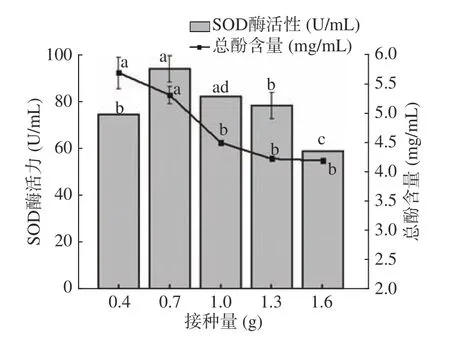
图3 接种量对玫瑰花酵素SOD酶活力与总酚含量的影响Fig.3 Effect of inoculum on the activity of fermented rose SOD and total phenol content
2.1.4 初始pH对SOD酶活力以及总酚含量的影响 如图4 所示,随着初始pH的增加,SOD酶活力与总酚含量呈先上升后下降的趋势,当初始pH为4.4 时,SOD酶活力与总酚含量均达到最大值,此时总酚含量为5.97 mg/mL,SOD酶活力为90.87 U/mL。当初始pH大于4.4 时,随着pH的增加,总酚含量和SOD酶活力都呈现出逐渐下降的趋势。这可能是由于初始pH逐渐增加,抑制乳酸菌的生长代谢,活菌数逐渐减少,导致产酶能力降低[27]。初始pH对玫瑰花酵素SOD酶活力以及总酚含量的影响是显著的(P<0.05)。因此,选择pH4.4 为最佳发酵初始pH进行后续试验。
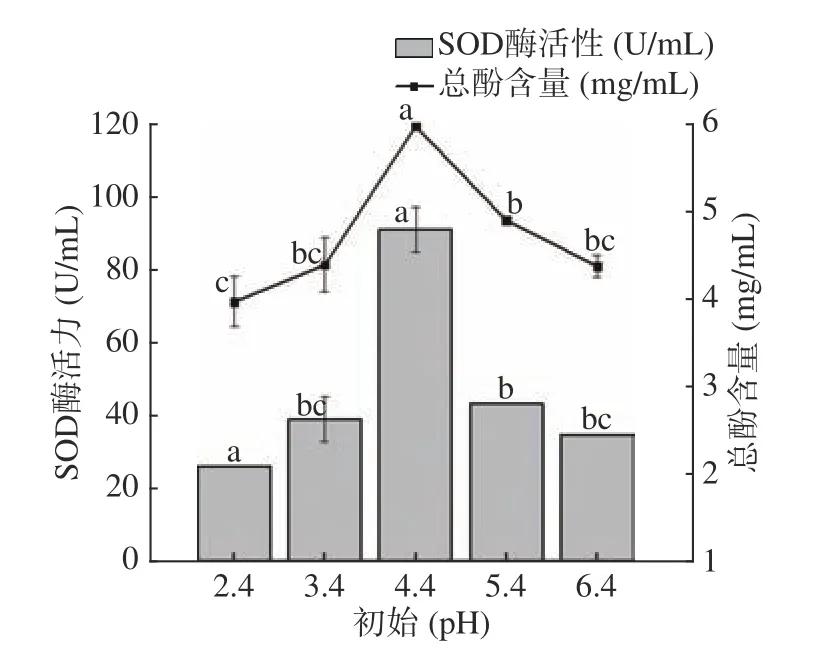
图4 初始pH对酵素SOD酶活力及总酚含量的影响Fig.4 The effect of initial pH on enzyme SOD activity and total phenol content
2.2 响应面试验结果
2.2.1 响应面试验设计与结果 根据单因素结果,进行响应面设计,试验设计与结果如表2。
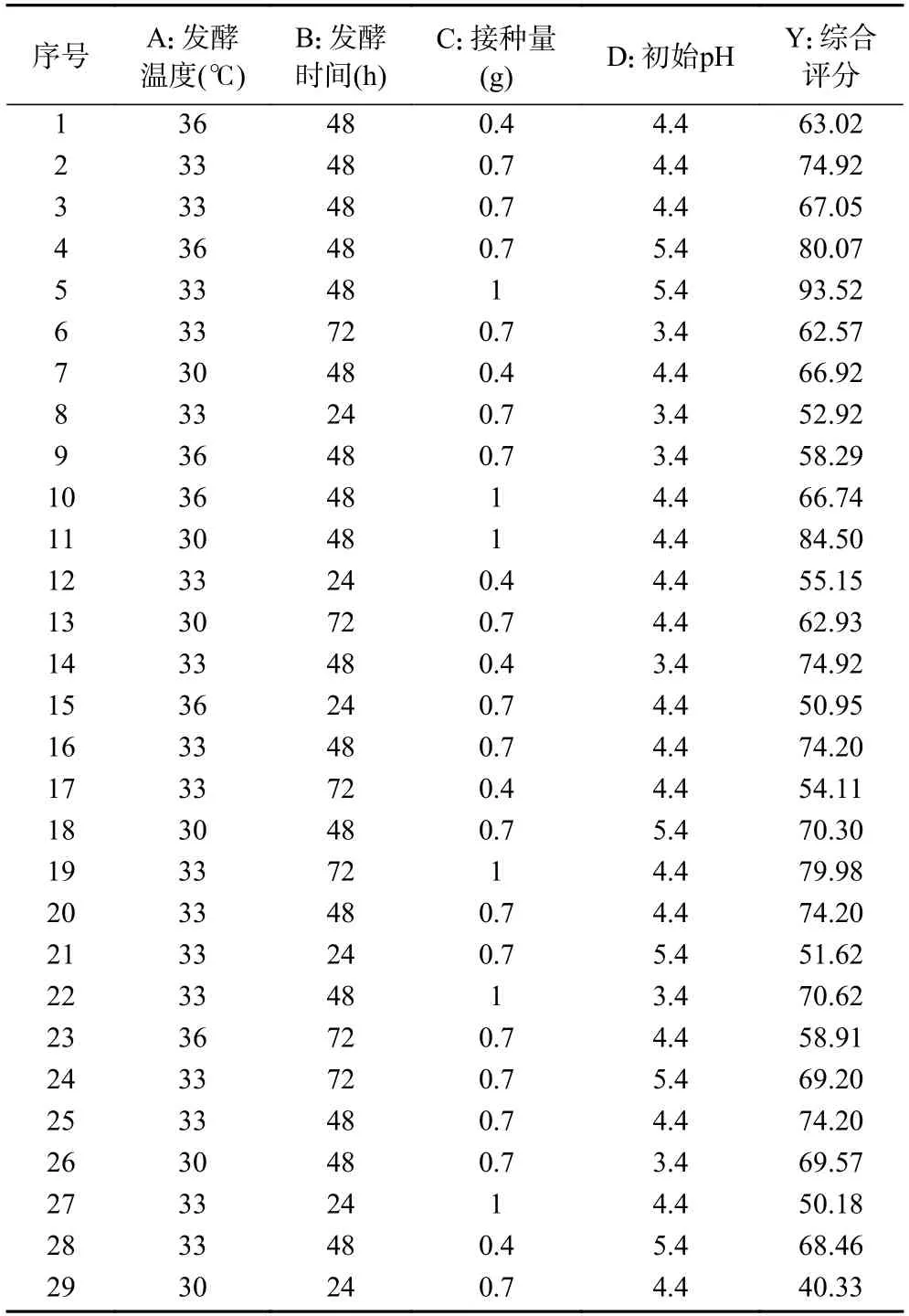
表2 响应面试验设计与结果Table 2 Box-Behnken design and results
利用Design expert软件对试验数据进行多元回归拟合,得到二次多项回归模型方程:
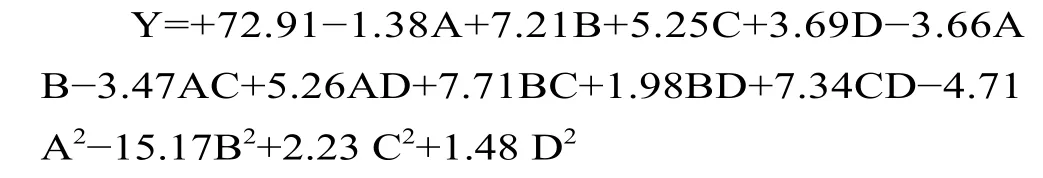
响应面二次多项回归方程的方差分析结果如表3 所示,该模型的F=19.25,P<0.0001,表明该模型极显著;回归系数R2=0.9506,表明建立的该模型可以较好地拟合试验的真实情况,自变量与响应值之间关系显著,该二次方程模型可以用来分析和预测玫瑰花酵素的最佳发酵工艺。由ABCD的F值可知,各因素对玫瑰花酵素综合品质影响的程度为:B>C>D>A,即发酵时间>接种量>初始pH>发酵温度。
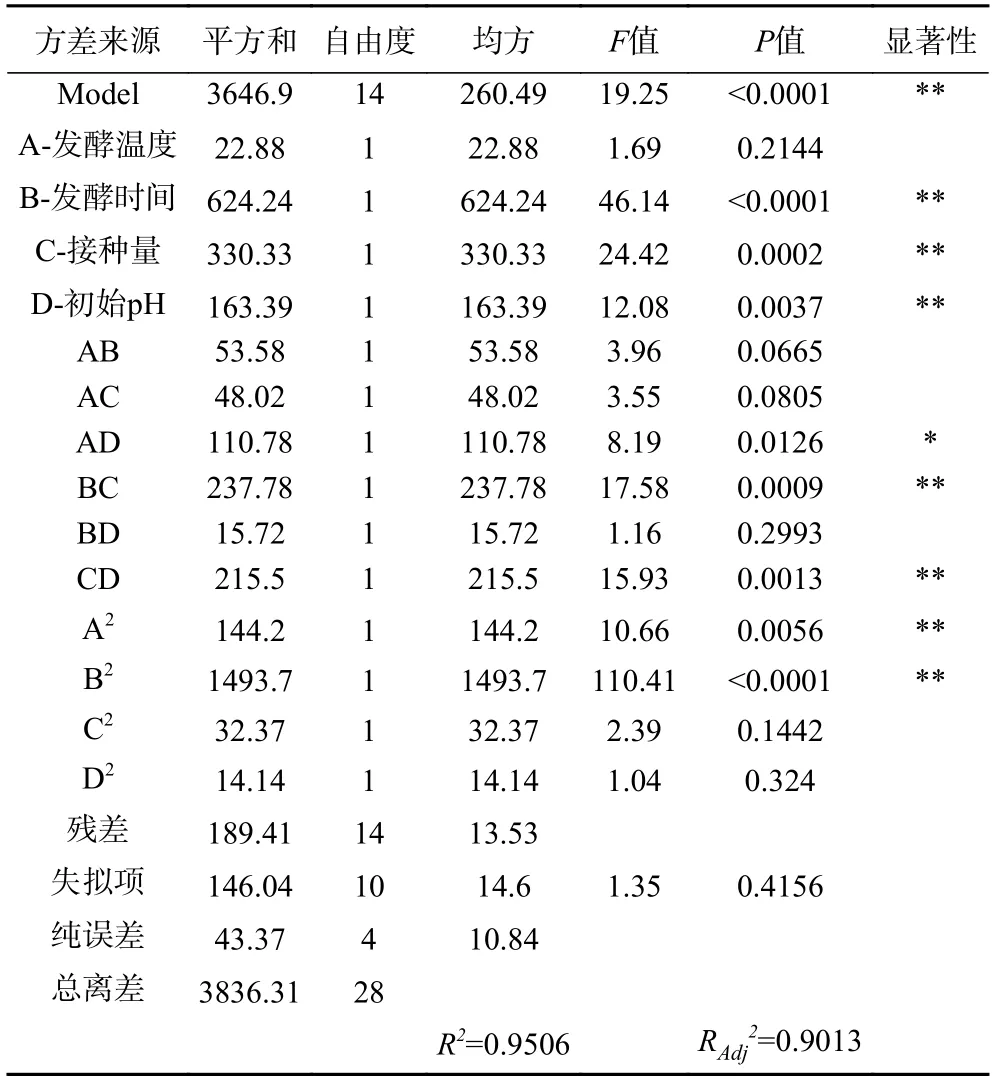
表3 回归模型方差分析Table 3 Analysis of variance of regression model
2.2.2 响应面交互分析 为直观反映各因素及其交互作用对SOD酶活力和总酚含量综合评分的影响结果,对回归方程绘制三维响应面图及其等高线,见图5。
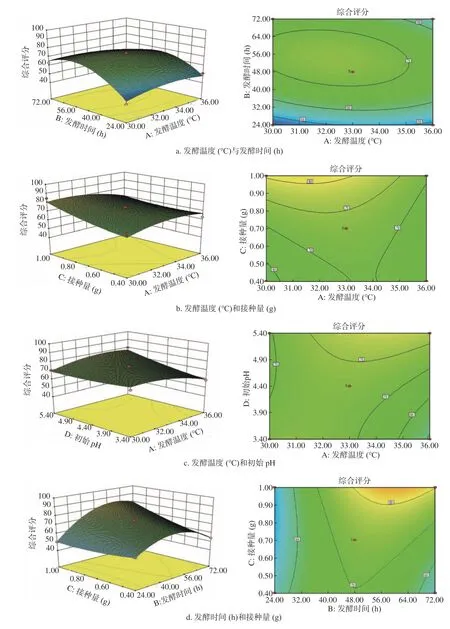
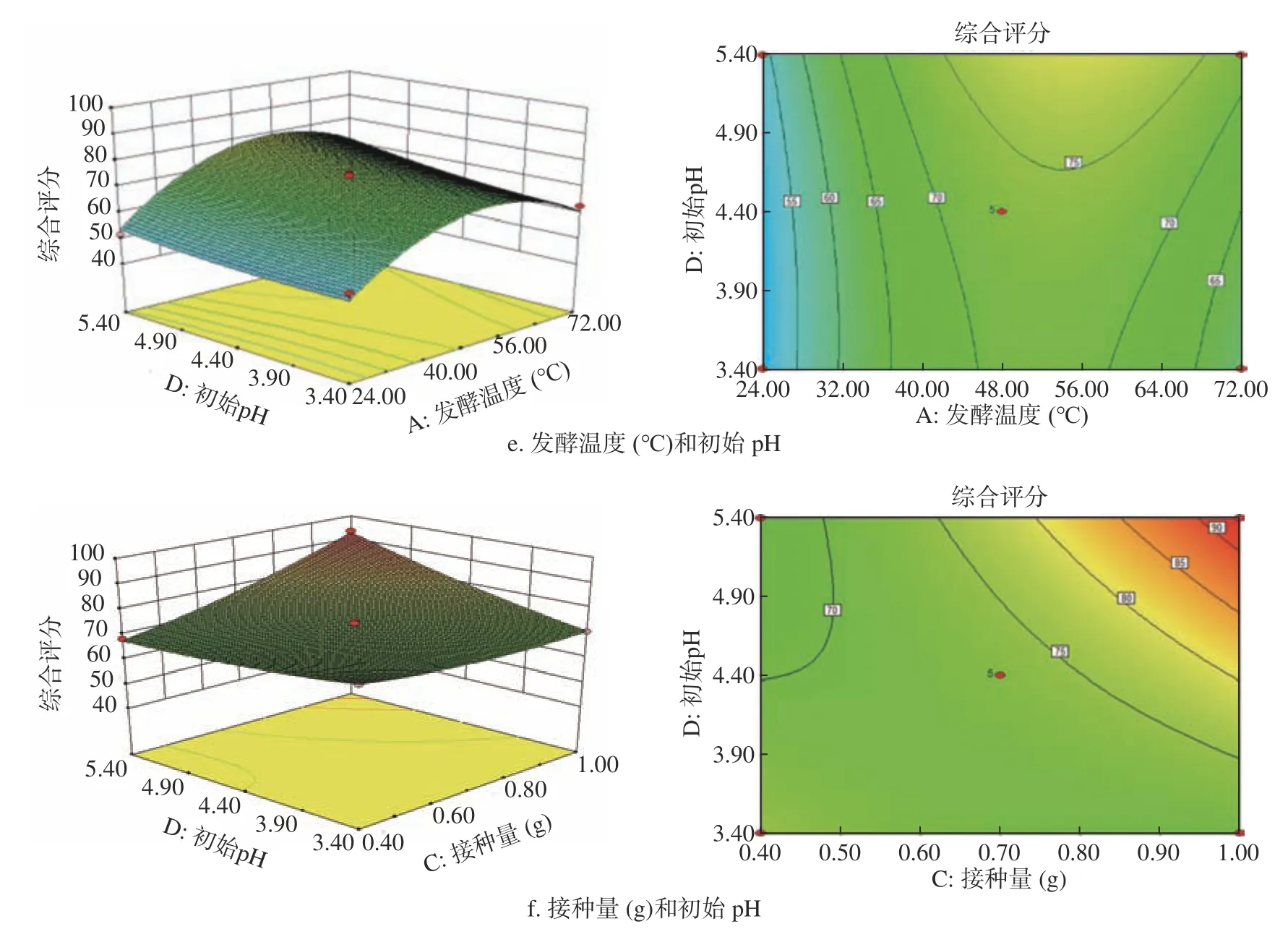
图5 各因素交互作用对SOD酶活力和总酚含量的综合评分影响的响应面和等高线图Fig.5 Response surface and contour map of the influence of the interaction of various factors on the comprehensive score of SOD enzyme activity and total phenol content
由图5 可知,发酵温度与初始pH,发酵时间和接种量,接种量和初始pH之间的交互作用对响应值的影响显著或极显著,其他因素两两交互作用对响应值的影响不显著。由图5a可知,等高线接近圆形,因此确定发酵时间和发酵温度交互作用不显著。由图5b可知,随着发酵温度的增加,综合评分逐渐增加。当发酵温度超过33 ℃时,综合评分开始下降。
但随着发酵温度和接种量的改变,综合评分的波动相对较为平稳,由此可知,发酵温度与接种量之间的交互作用不显著。由图5c可知,3D图像呈是向上凸曲面。初始pH一定时,随着发酵温度的升高,综合评分呈先上升后下降的趋势;发酵温度一定时,随着初始pH的增加,综合评分先增加,且增大趋势越来越不明显,而后减小,从等高线疏密度可知,发酵温度对综合评分的影响大于初始pH对综合评分的影响。两者之间交互作用显著。由图5d可知,发酵时间和接种量之间交互作用显著,综合评分在发酵时间32~72 h、接种量在0.4~1 g之间有最大值。由图5e可知,发酵时间和初始pH之间的交互作用不显著。由图5f可知,接种量和初始pH交互作用极显著。
2.2.3 最佳发酵工艺条件的验证 由响应面软件优化玫瑰花酵素发酵工艺条件为:发酵时间67.81 h,初始pH 5.32,接种量1 g,发酵温度31.27 ℃,该条件下综合评分为94.88。综合考虑,调整发酵工艺参数为:发酵时间68 h,初始pH 5.4,接种量1 g,发酵温度32 ℃。采取该最佳条件进行发酵所得的酵素综合评分为93.20,即SOD酶活力为(132.07±2.31)U/mL,多酚含量为(6.28±0.29)mg/mL,与理论值无显著差异(P>0.05),表明可利用此模型对玫瑰花酵素发酵工艺条件进行响应面优化。
2.3 发酵前后理化指标对比
对SOD酶活力、总酚含量、黄酮含量的检测结果如表4 所示。玫瑰花酵素发酵结束时SOD酶活力达到132.07 U/mL,比发酵前的SOD酶活力提升了4.40 倍。玫瑰花中本身含有黄酮类多酚类物质,是天然的抗氧化活性物质[28],玫瑰花中的单聚体酚类物质经益生菌的转化与利用,含量均有所提升。经过发酵,玫瑰花酵素中总酚含量达到6.28 mg/mL,与发酵之前相比,总酚含量提升了45.71%,黄酮含量提升了25.45%。且随着发酵时间的延长,微生物发酵产生乳酸、有机酸等代谢产物,使反应体系走向成熟,pH从5.40 下降至4.19。

表4 发酵前后理化指标对比Table 4 Comparison of physical and chemical indexes before and after fermentation
2.4 玫瑰花酵素抗氧化活性
2.4.1 DPPH自由基清除能力 DPPH法以氮为中心,是一种灵敏、快速、简便的评价物质抗氧化活性的方法[29]。由图6 可知,玫瑰花酵素原液在发酵前后具有较强的DPPH自由基清除能力,且随着体积分数的增加,DPPH自由基清除率逐渐增加。在相同体积分数下,发酵后的DPPH自由基清除率>发酵前>8 mg/mLVc。这表明,通过发酵,玫瑰花酵素DPPH自由基清除能力得到显著提升。这可能是与发酵后,玫瑰花酵素总酚、黄酮等活性物质提升有关[30]。发酵前后玫瑰酵素液以及8 mg/mLVc对DPPH自由基清除的半抑制体积分数分别为0.70%、0.30%、1.50%。

图6 DPPH自由基清除率能力的比较Fig.6 Comparison of DPPH free radical scavenging ability
2.4.2 ABTS自由基清除能力 ABTS经活性氧氧化后会生成一种稳定的蓝绿色阳离子自由基—ABTS+·,自由基产生过多或清除过慢,会对生物体产生损害,加速机体的衰老以及诱发各种疾病[31]。抗氧化物的存在会抑制ABTS+·的产生,颜色会随之变浅,在最大波长734 nm处吸光度值如果减小,表明ABTS+·被清除。如图7 所示,随着体积分数的增加,玫瑰花酵素液在发酵前后同Vc一样对ABTS+·清除率逐渐增强。且在相同体积分数下对ABTS+·的清除率表现为发酵后的玫瑰酵素液最强,其次是发酵前的玫瑰酵素液,最弱的是8 mg/mLVc。发酵前后玫瑰酵素液以及8 mg/mLVc对ABTS自由基清除的半抑制体积分数分别为0.40%、0.20%、6.80%。
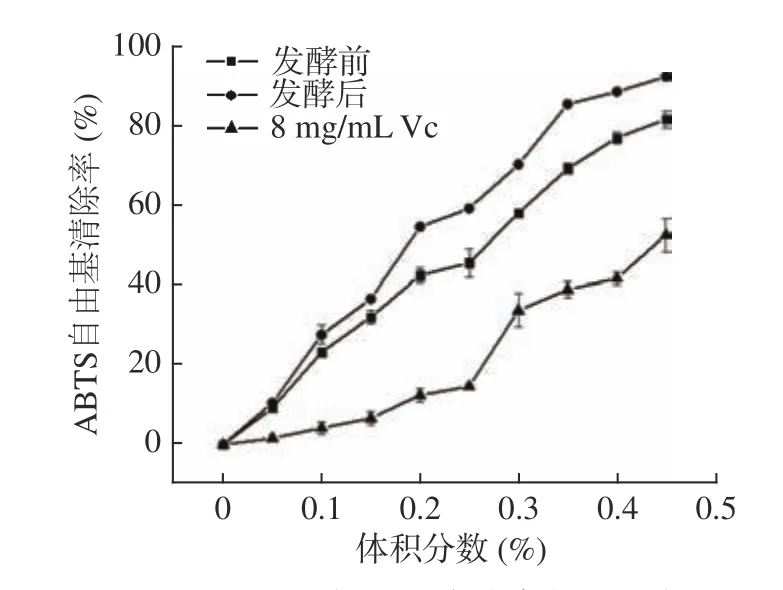
图7 ABTS自由基清除率能力比较Fig.7 ABTS free radical scavenging ability comparison
2.4.3 总抗氧化能力 FRAP法即铁离子抗氧化能力法。在酸性条件下,抗氧化物还原Fe3+-TPTZ产生蓝紫色的复合物—Fe2+-TPTZ,通过测定此复合物在最大波长593 nm处的吸光度,可对抗氧化能力进行评价。吸光度越大,则表明抗氧化能力越强[32]。由图8 可知,在相同体积分数下,玫瑰花酵素发酵前和发酵后的总抗氧化能力远高于8 mg/mLVc。且玫瑰花酵素液发酵后的总抗氧化能力大于发酵前的玫瑰花酵素液。
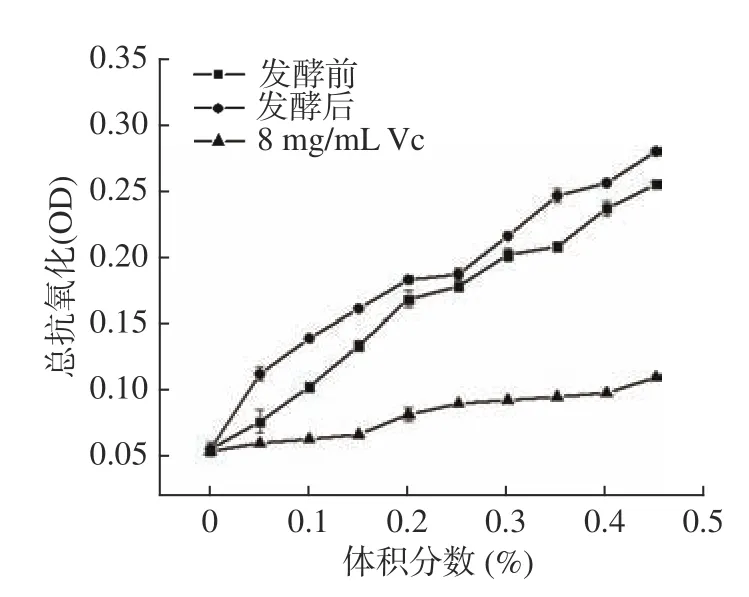
图8 总抗氧化能力比较Fig.8 Comparison of total antioxidant capacity
3 结论
本文采用响应面法对玫瑰花酵素的发酵工艺进行优化,同时探究玫瑰花酵素的抗氧化活性。优化得到玫瑰花酵素的最佳发酵条件为:发酵温度32 ℃、发酵时间68 h,接种量1 g,初始pH5.4。在该条件下得到的玫瑰花酵素SOD酶活力达到132.07 U/mL,比发酵前的SOD酶活力提升了4.40 倍,总酚含量达6.28 mg/mL,与发酵之前相比提升了45.71%,黄酮含量为3.48 mg/mL,提升了25.45%。此外,该酵素的ABTS自由基清除率、DPPH自由基清除率以及总抗氧化能力较高,且玫瑰花酵素发酵后的抗氧化能力明显优于发酵前。说明通过益生菌发酵,可以制备总酚含量与SOD酶活力较高且具有较好抗氧化活性的玫瑰花酵素产品。玫瑰花酵素的研究丰富了以果蔬为主要原料的酵素市场,为玫瑰花资源利用开辟了新途径。今后的研究中,还可以利用不同的益生菌进行发酵,深入探索玫瑰花酵素的发酵过程酶活性、抗氧化活性以及活性成分的变化,为工业化提供理论依据。

