婴幼儿血管瘤与脉管畸形的循证治疗研究进展
郑家伟, 赵泽亮
上海交通大学医学院附属第九人民医院·口腔医学院口腔颌面-头颈肿瘤科,国家口腔疾病临床医学研究中心,上海市口腔医学重点实验室,上海市口腔医学研究所,上海(200011)
血管瘤及脉管畸形是临床上常见的疾病,其中40%~60%发生于头颈部[1-2]。2018 年版的国际脉管异常研究学会(International Society for the Study of Vascular Anomalies,ISSVA)最新分类已得到广泛认可与应用。临床常见的良性血管肿瘤和脉管畸形主要包括婴幼儿血管瘤、静脉畸形、淋巴管畸形、动静脉畸形等。根据管腔内液体的流速,脉管畸形分为高流速型和低流速型[3]。近年来,出现了基于基因检测结果的新的脉管畸形分类方法[1]。大多数脉管畸形是非遗传性的,但病变组织常携带可导致血管生成紊乱及其他并发症的体细胞突变。大多数脉管畸形涉及PI3K/Akt/mTOR 和RAS/MAPK/ERK 这两条信号通路[4],这一发现对脉管畸形的诊疗产生了3 个重大影响:增强了对脉管畸形生物学的理解;细化了基于基因型的脉管畸形分类,例如新增PIK3CA 相关过度生长谱(PIK3CA-related overgrowth spectrum,PROS)一类疾病;促进了治疗脉管畸形的靶向药物的研发。脉管畸形的基因检测,正从单纯的学术研究转化为对临床治疗具有指导意义的关键要素。
循证医学是现代临床医学研究和实践的新模式,强调应用完善设计与执行的研究(证据)将决策最佳化,对证据依据知识论上的强度进行分级。本文采用牛津循证医学中心证据分级和推荐标准,将证据级别分为5 个等级,推荐强度从A~D表示由强到弱(表1)[5]。

表1 牛津循证医学中心证据分级和推荐强度Table 1 Oxford center for evidence-based medicine:levels of evidence and grades of recommendation
血管瘤与脉管畸形的病变部位与其临床表现及治疗方法的选择均密切相关,临床症状主要包括气道损伤、进食困难、疼痛不适以及美容缺陷等,常因累及或接近重要解剖结构而无法彻底手术切除。因此,血管瘤与脉管畸形的治疗目标主要是改善功能和美容,而非一味追求彻底根治。2018 年12 月,美国儿科学会基于循证医学方法,发布了针对婴幼儿血管瘤处理的临床实践指南[6]。目前,关于脉管畸形的研究多为回顾性临床研究或者低级别临床试验。本文旨在全面回顾婴幼儿血管瘤、淋巴管畸形、静脉畸形和动静脉畸形治疗的文献资料,对婴幼儿血管瘤与脉管畸形循证治疗研究进展做一述评。
1 婴幼儿血管瘤
婴幼儿血管瘤(infantile hemangioma,IH)是由血管内皮细胞增殖引起的良性肿瘤,是婴儿期最常见的软组织肿瘤,1 岁以内发病率为3%~10%。IH 常在出生后的最初几周内出现,其自然病程较为独特,包括快速增殖期、消退期和消退完成期。IH 在1 岁左右进入自然消退期,可持续3~8 年,但是多数为不完全消退,消退后常遗留色素沉积、瘢痕、纤维脂肪增生、皮肤下垂等。约有10%的IH 患儿在自然病程中出现溃疡、感染、疼痛,甚至出现失明、窒息等严重并发症;而且IH 好发于头颈部的特点,对学龄期患儿及其监护人产生较大的负面心理影响。因此,目前主张对IH 进行早期积极干预以减少并发症。IH 的治疗方法主要包括口服β受体阻滞剂(普萘洛尔或阿替洛尔)、口服和(或)局部注射糖皮质激素、局部注射抗肿瘤药物、手术、激光治疗、硬化剂注射等。治疗方法的选择根据IH 类型而各有侧重:浅表型IH 首选局部使用β受体阻滞剂(马来酸噻吗洛尔、倍他洛尔等),部分难治性病例可联合激光治疗;深部型IH 首选口服β 受体阻滞剂,若有口服β 受体阻滞剂的禁忌证或单纯口服β 受体阻滞剂疗效欠佳,可考虑加服泼尼松、瘤体内注射博莱霉素(或平阳霉素)等;混合型IH 可口服联合局部使用β 受体阻滞剂,抑制瘤体快速增殖、促进瘤体尽早消退,并减少色素沉着和(或)毛细血管扩张。对位于某些关键解剖部位(例如唇)的局灶性团块状IH,可考虑行曲安奈德和(或)倍他米松瘤体内注射[7](推荐强度B,证据等级3a)。自发现普萘洛尔对IH 具有良好的治疗作用以来,β 受体阻滞剂已经成为治疗IH 的一线药物(推荐强度B,证据等级2b)[7-9]。美国食品药品监督管理局批准的普萘洛尔推荐使用剂量婴幼儿为2 mg/(kg·d)或3 mg/(kg·d)[10](推荐强度A,证据等级1a),在喂养时或喂养后服用,以减少口服摄入量或呕吐,并降低低血糖风险。普萘洛尔是一种高度亲脂性、非选择性β 受体阻滞剂,能够穿透血脑屏障,理论上存在影响中枢神经系统的可能性[11](推荐强度B,证据等级2c);且有文献报道部分IH 患者对普萘洛尔耐药[9,12](推荐强度C,证据等级4)。阿替洛尔是一种亲水性、选择性β1受体阻滞剂,不会穿过血脑屏障,β2 效应较小,推荐剂量为1 mg/(kg·d),一次性口服。目前尚无文献报道IH 患者对阿替洛尔耐药,因此阿替洛尔有望取代普萘洛尔,成为治疗IH 的一线药物[13](推荐强度A,证据等级1b)。
局部注射药物治疗IH 具有作用范围精确、局部药物浓度高和全身副反应少的特点,但是,某些药物也可引起强烈刺激,且某些抗肿瘤药物(例如博莱霉素和平阳霉素)具有细胞毒性。局部药物注射适合于消退期、局限性、深部或增厚的IH,常用药物包括博莱霉素(或平阳霉素)、糖皮质激素和洗涤剂类(如聚多卡醇、聚桂醇)等。研究已证实博莱霉素或平阳霉素对IH 具有良好效果,然而,也有研究发现,局部注射平阳霉素治疗IH 可导致软组织萎缩[14](推荐强度C,证据等级4)。尽管如此,局部注射博莱霉素或平阳霉素仍是治疗对β 受体阻滞剂耐药或治疗后残留病灶IH 的良好选择[15-16](推荐强度C,证据等级4)。除可用于口服治疗IH 外,糖皮质激素也可用于局部病灶内注射治疗[17](推荐强度C,证据等级4)。
对于可能破坏、阻塞或使重要解剖结构(例如气道或眼眶)变形或涉及美学敏感区的IH,在下列情况下,可考虑手术切除[6](推荐强度D,证据等级5):①局部伤口处理和(或)药物治疗未能改善病情;②病变位置局限,早期手术将简化后期重建(如突出的IH 累及耳,或累及眼睑、导致上睑下垂);③病变位于解剖有利区;④病灶在将来也有可能被切除,且术后瘢痕无明显差异。
通过研究IH 的发病机制,发现了一些潜在的治疗靶点(物质)(表2)[18](推荐强度D,证据等级5),针对这些靶点开发出的药物,有望成为治疗IH的新选择。研究证实,肾素-血管紧张素系统在IH的发病过程中发挥作用。组织蛋白酶B 促进肾素生成,继而促进血管紧张素生成。组织蛋白酶D促进血管紧张素原转化为血管紧张素Ⅰ,而组织蛋白酶G 促进血管紧张素Ⅰ转化为血管紧张素Ⅱ,并将血管紧张素原直接转化为血管紧张素Ⅱ。靶向作用于组织蛋白酶B、D 和G 的药物,可能会阻断血管紧张素的产生,从而发挥抗血管生成作用。

表2 婴幼儿血管瘤的潜在治疗靶点Table 2 Potential therapeutic targets for infantile hemangioma
2 淋巴管畸形
淋巴管畸形(lymphatic malformations,LMs)是与体细胞PIK3CA 激活突变相关的低流量病变(图1)。LMs 多见于2 岁以下的儿童,50%的患者出生时即被诊断。浅表LMs 表现为软组织隆起,伴或不伴表面皮肤变色。黏膜病变常表现为白色或深紫色突起,可伴出血。靠近气道的深部病变可引起气道损伤,气道受累最常见的部位是口腔、口咽和下咽,靠近食管的深部病变可引起吞咽障碍。
根据影像学特征,可将LMs 分为大囊型、微囊型或混合型。超声检查可见大囊型LMs 界限清晰,无内流多普勒信号;微囊型LMs 则表现为增厚的回声灶,常浸润周围组织。MRI 的T2 序列显示LMs 高信号,大囊型LMs 可呈边缘强化,而微囊型则微强化。MRI 可充分显示病变范围和受累结构[1](推荐强度B,证据等级2c),是诊断LMs 的最佳影像学手段。
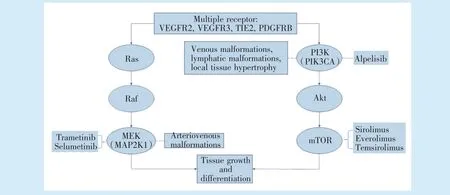
Figure 1 Vascular malformation mutation spectrum and medical therapy targets图1 脉管畸形的突变谱及潜在治疗靶点
LMs 出现疑似感染时应使用抗生素治疗,而呼吸道或牙源性感染继发炎症引起的LMs 肿大可使用皮质类固醇治疗。伴或不伴外伤时,LMs 均可能发生局部出血,常表现为挫伤和肿痛,可使用非甾体消炎药、皮质类固醇治疗,偶尔也可抽出囊液以缓解症状。大囊型LMs 治疗难度较小,手术切除和硬化治疗均有较好效果。微囊型病变常由微淋巴管组成,可浸润正常软、硬组织,且边界不清,治疗较为复杂,手术切除和硬化治疗的效果有限,常需要多方法、分阶段治疗。1995 年,de Serres 等[19]根据病变累及范围提出了头颈部LMs 分类方法(推荐强度D,证据等级5),以中线和舌骨平面为参考,将LMs 分为:单侧舌骨下病变(Ⅰ级),单侧舌骨上病变(Ⅱ级),单侧舌骨下及舌骨上病变(Ⅲ级),双侧舌骨上病变(Ⅳ级),双侧舌骨上及舌骨下病变(Ⅴ级)。LMs 的复发率和出现并发症的风险均随病变累及范围增加而增加。
硬化治疗是LMs 的首选方法,治疗时机需权衡患者年龄及麻醉风险,临床医师常需要与患者家属共同商定合适的治疗年龄。临床实践中,一般不推荐对年龄小于6 个月的患儿进行过早干预。根据病变范围,多数患者可能需要行1 次以上的硬化治疗。如果需行多次硬化治疗,则可考虑给予口服西罗莫司,以减少全麻手术的几率。西罗莫司可抑制mTOR 信号通路进而抑制血管生成,而PI3K/Akt/ mTOR 信号通路是细胞生长和增殖的基础,且可增加血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达。多西环素是国际上治疗大囊型LMs 最常用的硬化剂[20](推荐强度D,证据等级5),但可引起明显疼痛,目前在国内很少使用。博莱霉素(或平阳霉素)是国内治疗微囊型LMs 的首选药物[21](推荐强度B,证据等级2a),治疗后肿胀反应较轻。其他硬化剂,如无水乙醇、十四烷基硫酸钠和OK-432(沙培林),目前已较少用于治疗LMs。LMs 硬化治疗后的肿胀如累及或邻近眼眶时,应考虑测量眼压,以避免视神经受压,导致失明的风险;当肿胀累及或邻近气管时,可能需要行气管插管,并留置重症监护病房观察。
一项纳入25 个研究、包括726 例头颈部LMs 患者的系统综述发现,使用任意硬化剂硬化治疗后,任何类型的LMs 彻底治愈率为50.5%;大囊型LMs的治愈率为53.1%、微囊型为35.1%、混合型为31.1%,大囊型病变治疗的有效率和安全性高于微囊型和混合型[22]。与博莱霉素、OK-432 和平阳霉素等硬化剂相比,多西环素的治愈率最高(62.4%),但安全性较差,并发症发生率为1.2%,无死亡病例出现[22](推荐强度B,证据等级2a)。
对仅累及单个解剖结构的大囊型LMs,尤其是舌骨下方的颈部病变,手术切除效果较好[23](推荐强度B,证据等级2c)。舌骨上方的LMs 更易累及多个解剖结构,因此手术切除更为复杂,复发率和并发症发生率也更高[24](推荐强度C,证据等级4)。如果LMs 累及重要解剖结构,可能需要行次全切除,手术可分期多次进行,但缺点是多次手术会导致瘢痕形成及解剖畸变,使后续手术变得复杂。最新的临床经验表明,术前及术中使用西罗莫司可使淋巴液漏出减少,缩短术后引流时间[1]。选择手术切除还是硬化疗法治疗LMs 的有效性一直存在争议。一项多中心研究表明,手术切除或硬化疗法后,LMs 在1 年内无需接受进一步治疗的几率无显著差异,表明两种治疗方法疗效相同[25](推荐强度B,证据等级3b)。
黏膜浅表微囊型LMs 可采取多种治疗手段,包括激光消融(最常用的是CO2激光)、射频消融、微吸切器切除术、博莱霉素(平阳霉素)注射和口服西罗莫司,这些治疗方法均可不同程度地缓解疼痛、减少出血。分娩时,若LMs 损害胎儿气道稳定性,可从病灶内抽出囊液作为稳定措施。约15%的大囊型LMs 患儿在治疗过程中需行气管切开术,如果LMs 累及喉部,可能需永久放置胃管及气管切开。
西罗莫司最初被作为卡波西样血管内皮细胞瘤患者的同情用药,随后的研究发现其对LMs 也有治疗作用[26](推荐强度C,证据等级4),适合新生儿和婴幼儿LMs 患者长期口服,且副作用小[27](推荐强度B,证据等级2a)。有研究提出西罗莫司的最佳适应证是伴严重慢性疼痛的LMs,但是哪种类型LMs 对西罗莫司有治疗反应、西罗莫司的最佳剂量和治疗时间仍不清楚[28](推荐强度B,证据等级2c),需要进一步研究。尽管无法完全治愈LMs,但多数研究证实大多数LMs 患者口服西罗莫司后可部分消退,且疼痛缓解。一项Ⅱ期临床研究[29](推荐强度B,证据等级2c)发现,57 例LMs 患者接受单一口服西罗莫司治疗48 周后,82.5%(47例)有部分反应且耐受良好,临床症状及影像学表现均显著改善[29]。随后,一组头颈部LMs 病例报告发现,19 例患者出现不同程度的症状改善以及可耐受的毒性反应,无全身细菌感染[30](推荐强度B,证据等级2c)。另一项纳入20 项研究、包括71例接受西罗莫司治疗的LMs 患者的系统综述(推荐强度B,证据等级2a)发现,口服西罗莫司后,60例患者部分缓解,3 例病情进展,8 例治疗结果未见报道[31]。以上研究表明,西罗莫司治疗LMs 在某种程度上是有效的,且耐受性良好,常见的不良反应为高脂血症和中性粒细胞减少。一般而言,西罗莫司可减少LMs 的液体量,这一点可通过MRI的T2 信号改善和LMs 质地改变得以证实。囊液减少与淋巴囊泡减少、疼痛减轻、蜂窝织炎发作次数减少和病变不同程度缩小有关。虽然有些患者可成功停药而不出现复发,但多数患者需要持续口服西罗莫司以达到长期控制症状的目的。目前,如何将口服西罗莫司作为辅助或一线疗法最佳地整合到LMs 治疗的多学科治疗中,仍是亟待解决的临床问题。现有证据仅是从病例报道中得出的有限结论,缺乏随机对照研究的有力支持。
依维莫司是一种西罗莫司衍生物,主要通过抑制PI3K/Akt/mTOR 信号通路,起到抑制细胞生长和增殖的作用[32](推荐强度B,证据等级2c)。依维莫司临床应用时间较短,因此对其治疗LMs 详细作用的认识更加有限。依维莫司已被零星用于脉管畸形的治疗,但尚无前瞻性临床试验报道。有研究报道标签外使用依维莫司,成功治疗了卡波西样血管内皮细胞瘤[33](推荐强度C,证据等级4)。
抑制PIK3CA 是治疗PIK3CA 突变相关脉管畸形的一种有前景的策略。阿培利司(Alpelisib,Piqray®)目前在临床试验中表现出良好的耐受性,最近获得了美国食品药品监督管理局的批准,用于治疗PIK3CA 突变相关的乳腺癌。根据前期临床观察,阿培利司同情用药对患有先天性脂肪瘤增生、血管畸形、表皮痣、脊柱侧凸、骨骼、脊柱异常为主要表现的临床综合征(CLOVES 综合征)患者的生殖器LMs 有明显改善作用,患者未出现任何不良反应[34](推荐强度C,证据等级4)。对于PIK3CA 突变的复杂脉管畸形(包括LMs),症状无法控制且生活质量较差时,可尝试使用阿培利司和其他可能的PIK3CA 抑制剂进行治疗。阿培利司局部制剂也在开发中,这将有利于拓宽其在治疗局限性脉管畸形中的应用,同时减少副作用。与RAS/MAPK/ERK 信号通路中体细胞突变有关的LMs,可受益于MEK 抑制剂(如曲美替尼)的治疗[35-36](推荐强度B,证据等级2c)。其他PI3K/AKT 通路抑制剂,如ARQ 092 目前正在北美、南美以及欧洲进行治疗PROS 综合征(LMs 是其病症之一)患者的Ⅰ、Ⅱ期临床研究(NCT03094832)(推荐强度A,证据等级1a)。
3 静脉畸形
静脉畸形(venous malformations,VMs)是由畸形扩张的静脉组成的低流量病变,约40%发生于头颈部,最常累及的部位是咀嚼肌、唇和舌体,累及气道可造成气道损害和吞咽困难。大多数VMs(>90%)为散发性和单灶性,散在的VMs 与TIE2 和PIK3CA 基因的体细胞突变有关(图1)[37-38](推荐强度B,证据等级2c)。VMs 组织的TIE2 中发现了20 多个功能增强突变,以及突变诱导不依赖配体的酪氨酸磷酸化和PI3K/ AKT 信号通路的下游信号激活。在TIE2 突变阴性的VMs 中,编码PI3K 催化亚基的PIK3CA 经常被发现激活突变。研究表明,TIE2 和PIK3CA 参与相同的VMs 致病信号通路[37](推荐强度B,证据等级2c)。
Puig 等[39]根据解剖和血流动力学特征结合造影技术,对VMs 进行了系统分类(图2)(推荐强度D,证据等级5)。临床上,可依据该分类,对VMs进行针对性治疗(推荐强度D,证据等级5):Ⅰ型,彩超定位,穿刺,尽量将血液吸净,采用双针或多针技术,注射3%聚多卡醇(或聚桂醇)泡沫或2 mg/mL 平阳霉素(或博莱霉素);Ⅱ型,彩超定位,穿刺,采用双针或多针技术,注射3%聚多卡醇(聚桂醇)和(或)平阳霉素(或博莱霉素)泡沫;Ⅲ型,DSA 造影,无水乙醇或弹簧圈栓塞回流静脉或手术结扎回流静脉;采用双针或多针技术,注射无水乙醇,或3%聚多卡醇或聚桂醇(和/或平阳霉素或博莱霉素)泡沫;Ⅳ型,DSA 造影,弹簧圈栓塞回流静脉或手术结扎回流静脉,采用双针或多针技术,注射无水乙醇,或3%聚多卡醇(或聚桂醇)和(或)平阳霉素(或博莱霉素)泡沫。
VMs 的典型表现为质地柔软的肿块,无搏动感、可压缩、体位移动试验阳性,表面皮肤呈紫色或蓝色。超声显示VMs 的静脉扩张,伴或不伴静脉石。VMs 在MRI T2 加权相表现为高信号,压脂相有助于显示病变范围[1]。增强MRI 和CT 表现为初期不均匀强化,随后逐渐增强。VMs 通常比LMs明显增强,后者通常仅在周围增强,这种差异有助于鉴别诊断。与其他脉管畸形一样,创伤、感染、性激素水平波动和不充分治疗均会刺激病灶发展,超过60%的VMs 在青春期加重,因此主张对无症状的VMs 进行积极干预[40](推荐强度B,证据等级2c)。 但也有学者主张对无症状或无潜在进展可能的VMs 采取随访观察;在观察期间,一旦症状加重或美观和功能受到影响,应采取必要的干预措施[41](推荐强度D,证据等级5)。
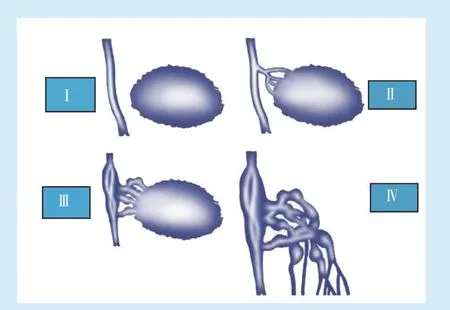
Figure 2 Venous malformations were classified according to the anatomical and hemodynamic characteristics of the lesions and adjacent veins图2 根据病灶及邻近静脉的解剖及血流动力学特征对静脉畸形进行分类
VMs 可因皮肤颜色和外形改变而导致毁容,也可因静脉淤滞和局部血管内凝血伴血栓或静脉石形成而导致间歇性疼痛和炎症。非甾体类消炎药和热敷对缓解疼痛很有帮助,对于轻、中度血栓性静脉疼痛患者,低剂量阿司匹林[2~5 mg/(kg·d),每天最大剂量为81 mg]可预防或减轻疼痛。若单纯口服阿司匹林疗效不显著,可联合使用低分子肝素预防血栓形成,改善与静脉淤滞相关的疼痛[42](推荐强度C,证据等级4)。
硬化疗法是VMs 的首选治疗方法。十四烷基硫酸钠是国外最常用的药物,十四烷基硫酸钠泡沫可延长药物在VMs 内的停留时间,增加硬化剂与血管内皮细胞的接触面积。由于十四烷基硫酸钠是腐蚀性药物,因此应尽量减少其外溢到邻近组织或流入正常静脉的可能性。建议使用双针技术,避免用过多的硬化剂填充病变,从而保持病变内容物的稳定性,并且降低非目标区硬化的风险[41]。系统综述显示,所有硬化剂都是有效的,但是由于缺乏高质量的对照研究,目前尚不能在荟萃分析中比较这些药物。然而,在更有力的证据出现前,并发症发生率的差异可能是硬化剂选择的决定性因素。由于无水乙醇并发症发生率高,局部并发症严重,故在头颈部应慎用[43](推荐强度B,证据等级3a)。一项纳入9 个研究、632 例患者的荟萃分析显示,无水乙醇治疗VMs 的疗效优于聚多卡醇和博莱霉素,但无水乙醇硬化疗法的不良反应明显多于聚多卡醇[44](推荐强度B,证据等级3a)。聚多卡醇泡沫硬化剂可提高治疗效率,同时降低用药剂量,从而减少可能的全身性副作用[41]。一项纳入37 个研究、包括2 067 例患者的系统评价发现,硬化疗法是头颈部VMs 非常安全有效的方法(表3)[45](推荐强度B,证据等级3a)。使用任何一种硬化剂经皮硬化治疗后,总体完全治愈率为64.7%。中等强度硬化剂如博莱霉素和十四烷基硫酸钠的有效率较低,但总体上比强硬化剂如乙醇、乙醇胺更安全。十四烷基硫酸钠的完全治愈率最低,为55.5%,平阳霉素的完全治愈率最高,为85.9%。任何一种硬化剂经皮硬化治疗后,患者总体满意度为91.0%,总体生活质量改善为78.9%,总体永久并发症率为0.8%,无死亡病例。
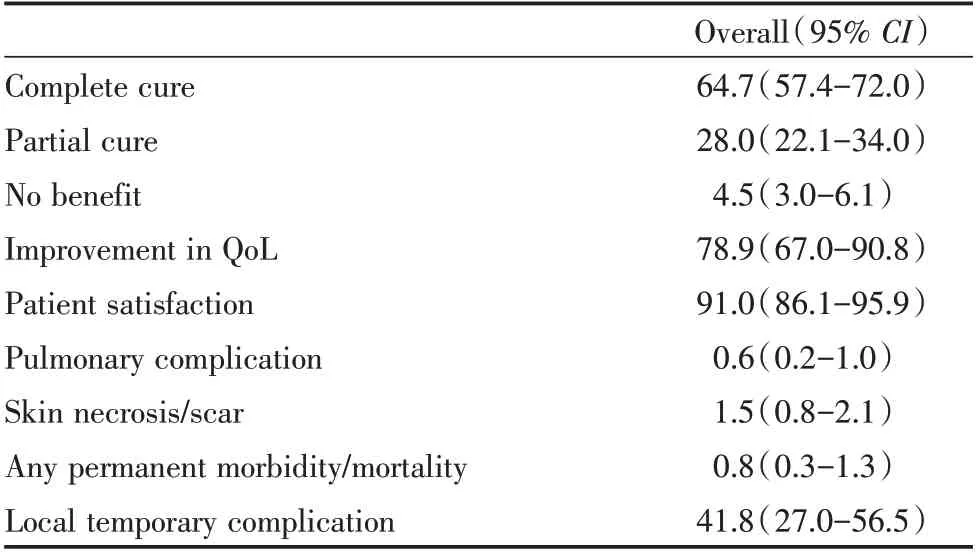
表3 静脉畸形硬化治疗总体疗效总结Table 3 Summary of the overall curative effect of sclerotherapy for venous malformations %
长脉冲Nd:YAG 激光可改善浅表黏膜VMs 的颜色和大小,目前已被用于治疗口腔、咽和喉内的黏膜VMs[46](推荐强度C,证据等级4)。当VMs 邻近重要解剖结构如面神经或视神经时,单纯手术切除可降低神经损伤风险。对伴持续疼痛或美观缺陷的患者,手术切除也是一种可行的治疗方法。VMs 的手术计划根据病变的深度、与重要结构的接近程度以及是否有黏膜受累而有所不同。未累及重要解剖结构的局限性VMs 可被完全切除。复杂VMs 通常需要结合硬化治疗和手术减瘤以控制症状,通常建议术前硬化治疗以缩小VMs体积并诱发局部血栓形成,从而减少术中出血和术后复发,且硬化治疗后的VMs 纤维化可使其更容易被切除。
对于复杂VMs,其症状无法通过上述方法控制或缓解时,可考虑口服西罗莫司。一项应用西罗莫司治疗VMs 的Ⅱ期临床试验已取得令人满意的临床效果,目前正在进行多项多中心、前瞻性Ⅳ期临床试验,以进一步评估西罗莫司治疗VMs 的安全性和有效性[47-48](推荐强度C,证据等级4)。西罗莫司可缓解与VMs 相关的难治性疼痛、肿胀和凝血功能障碍[38,49](推荐强度C,证据等级4)。一项包括10 例口服西罗莫司治疗VMs 患者的Ⅱ期临床试验证实,对于手术或硬化治疗难以取得满意疗效的广泛性VMs 患者,西罗莫司是一种有效的治疗手段,可减轻疼痛,提高患者生活质量,且患者耐受性良好[50](推荐强度A,证据等级1)。
4 动静脉畸形
动 静 脉 畸 形(arteriovenous malformations,AVMs)是一种高流量病变,在畸形动脉和回流静脉间存在异常联系。AVMs 可单独发生,也可是遗传性综合征的一种病症,如遗传性出血性毛细血管 扩 张 症(hereditary hemorrhagic telangiectasia,HHT)、同源性磷酸酶(phosphatase and tensin homolog,PTEN)错构瘤综合征、CLOVES 综合征(congenital lipomatous overgrowth,vascular malformations,and epidermal nevi syndrome,CLOVES),以及毛细血管-动静脉畸形(capillary malformation-arteriovenous malformation,CM-AVM)。颅外AVMs 发生的分子遗传学基础尚不明确,可能与TGF-β/Ras/MAPK 和PI3K/AKT 信号通路有关。颅外AVMs 最常见的突变是MAP2K1,而颅内AVMs 是KRAS 或BRAF。
约50%的颅外AVMs 位于头颈部,主要集中于面中部和口腔。Schobinger 分类系统详细描述了AVM 的自然病史[51](推荐强度D,证据等级5):Ⅰ期(静止期),皮肤变色和皮温升高;Ⅱ期(扩张期),病变增大、搏动明显;Ⅲ期(破坏期),由于静脉高压和淤滞、局部组织破坏、疼痛和大量出血而出现溃疡;Ⅳ期(失代偿期),高输出性充血性心力衰竭,在头颈部AVM 中很少见。SchobingerⅠ期AVMs 常无症状,Ⅱ期病变主要影响美观及损害功能,Ⅲ期和Ⅳ期病变则必须治疗。AVMs 的Yakes分类和相应治疗方案(表4)(图3)[52](推荐强度D,证据等级5),主要用于确定血管内入路和AVMs 栓塞药物[53](推荐强度D,证据等级5),包括了按ISSVA 分类(2018 版)归为动静脉瘘(AVF)而非动静脉畸形(AVM)的病变。
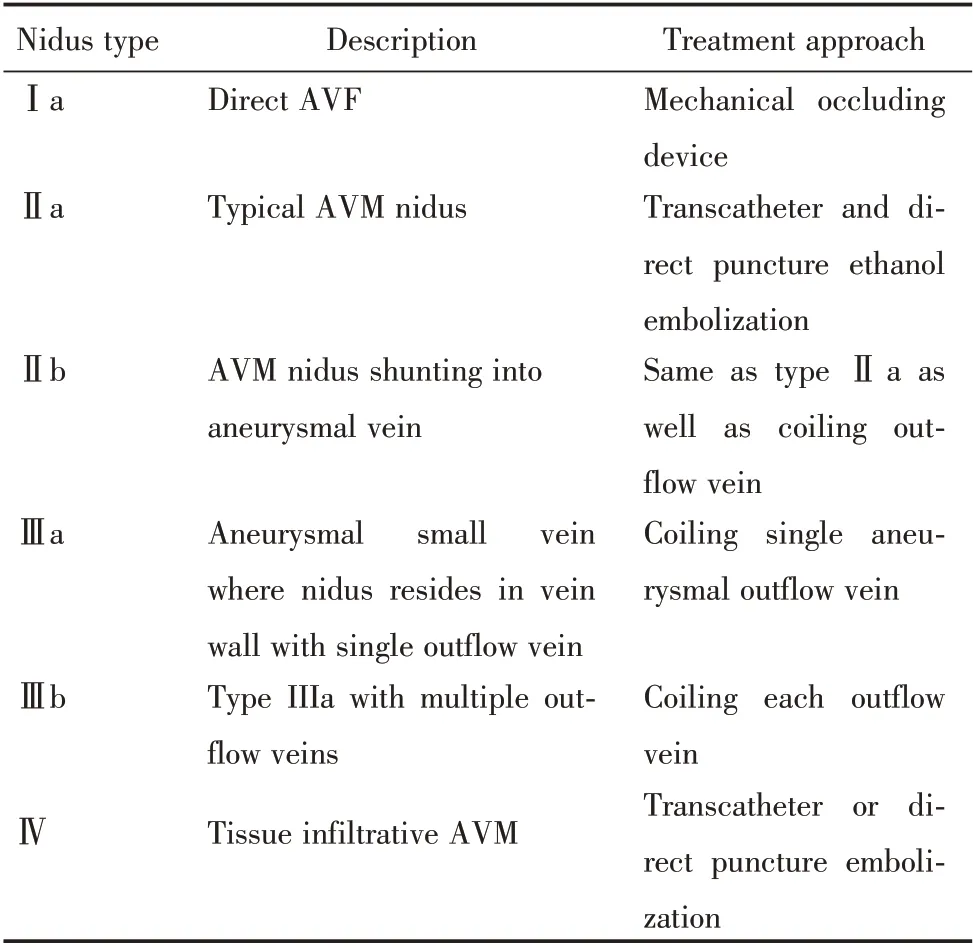
表4 动静脉畸形的Yakes 分类及相应治疗建议Table 4 Yakes classification of arteriovenous malformations and corresponding treatment recommendations
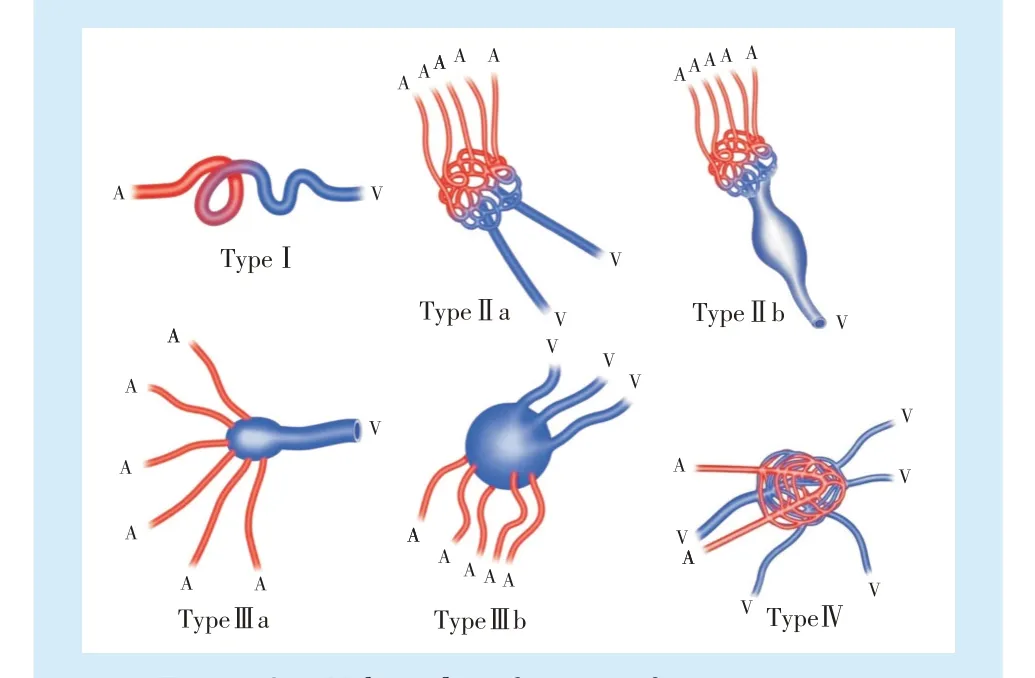
Figure 3 Yakes classification of arteriovenous malformations图3 动静脉畸形的Yakes 分类
AVMs 的处理非常复杂,治疗经验在很大程度上依赖于回顾性研究和病例报告。AVMs 无法根治,控制病情发展以缓解症状、保存重要功能是主要目标,治疗方法包括介入栓塞、手术切除、激光治疗及综合治疗。在确定AVMs 治疗时机时,需确保对患者进行长期的定期随访,以便及时发现复发。先期干预措施应治疗浅表病变,以便在深大的病灶表面形成健康的软组织形态。
AVMs 的生物学行为特殊,可像血管性胎记一样发病,但又具有局部浸润性肿瘤的特征,破坏邻近的正常组织。不当治疗可加重AVMs 病情,使后续治疗变得更加困难。有学者主张积极手术切除,以达到最佳疗效。但实际上,不当切除或广泛栓塞往往会导致病情恶化[54](推荐强度B,证据等级2c)。所有颅外AVMs 均会持续进展,并在成年期前引起组织破坏和功能缺陷[55](推荐强度C,证据等级4),若不积极干预,所有AVMs 最终都会发展为Schobinger Ⅲ期病变。
组织学上,AVMs 缺乏正常血管结构和毛细血管,影响氧气和营养在AVMs 中的自然扩散梯度,进而导致慢性缺氧和炎症。病变血管较差的稳定性和功能会阻碍正常血液层流,增加剪切应力及后续的血管修复机制。因此,AVMs 的这些特性可诱导伤口愈合、基质降解和血管生成相关分子的产生和隔离,这些分子包括血管生长因子、一氧化氮、转化生长因子、缺氧诱导因子和基质金属蛋白酶(特别是MMP-9)[56](推荐强度B,证据等级2c)。遗憾的是,恰恰是这种上调的修复机制,诱导更多异常血管的生成,导致AVMs 进一步发展。而旨在彻底消融AVMs 异常血管的干预措施,可能会进一步损害AVMs 的缺氧性血管床,刺激血管生成。这就解释了为什么过度干预常无法消除病变,反而可能导致病情加重。AVMs 难以治疗且复发率极高,Liu 等[57]报道,AVMs 手术切除后的复发率为81%,介入栓塞后的复发率为98%(推荐强度C,证据等级4)。AVMs 的治疗终点难以确定,患者必须随访多年,直到病情稳定为止。
博莱霉素和多西环素是治疗AVMs 的有效硬化剂,已被广泛使用,这些药物在控制早期AVMs的进展方面非常有效,可能是通过破坏血管内皮细胞和控制AVMs 中异常伤口愈合而发挥作用。Yan 等[58]联合使用纤维蛋白胶与平阳霉素成功缩小了颌面部AVMs(推荐强度C,证据等级4)。硬化治疗可与激光治疗结合使用。AVMs 表面可联合使用2 种激光治疗,首先使用585~595 nm 波长的脉冲染料激光,然后使用1 064 nm 的YAG 激光。对于病变范围较大或弥漫性AVMs,首先处理皮肤和黏膜,有助于保护周围软组织和神经,从而利于维持功能并改善美观。可在成功治疗皮肤和(或)黏膜后分阶段切除,并在术前行Onyx 胶栓塞治疗。AVMs 的介入栓塞极具挑战性,需要先进的血管造影工具和高超的手术技巧,常用的液体栓塞剂有3 种,即无水乙醇、乙烯-乙烯醇共聚物、Onyx 胶。
近年来,国内外研究者一直致力于寻找控制或治愈AVMs 的潜在分子和遗传靶点,已提出多个潜在药物以控制AVMs。有证据表明,西罗莫司与介入治疗联合使用,可改善AVMs 的总体复发率和预后。尽管有许多研究讨论了其潜在作用,但除辅助治疗手段外,西罗莫司无法根治AVMs。实际上,Triana 等[59]研究表明,单独使用西罗莫司治疗AVMs 的效果较差(推荐强度C,证据等级4)。Couto 等[60]对来自不同个体的AVMs 组织进行全外显子组和基因组测序发现,70%的AVMs 组织中出现MAP2K1 体细胞突变,因此认为内皮细胞功能障碍是由于MEK1 活性增加所致(推荐强度C,证据等级4)。MAP2K1 基因编码MEK1 并可能成为未来抗血管生成治疗的靶点[61](推荐强度C,证据等级4),用于治疗包括黑色素瘤和非小细胞肺癌在内的多种MEK1 抑制剂,有望成为颅外AVMs 的潜在治疗药物。曲美替尼是一种MEK1 抑制剂,目前正进行治疗复杂颅外AVMs 的Ⅱ期临床试验(NCT04258046)。研究发现,携带MAP2K1 突变基因的AVMs 患者对曲美替尼治疗反应良好,患者病变缩小、症状缓解,且耐受性良好[36]。一项使用曲美替尼治疗AVMs 的前瞻性Ⅱ期临床试验即将在比利时启动(EudraCT Number:2019-003573-26)。
总之,IH 与脉管畸形的表现多样、治疗复杂,应遵循多学科综合治疗、个体化施策的理念。尽管存在诸多挑战,但随着基因测序、分子生物学和放射成像技术的发展,脉管畸形分类的相关性和诊断的准确性在不断提高,与之相伴的是手术治疗的创新,硬化治疗、介入栓塞及靶向疗法的不断进步。
【Author contributions】Zheng JW wrote the article. Zhao ZL revised the article. All authors contributed to the article and approved the submitted version.

