海南不同区域槟榔根际土壤细菌多样性研究
马思远,王海花,林雨彬,曾若菡,刁晓平*,李 鹏
(1.热带岛屿生态学教育部重点实验室,海南 海口 571158;2.海南省热带动植物生态学重点实验室,海南 海口 571158;3.海南师范大学 生命科学学院,海南 海口 571158;4.海南大学 生态与环境学院,海南 海口 570228)
槟榔(Areca catechuL.)属棕榈科多年生常绿乔木,是热带珍贵药用植物,为四大南药之首。槟榔果实具有消积驱虫、降气行水之功效,主要用来治疗人体肠道寄生虫、食积腹痛、水肿胀满、痢疾、脚气肿痛等疾病[1]。海南省是我国槟榔的主产区[2],全省槟榔种植面积约102 530 hm2,占全国槟榔种植总面积的95%;产量约255 114吨,占全国产量的95%以上。目前海南槟榔产业年产值已超过百亿元,成为海南省重要的支柱产业[3]。
植物根际微生物对植物的健康发育有着至关重要的作用,目前植物与根际微生物的互作已成为热点研究领域之一。植物根系能通过其分泌的各种次生代谢物质使根际微生物的种类、分布和数量发生改变,对根际微生物群落结构有选择塑造作用[4],而根系分泌物介导下的植物-微生物互作对于土壤肥力及植物生长发育有着极其重要的作用[5],例如一些有机肥可以在根系分泌物介导下通过提高根际微生物多样性及微生物共现网络复杂性来提高猕猴桃的生产效率[6]。现在普遍认为根际微生物群落的宏基因组是植物体的第二基因组[7],而且植物的他感作用、连作障碍、连作促进或间套作增产等均是由其根系分泌物介导下的植物与特异微生物共同作用的结果[4]。
已有研究结果显示,微生物群落结构容易受到土壤理化性质、季节变化、海拔以及地形等外界因素影响[8-9]。即使在相同的气候和土壤条件下,不同区域的土壤微生物也会有差别[10]。高通量测序技术具有成本低、通量高等优点[11],在微生物生态学领域得到了广泛应用[12-13]。目前还未见关于槟榔根际微生物多样性的相关报道,为揭示槟榔根际微生物分布特征,本研究拟在海南省万宁市、陵水县和三亚市3个重要的槟榔种植区域采集根际土壤样品,利用Illumina MiSeq高通量测序技术系统分析3个区域槟榔根际土壤细菌群落组成及多样性,并探讨不同区域之间槟榔根际微生物的相关性,以期为研究槟榔根际微生物互作等奠定基础。
1 材料和方法
1.1 采样地点
在海南省万宁市、陵水县和三亚市3个主要槟榔种植区分别选取一个槟榔生长年份相同的地块(30 m×30 m)作为采样地点,每个采样点大约种植150棵槟榔树。采样点具体情况如表1所示。

表1 采样点概况Table 1 Overview of the sampling site
1.2 样品采集方法
将上述3个采样点分别平均划分为10个小区域,于2019年1月8—9日在每个小区域中选取3~4棵槟榔树,刨出根部,用剪刀剪下10 cm左右根系组织,收集附着在根系组织上的土壤样品。每棵树取4~5根根系,每个小区域混合为一份样品,每个采样点共10份根系组织样品,本研究共采集30份根系组织样品。另于每个采样点未种植槟榔树的空地上分别采集3份土壤样品作为对照,共采集9份对照土壤样品。在土样采集时均佩戴新的无菌手套,采集的根系组织样品装于塑封袋后迅速置于冰盒中保存。对照和根系组织样品附着的土壤用于提取根际细菌DNA、高通量测序及理化性质测定。
1.3 土壤理化性质测定
采集得到的土壤经自然晾干之后,按标准法测定样品的基本理化性质[14]。测量指标包括pH、有机质(Organic Matter,OM)、全氮(Nitrogen,N)、碱解氮(Alkali-Hydrolyzable Nitrogen,HN)、全磷(Phosphorus,P)、速效磷(Olsen-P,OP)、全钾(Kalium,K)、速效钾(Olsen-K,OK)。所有土壤样品理化性质由海南乐东香蕉枯萎病及热带作物土传病防控所进行测定。
1.4 根际土壤细菌DNA提取及测序
将采集的根际土壤样品分别放置于装有30 mL PBS缓冲液的50 mL离心管中,超声处理15 min,弃根系组织后再于8 000 rpm、4 ℃条件下离心20 min,弃上清,收集土壤样品直接进行DNA提取或置于-80 ℃冰箱备用。采用德国QIAGEN 公司的DNeasy PowerSoil Kit 试剂盒提取土壤样品DNA,利用超微量分光光度计(NanoDrop 1000)检测其DNA浓度,质量合格后进行扩增子测序分析。
以338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)为扩增细菌16S rDNA基因的引物,利用Illumina Miseq 2300测序平台对PCR扩增产物进行双端测序。
1.5 细菌多样性分析
测序完成后,经过过滤处理得到优化序列。基于97%的相似性阈值进行细菌操作分类单元(Operational Taxonomic Units,OTUs)聚类。基于分类学信息在属水平上进行群落结构分析。利用美吉云平台(https://cloud.majorbio.com)完成分析对比工作。
2 结果与分析
2.1 对照土壤样品理化性质
3个不同采样点的对照土壤样品理化性质检测结果见表2,3个采样点对照土样的pH、有机质、全钾、速效磷和速效钾等理化因子差异明显。其中,万宁采样点的pH最低,三亚采样点的pH最高;三亚采样点的有机质含量显著高于万宁和陵水采样点;陵水采样点的全钾和速效钾含量显著高于万宁和三亚采样点;三亚采样点速效磷含量最高,且显著高于万宁和陵水采样点。

表2 3个采样点对照土样的主要理化性质Table 2 Main physical and chemical properties of soil samples from three sampling sites
通过走访当地农户得知,采样前陵水采样点的农户施加过钾元素含量较高的肥料,三亚采样点的农户施加过草甘膦除草剂,可能为导致陵水采样点对照土样的钾元素含量和三亚采样点对照土样的速效磷含量均较高的主要原因。
2.2 槟榔根际土壤细菌群落多样性
通过Illumina Miseq高通量测序后,按97%相似度聚类,得到4 989个OTUs,各样品文库覆盖率均在99%以上,能够反映3个典型种植区槟榔根际土壤微生物群落的真实情况(表3)。陵水采样点根际土壤细菌的Chao1 指数为471,显著高于万宁(354)和三亚(388)(P<0.05)。万宁和三亚采样点根际土壤细菌的Shan⁃non 指数分别为2.41和2.07,显著低于陵水(3.11)(P<0.05)。陵水采样点的槟榔根际土壤细菌丰富度以及多样性都显著高于万宁和三亚,而万宁和三亚差别不大。结合陵水采样点对照土壤钾元素含量与其它两个采样点有显著差异,研究结果与姚一文等得出的钾元素含量对物种多样性影响较大相符[15]。

表3 3个采样点槟榔根际土壤细菌OTU及多样性指数Table 3 OTU and diversity index of Areca catechu rhizosphere bacteria in three sampling sites
2.3 槟榔根际土壤细菌群落结构
为解析海南省3个区域槟榔根际土壤细菌群落结构特征,本研究对聚类后的OTU代表序列进行了物种注释。3个采样点槟榔根际土壤细菌OTU 隶属于33门88纲222目387科770属。将所有相对丰度低于1%以及在该水平上没有注释结果的OTU归于其他类群。在属水平上,3个采样点槟榔根际土壤中相对丰度较高的细菌为伯克霍尔德菌属(Burkholderia)和肠杆菌属(Enterobacter),其相对丰度分别为10.94%~46.96%和12.16%~28.14%,但不同采样点的优势菌及其相对丰度存在较大差异(图1)。万宁采样点槟榔根际土壤中伯克霍尔德菌属的相对丰度最高(46.96%),其次为肠杆菌属(12.16%)和科萨克氏菌属(Kosakonia)(2.28%);陵水采样点的槟榔根际土壤中科萨克氏菌属的相对丰度最高(15.97%),其次为伯克霍尔德菌属(15.28%)和肠杆菌属(12.48%);三亚采样点槟榔根际土壤中假单胞菌属(Pseudomonas)的相对丰度最高(31.47%),其次为肠杆菌属(28.14%)和伯克霍尔德菌属(10.94%)。此外,芽孢杆菌属(Bacillus)和不动杆菌属(Acinetobacter)的相对丰度也都超过了1%。
在属水平上分析3个采样点槟榔根际土壤细菌群落结构后发现3个采样点的槟榔根际土壤样品中共同含有的属有431个,陵水采样点独有71个属,万宁和三亚采样点分别独有46和45个属(图2A)。在共有的属中,伯克霍尔德菌属的相对丰度最高,占总核心菌属的23.40%,其次是肠杆菌属(17.70%)、假单胞菌属(11.90%)、科萨克氏菌属(8.94%)、芽孢杆菌属(3.78%)、Enterobacteriacead(1.76%)、不动杆菌属(1.60%)和Subgroup-2(1.24%)等(图2B)。伯克霍尔德菌属、肠杆菌属、科萨克氏菌属以及假单胞菌属同属于变形菌门(Proteobacteria),上述结果说明变形菌门的细菌在槟榔根际土壤生态环境构建和物质循环中发挥着重要的作用。同时,已有研究人员发现变形菌门的细菌是多种土壤环境的优势菌[16-17],说明其生态幅较宽,对土壤环境有较强的适应能力。本研究中,除了变形菌门的细菌外,酸杆菌门(Acidobacteria)的Acidobacteriales和Subgroup-2相对丰度也较高,可能与3个采样点土壤酸性均较强有关[18]。

图1 三个采样点槟榔根际土壤细菌群落相对分布特征Figure 1 Relative redundancies characteristics of Areca catechu bacterial community structure in three sam⁃pling sites at genus level

图2 槟榔根际土壤细菌核心类群Figure 2 Bacterial core groups of areca rhizosphere soil
分别对3个采样点两两共有的相对丰度较高的槟榔根际土壤细菌进行组间差异分析后发现,万宁和陵水采样点槟榔根际土壤细菌中伯克霍尔德菌属和芽孢杆菌属的相对丰度有极显著差异(P<0.01),而假单胞菌属、热酸菌属(Acidothermus)和Xanthoacteraceae的相对丰度有显著性差异(P<0.05)(图3);万宁和三亚采样点槟榔根际土壤细菌中伯克霍尔德菌属、假单胞菌属、芽孢杆菌属、热酸菌属和不动杆菌属的相对丰度有极显著差异(P<0.01),肠杆菌属的相对丰度有显著性差异(P<0.05)(图4);陵水和三亚采样点槟榔根际土壤细菌中假单胞菌属的相对丰度有极显著差异(P<0.01),肠杆菌属和克雷白氏杆菌属(Kisbsiella)的相对丰度有显著性差异(P< 0.05)(图5)。其中,假单胞菌属的相对丰度在3 组分析中均有显著性差异(P<0.05),三亚采样点的相对丰度最高(31.47%),万宁采样点最低(0.36%)。已有研究表明假单胞菌属的某些菌株可以帮助修复环境,例如使用变形假单胞菌2,4-D 处理的大麦种子在土壤中发芽和生根的概率会提高[19]。笔者在田间调查时发现,三亚采样点槟榔根系生长整齐且粗壮,明显好于万宁和陵水采样点的槟榔根系,可能与其假单胞菌属的相对丰度较高有关。

图3 万宁(WN)和陵水(LS)采样点槟榔根际土壤细菌相对丰度差异分析Figure 3 Difference analysis of relative abundance of soil bacteria in Areca catechu rhizosphere between WN and LS

图4 万宁(WN)和三亚(SY)采样点槟榔根际土壤细菌相对丰度差异分析Figure 4 Difference analysis of relative abundance of soil bacteria in Areca catechu rhizosphere between WN and SY

图5 陵水(LS)和三亚(SY)采样点槟榔根际土壤细菌相对丰度差异分析Figure 5 Difference analysis of relative abundance of soil bacteria in Areca catechu rhizosphere between LS and SY
2.4 槟榔根际土壤细菌互作网络
共现网络的探索是确定微生物群落中发生生物相互作用的一种有效途径[20]。本研究选用Pearson模型,以相对系数绝对值≥0.5、Pvalue<0.05对不同采样点槟榔根际土壤细菌中相对丰度排在前50位的属进行单因素网络分析。结果发现,万宁和陵水采样点的单因素网络是连通的,网络直径分别为8和6,节点间平均最短路径长度分别为2.795 和2.236。在万宁采样点,网络中心性数值最高的节点为变形菌门(Proteobacte⁃ria)的Micropepsaceae属,可以和26个属进行互作,且全部为正相关(图6)。在陵水采样点,网络中心性数值最高的节点是绿弯菌门(Chloroflexi)的Subgroup-6属,与其它27个属互作频繁,且多数为正相关,但是与变形菌门的2个属呈负相关(图7)。在三亚采样点,网络中心性数值最高的节点是酸杆菌门(Acidobacteria)的独活假丝酵母属(Candidatus Solibacter),与其它23个属相关性较强,且全部为正相关(图8)。Chen等研究发现,控制微生物群落的潜在因素因空间规模而异[21]。本研究中,3个采样点槟榔根际土壤细菌互作模式存在明显的差异,可能与不同采样点土壤理化性质和植物群落功能属性不同有关。已有报道表明,独活假丝酵母属是分解有机质、利用碳源的菌属,其相对丰度与土壤有机质含量正相关[22]。本研究中,三亚采样点的独活假丝酵母属与其他属的相关性较强,可能与三亚采样点土壤的有机质含量较高有关。
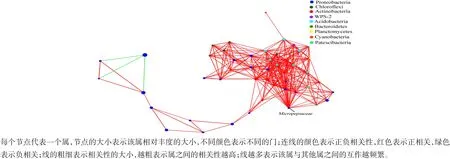
图6 万宁(WN)采样点槟榔根际土壤细菌互作网络Figure 6 Bacterial interaction network in Areca catechu rhizosphere soil in Wanning sampling sites

图7 陵水(LS)采样点槟榔根际土壤细菌互作网络Figure 7 Bacterial interaction network in Areca catechu rhizosphere soil in Lingshui sampling sites

图8 三亚(SY)采样点槟榔根际土壤细菌互作网络Figure 8 Bacterial interaction network in Areca catechu rhizosphere soil in Shanya sampling sites
3 结论
万宁、陵水和三亚3个区域槟榔根际土壤细菌群落结构存在明显差异。共获得4 989个OTUs,隶属于33门770属,伯克霍尔德菌属、肠杆菌属和假单胞菌属相对丰度较高。假单胞菌属在三个区域间存在显著性差异,其中三亚采样点的相对丰度最高(31.47%),万宁采样点最低(0.36%)。对3个地区槟榔根际土壤细菌群落中相对丰度排在前50位的属进行单因素网络分析的结果显示,3个采样点槟榔根际土壤细菌互作模式存在明显的差异,Micropepsaceae、Subgroup-6和独活假丝酵母属在互作网络中与其他微生物类群密切互作。

