补阳还五汤苷类组分调控动脉粥样硬化炎性反应及脂质代谢的作用机制
傅馨莹,杨仁义,孙正骥,李艳玲,龙清吟,李俊熙,吴 露,张 伟*
1.湖南中医药大学,湖南 长沙 410208
2.浏阳市中医医院,湖南 浏阳 410300
动脉粥样硬化(atherosclerosis,AS)与血管内膜下的脂质蓄积及局部血管炎性反应密切相关,氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)在血管内膜下聚集,巨噬细胞吞噬ox-LDL形成的泡沫细胞不断增多,释放大量炎性因子,局部血管发生炎性反应,促进脂质蓄积和细胞泡沫化,最终形成粥样斑块。AS病变过程中,脂质蓄积常伴有炎性反应的发生[1]。《动脉粥样硬化中西医结合诊疗专家共识》[2]指出,抗AS的关键在于早期干预血脂异常、肥胖、高血压等危险因素,他汀类药物能够显著降低低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平并升高高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平,具有稳定或消退粥样斑块的作用,可以降低心脑血管疾病发生率。他汀类药物可以有效地调脂稳斑,但其抑制血管炎性反应作用较弱,目前临床上尚无特异性针对动脉粥样硬化炎性反应的有效药物。《动脉粥样硬化中西医结合诊疗专家共识》规范了中西医诊疗方案,将AS分为痰瘀互结、气阴两虚、气虚血瘀、气滞血瘀4证,面色淡白而乏力身倦,伴有气虚懒言,痛如针刺,舌暗或紫斑,脉沉而涩者,可予以补阳还五汤治之[3]。补阳还五汤能够降低斑块内巨噬细胞含量,抑制泡沫细胞形成[4];抑制斑块中脂质蓄积及炎性因子分泌,抑制炎性反应,加速脂质代谢[5]。
课题组前期研究表明,补阳还五汤苷类组分具有抑制炎性因子表达、减少炎性因子生成的作用[6-7];补阳还五汤苷类组分可以抑制血管内膜增生,具有修复内皮的作用,可能与调节血脂水平、改善局部微环境有关[8],但补阳还五汤苷类组分抗炎及调血脂的作用机制尚不明确。近年来,中西医结合治疗模式展现出协同增益效用,基于此推测补阳还五汤苷类组分与阿托伐他汀在治疗AS炎性反应和脂质代谢上具有协同作用。本研究基于网络药理学系统分析补阳还五汤苷类组分与阿托伐他汀治疗AS的作用机制,从生物信息学角度挖掘出二者的潜在靶点及作用通路,并用体外实验进行验证,为中西医结合抗AS奠定药物基础,为后续临床转化研究提供新方向。
1 方法
1.1 网络药理学分析
1.1.1 数据库及软件 PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/);Swiss Target Prediction数据库(http://www.swisstargetprediction.ch/);GeneCards数据库(https://www.genecards.org/);OMIM数据库(https://omim.org/);中医药整合药理学研究平台(TCMIP,http://www.tcmip.cn/TCMIP/index.php/Home/);String数据库(https://string-db.org/);WebGestalt数据库(http://www.webgestalt.org/#);DAVID数据库(https://david.ncifcrf.gov/);Cytoscape 3.7.2软件。
1.1.2 药物作用靶点预测 将补阳还五汤苷类组分的主要成分黄芪甲苷、芍药苷、苦杏仁苷及阿托伐他汀录入PubChem数据库,收集其化学结构式;将各化学结构式导入Swiss Target Prediction数据库对作用靶点进行预测,获得作用靶点,整合4个成分作用靶点并去除重复值,获得药物相关作用靶点。
1.1.3 疾病相关靶点预测 以“atherosclerosis”“atherogenesis”为关键词,在GeneCards、OMIM及TCMIP数据库检索相关靶点信息,整合3个数据库检索结果并去除重复值,获得疾病相关靶点。
1.1.4 药物-疾病靶点筛选 取交集,获得药物活性成分与AS的共同靶点,绘制韦恩图。
1.1.5 药物-疾病靶点蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建 将所得到的共同靶点导入String数据库,获取PPI网络图,并导入Cytoscape,使PPI网路可视化。利用cytoHubba插件对共同靶点进行拓扑分析,选取富集于前20的靶点,得到网络图。
1.1.6 药物-疾病共同靶点基因本体(gene ontology,GO)及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 通过WebGestalt数据库,将共同靶点进行GO富集分析,分别导出生物过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF)富集分析数据,进行“加权集合覆盖”分析;将共同靶点导入DAVID数据库,进行KEGG通路富集分析,利用Cytoscape软件对前20的通路与该通路涉及靶点构建“靶点-通路”网络。
1.2 实验验证
1.2.1 动物 SPF级雄性SD大鼠20只,5~6周龄,体质量180~200 g,购自湖南斯莱克景达实验动物有限公司,动物合格证号SCXK(湘)2019-000。动物饲养于湖南中医药大学实验动物中心,昼夜交替各12 h,温度21~26 ℃,湿度40%~50%。动物实验经湖南中医药大学实验动物伦理委员会批准(伦理号LL2019102503)。
1.2.2 细胞 小鼠单核巨噬细胞RAW264.7购自中国科学院上海生命科学研究院细胞细胞库。
1.2.3 药材 补阳还五汤由黄芪60 g、赤芍9 g、川芎6 g、当归9 g、地龙9 g、红花9 g、桃仁9 g组成,黄芪(批号190902)、赤芍(批号190701)、川芎(批号190902)、当归(批号190802)、地龙(批号191001)、红花(批号190901)、桃仁(批号191101)购自湖南新汇医药有限公司,经湖南中医药大学第一附属医院左亚杰教授鉴定分别为豆科植物蒙古黄芪Astragalus membranaceus(Fisch.) Bge.var.mongholicus(Bge.) Hsiao的干燥根、毛茛科植物川赤芍PaeoniaveitchiiLynch.的根、伞形科植物川芎LigusticumchuanxiongHort.的根茎、伞形科植物当归Angelica sinensis(Oliv.) Diels.的根尾、钜蚓科动物参环毛蚓Pheretima aspergillum(E.Perrier)的去内脏全体、菊科植物红花Carthamus tinctoriusL.的花、蔷薇科植物桃AmygdaluspersieaLinn.的干燥成熟种子,均符合《中国药典》2020年版规定。
1.2.4 药品与试剂 阿托伐他汀片(批号H20133127,10 mg/片)购自浙江乐普药业股份有限公司;DMEM高糖培养基(批号PM150210)、特级胎牛血清(fetal bovine serum,FBS,批号164210-500)购自武汉普诺赛生命科技有限公司;ox-LDL(批号YB-002)购自广州奕源生物科技有限公司;CCK8试剂盒(批号BS350B)购自上海白鲨生物科技有限公司;油红O染色液(批号G1262-4)购自北京索莱宝科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒(批号分别为E-EL-M0049c、E-EL-M0044c)购自武汉伊莱瑞特生物科技股份有限公司;细胞总胆固醇(total cholesterol,TC)、游离胆固醇(free cholesterol,FC)试剂盒(批号分别为E1015-50、E1016-50)购自北京普利莱基因技术有限公司;BCA蛋白定量试剂盒(批号70-PQ0012)购自上海碧云天天生物科技有限公司;ECL高效化学发光试剂盒(批号GE2301-100)购自美国Genview公司;Janus蛋白酪氨酸激酶2(Janus kinase-2,JAK2)抗体、磷酸化JAK2(p-JAK2)抗体、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)抗体、p-STAT3抗体(批号分别为ab108596、ab32101、ab68153、ab76315)购自英国Abcam公司;β-actin抗体、HRP标记的山羊抗兔IgG抗体(批号分别为02536-1-AP、SA00001-2)购自武汉三鹰生物技术有限公司;总RNA提取试剂盒(批号DP419)购自北京天根生化科技有限公司;逆转录试剂盒、扩增试剂盒(批号E047、E096)购自上海近岸科技有限公司;JAK2、STAT3、β-actin引物由南京金斯瑞生物科技有限公司合成。
1.2.5 仪器 CO2培养箱(德国Heraeus公司);SW-CJ-1FD超净工作台(苏州苏净仪器自控设备有限公司);Cytation 3型多功能酶标仪(美国Bio-Tek公司);Heraeus Fresco 17型超速冷冻离心机(美国Thermo Fisher Scientific公司);T100 Thermal Cycler qRT-PCR仪、Gel Doc XR+凝胶成像系统、Mini-PROTEAN Tetra型电泳槽、Mini Trans-Blot型转印槽(美国Bio-Rad公司)。
1.2.6 补阳还五汤的制备 补阳还五汤浸膏由湖南中药研究所制备,取原方药材,浸泡30 min后,加入12倍量水煎煮2 h,滤过;再加入10倍量水煎煮1.5 h,滤过;合并2次滤液,浓缩至100 mL,减压干燥浓缩为干膏(21.32 g/付),不加辅料打磨成粉,密封备用。补阳还五汤浸膏稀释后,经大孔树脂色谱、高效液相色谱等方法提取苷类组分浸膏(1.286 6 g/付)[9]。原方提取物和苷类组分提取物以高效液相色谱法进行质控检测,苷类组分中的黄芪甲苷、苦杏仁苷、芍药苷质量分数分别为37.98、5.48、103.6 mg/g[10]。
1.2.7 含药血清的制备 根据前期预实验结果,SD大鼠随机分为对照组、补阳还五汤(10.8 g/kg)组、苷类组分(0.64 g/kg)组和阿托伐他汀(0.9 mg/kg)组,每组5只。各给药组ig相应药物,对照组ig等体积0.9%氯化钠溶液,2次/d,连续7次。于末次给药2 h后,大鼠ip 10%戊巴比妥钠麻醉,腹主动脉取血,取血后脱颈椎处死。全血3000 r/min离心15 min,取上层血清,分别得到空白血清、补阳还五汤血清、苷类组分血清及阿托伐他汀血清,于恒温水浴锅56 ℃灭活30 min,滤过分装,于-80 ℃保存。
1.2.8 ox-LDL对RAW264.7细胞存活率的影响 取处于对数生长期的RAW264.7细胞,以1×105/孔接种于96孔板,待细胞贴壁。设置对照组和ox-LDL(25、50、75、100、125 μg/mL)组,各给药组加入相应溶液,对照组加入含10% FBS的DMEM培养基,分别培养0、3、6、12、24、48 h,加入CCK8试剂,于37 ℃、5% CO2恒温培养箱孵育40 min,采用酶标仪测定450 nm处的吸光度(A)值,计算细胞存活率。
细胞存活率=(A给药-A空白)/(A对照-A空白)
1.2.9 ox-LDL对RAW264.7细胞泡沫化的影响 在确定对RAW264.7细胞活力无影响的ox-LDL质量浓度范围(0~100 μg/mL)及刺激时间(0~24 h)后,将处于对数生长期的RAW264.7细胞以2.5×105/孔接种于放有细胞爬片的24孔板中,待细胞贴壁。加入ox-LDL(50 μg/mL),分别培养0、3、6、12、24 h,以确定ox-LDL对RAW264.7细胞泡沫化的合适时间;加入含不同质量浓度ox-LDL(0、25、50、75、100 μg/mL)的10% FBS DMEM培养基,培养24 h,以确定ox-LDL对RAW264.7细胞泡沫化的合适质量浓度。取出细胞,按试剂盒说明书进行染色,甘油封片。染色后细胞内可见明显红色脂质颗粒。
1.2.10 CCK8法确定含药血清作用于RAW264.7细胞的浓度和时间 将处于对数生长期的RAW264.7细胞以1×105/孔接种于96孔板,待细胞贴壁。设置对照组和空白血清(1%、5%、10%、15%、20%)组,空白血清组加入含不同浓度空白血清的DMEM培养基,对照组加入含10% FBS的DMEM培养基,培养24 h,加入CCK8试剂,于37 ℃、5% CO2恒温培养箱孵育40 min,采用酶标仪测定450 nm处的A值,计算空白血清对细胞生长的抑制率,获得无细胞毒性的含药血清浓度。
细胞抑制率=(A对照-A给药)/(A对照-A空白)
1.2.11 细胞分组及干预 在确定造模条件后,将处于对数生长期的RAW264.7细胞以1×106/孔接种于6孔板,待细胞贴壁。设置对照组、模型组、补阳还五汤(10%)组和苷类组分高、中、低剂量(10.0%、5.0%、2.5%)组及阿托伐他汀(10%)组。对照组和模型组加入10%空白血清,苷类组分高剂量组加入10%苷类组分血清,苷类组分中剂量组加入5%苷类组分血清和5%空白血清,苷类组分低剂量组加入2.5%苷类组分血清和7.5%空白血清,补阳还五汤组和阿托伐他汀组分别加入10%补阳还五汤血清及10%阿托伐他汀血清,预处理3 h;再加入含ox-LDL(75 μg/mL)的含药或空白血清的DMEM培养基干预24 h。
1.2.12 含药血清对RAW264.7细胞内脂质含量的影响 按“1.2.11”项下方法处理细胞和分组,弃去培养基,PBS洗涤3次,加入裂解液反应10 min,离心取上清,采用BCA蛋白定量试剂盒测定蛋白浓度。按试剂盒说明书测定各组细胞内TC及FC含量,胆固醇酯(cholesteryl ester,CE)为TC与FC的差值,CE/TC>50%为泡沫细胞模型的标准[11]。
1.2.13 含药血清对RAW264.7细胞泡沫化程度的影响 按“1.2.11”项下方法处理细胞和分组,进行油红O染色,于显微镜下随机观察6个不重合的视野,取细胞内含有5个以上较大红色染料颗粒作为泡沫细胞形成的标准[12],计数泡沫化细胞并计算泡沫细胞阳性率。
泡沫细胞阳性率=泡沫细胞数/细胞总数
1.2.14 ELISA检测含药血清对RAW264.7细胞上清液中TNF-α和IL-6水平的影响 按“1.2.11”项下方法处理细胞和分组,吸取上清,离心,收集上清液,按ELISA试剂盒说明书测定细胞上清液中TNF-α和IL-6水平。
1.2.15 Western blotting检测含药血清对RAW264.7细胞JAK2、p-JAK2、STAT3和p-STAT3蛋白表达的影响 按“1.2.11”项下方法处理细胞和分组,收集各组细胞,加入含蛋白酶抑制剂、磷酸酶抑制剂的RIPA蛋白裂解液,提取细胞总蛋白,采用BCA蛋白定量试剂盒测定蛋白质量浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%牛奶或牛血清白蛋白室温封闭90 min,分别加入β-actin(1∶6000)、JAK2(1∶2000)、p-JAK2(1∶2000)、STAT3(1∶2000)和p-STAT3(1∶2000)抗体,4 ℃孵育过夜;加入HRP标记的山羊抗兔IgG抗体(1∶6000),37 ℃孵育60 min;采用ECL高效化学发光试剂盒显影,并用Image Lab 4.0软件进行定量分析。
1.2.16 qRT-PCR检测含药血清对RAW264.7细胞JAK2和STAT3mRNA表达的影响 按“1.2.11”项下方法处理细胞和分组,按照试剂盒说明书提取细胞总RNA并合成cDNA,进行qRT-PCR分析。引物序列:JAK2上游引物5’-CGCTCAGACAGTATCATCT-3’,下游引物5’-CTCCAACTTCTCTTCTTACAC-3’;STAT3上游引物5’-AGGACATCAGTGGCAAGA-3’,下游引物5’-AGGTAGACAAGTGGAGACA-3’;β-actin上游引物5’-TTCCAGCCTTCCTTCTTG-3’,下游引物5’-GGAGCCAGAGCAGTAATC-3’。
1.3 统计学分析
使用SPSS 23.0软件进行统计,计量资料以±s表示,组间比较若符合正态性且方差齐性时,采用单因素方差分析LSD法进行两两比较;方差不齐时,采用Tamhane’sT2法进行两两比较;若不符合正态性时,采用Kruskal-Wallis秩和检验。计数资料以率表示,采用χ2检验分析。
2 结果
2.1 网络药理学分析
2.1.1 药物抗AS靶点预测 通过Swiss Target Prediction数据库获得药物主要成分相关作用靶点163个,其中黄芪甲苷26个、芍药苷24个、苦杏仁苷38个、阿托伐他汀100个。通过GeneCards、OMIM及TCMIP得到疾病相关作用靶点1165个。通过Bioinformatics Gent数据库取交集,获得药物-疾病共同靶点65个,韦恩图见图1。
2.1.2 共同靶点PPI网络分析 将共同靶点导入String数据库及Cytoscape软件,获得有63个靶点的PPI网络图,见图2。用CytoHubba插件对PPI网络图进行拓扑分析,得到富集于前20靶点的网络图,见图3。度值、紧密度、介数从高到低的前5位为相同靶点,依次为TNF、蛋白激酶B(protein kinase B,AKT1)、血管内皮生长因子A(vascular endothelial growth factor-A,VEGFA)、STAT3、半胱氨酸蛋白酶-3(Caspase-3,CASP3),表明这些靶点在整个网络中影响能力大,受其他靶点的影响小,在治疗AS中发挥重要的作用。

图2 “药物-疾病”靶点PPI网络Fig.2 PPI network of “drug-disease” targets

图3 度值 (A)、紧密度 (B) 和介数 (C) 拓扑分析图Fig.3 Topology analysis diagram of degree (A), closeness (B) and betweenness (C)
2.1.3 GO和KEGG通路富集分析 通过WebGestalt数据库,获得GO富集分析结果,其中BP分析结果260个、CC分析结果2个、MF分析结果17个。GO富集分析显示,共同靶点主要分布于细胞外基质、膜区,通过调节转录因子、内肽酶、磷脂酰肌醇激酶等活性以及与磷酸酶、糖胺聚糖、脂多糖、细胞因子受体等结合的方式,参与炎性反应的调节、白细胞迁移、肌细胞增殖、脂质定位、传导细胞内受体信号等生物过程。通过DAVID数据库,获得KEGG通路富集分析结果,共富集78条通路,“靶点-通路”网络见图4,药物主要通过参与HIF-1、JAK/STAT、Rap1、VEGF等信号通路治疗AS。
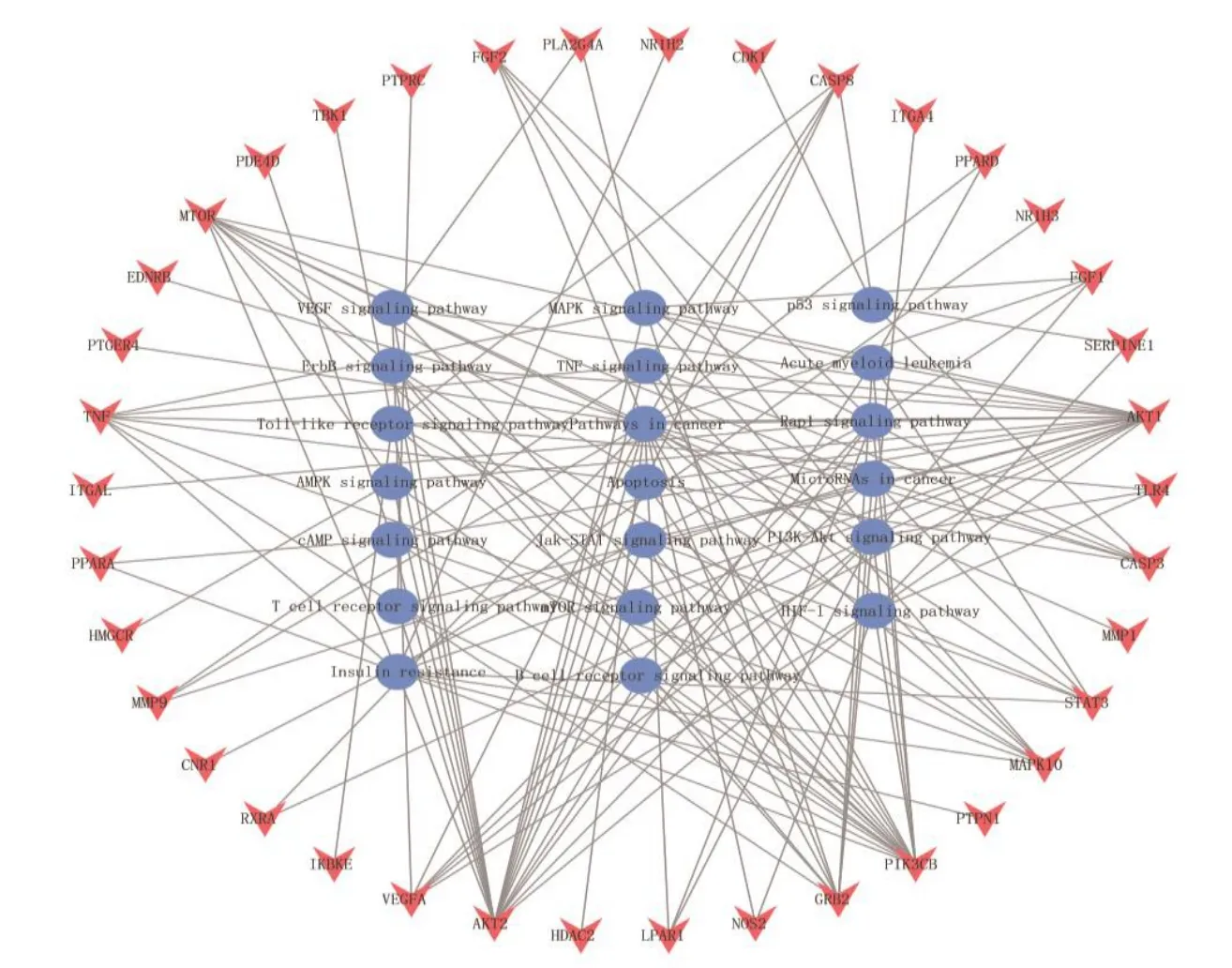
图4 “靶点-通路”网络Fig.4 “Target-pathway” network
2.2 实验验证
结合网络药理学分析结果,为进一步探讨补阳还五汤苷类组分与阿托伐他汀在治疗AS的作用,本研究基于JAK2/STAT3信号通路,以炎性反应和脂质代谢异常为切入点,在RAW264.7细胞泡沫化模型中研究联合用药对脂质含量、泡沫化程度及炎性因子的影响,为中西医结合治疗AS的协同增益效用提供实验基础。
2.2.1 ox-LDL对RAW264.7细胞活力的影响 如表1所示,与对照组比较,ox-LDL(125 μg/mL)作用于RAW264.7细胞3、6、12、48 h均显著降低细胞活力(P<0.05、0.01),抑制细胞增殖;ox-LDL(50、75、100 μg/mL)作用于RAW264.7细胞48 h显著降低细胞活力(P<0.05、0.01)。ox-LDL(0~100 μg/mL)作用于RAW264.7细胞0~24 h,细胞活力无明显影响。
表1 ox-LDL对RAW264.7细胞活力的影响 (±s , n=6)Table 1 Effect of ox-LDL on viability of RAW264.7 cells (±s , n=6)

表1 ox-LDL对RAW264.7细胞活力的影响 (±s , n=6)Table 1 Effect of ox-LDL on viability of RAW264.7 cells (±s , n=6)
与对照组比较:#P<0.05 ##P<0.01#P < 0.05 ##P < 0.01 vs control group
组别 剂量/(μg·mL-1) 细胞存活率/%0 h 3 h 6 h 12 h 24 h 48 h对照 — 100.00 100.00 100.00 100.00 100.00 100.00 ox-LDL 25 100.00 98.29±8.65 99.51±12.05 114.26±12.14# 105.22±6.45 105.76±5.79 50 100.00 101.03±9.54 99.22±7.23 95.65±10.62 105.31±7.46 91.40±2.12#75 100.00 96.91±5.36 95.16±6.55 94.85±7.04 101.63±5.87 70.59±5.99##100 100.00 92.86±10.61 94.70±10.88 93.51±6.00 100.24±3.94 58.96±2.32##125 100.00 91.66±7.54# 93.75±3.32# 83.68±6.31## 94.45±3.86 28.70±10.75##
2.2.2 ox-LDL对RAW264.7细胞泡沫化的影响 细胞吞噬ox-LDL后,细胞内脂质大量积聚形成泡沫细胞,为了确定ox-LDL诱导RAW264.7细胞泡沫化的最佳时间和最佳质量浓度,通过油红O染色检测ox-LDL干预后RAW264.7细胞泡沫化程度。如图5所示,与对照组相比,ox-LDL(50 μg/mL)作用于细胞后,胞内脂质明显增多,泡沫化程度逐渐增加,呈时间相关性。如图6所示,随着ox-LDL质量浓度的增加,细胞泡沫化程度逐渐增强;当ox-LDL质量浓度为75 μg/mL时,细胞内有大量脂质存在,细胞体积增大,多呈圆形,泡沫化程度较高,其后泡沫化程度未见明显增高。由此确定以ox-LDL(75 μg/mL)刺激RAW264.7细胞24 h为造模条件。
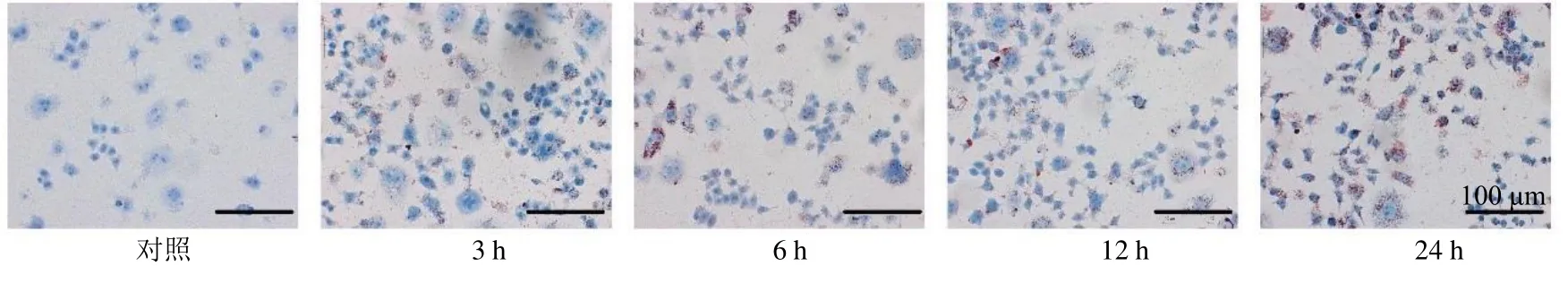
图5 ox-LDL (50 μg/mL) 对RAW264.7细胞泡沫化的影响 (×200)Fig.5 Effect of ox-LDL (50 μg/mL) on foaming of RAW264.7 cells (× 200)
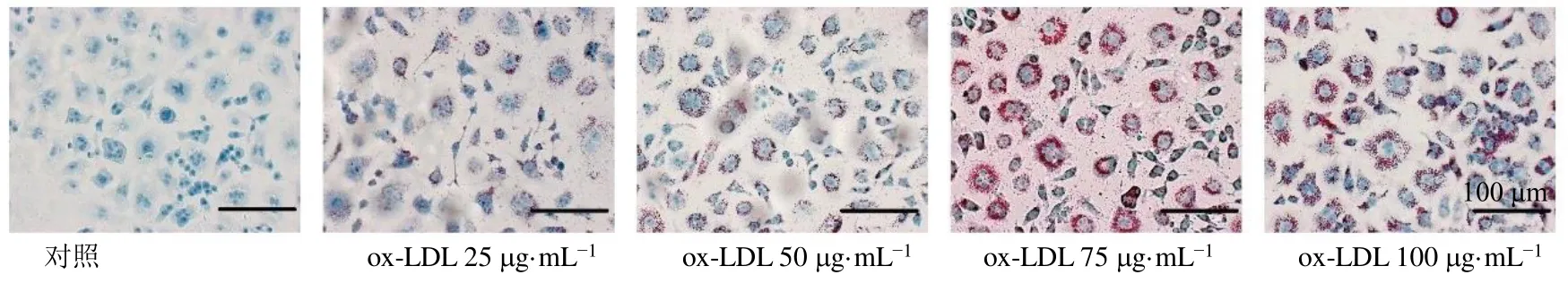
图6 ox-LDL对RAW264.7细胞泡沫化的影响 (×200)Fig.6 Effect of ox-LDL on foaming of RAW264.7 cells (× 200)
2.2.3 空白血清的细胞毒性实验 如图7所示,与对照组比较,血清浓度为1%、5%、15%、20%时,对细胞有明显的抑制作用(P<0.05、0.01)。因此,选取10%血清浓度为无细胞毒性的血清浓度。
2.2.4 含药血清对RAW264.7细胞内脂质含量的影响 如图8所示,与对照组相比,模型组细胞内TC、FC、CE含量和CE/TC值明显升高(P<0.01);与模型组相比,补阳还五汤、苷类组分高、低剂量组以及阿托伐他汀组细胞内TC、FC、CE含量显著降低(P<0.01),苷类组分中剂量组细胞内TC、CE含量显著降低(P<0.01),苷类组分高、中剂量组以及阿托伐他汀组细胞内CE/TC值显著降低(P<0.05、0.01)。
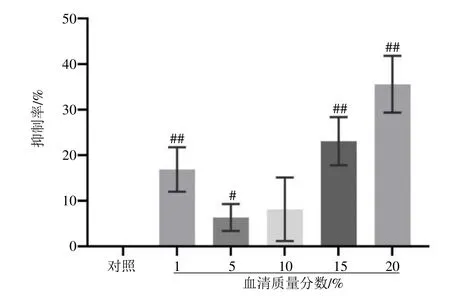
图 7 空白血清对 RAW264.7细胞抑制率的影响(±s , n=6)Fig.7 Effect of blank serum on inhibition rate of RAW264.7 cells (±s , n=6)
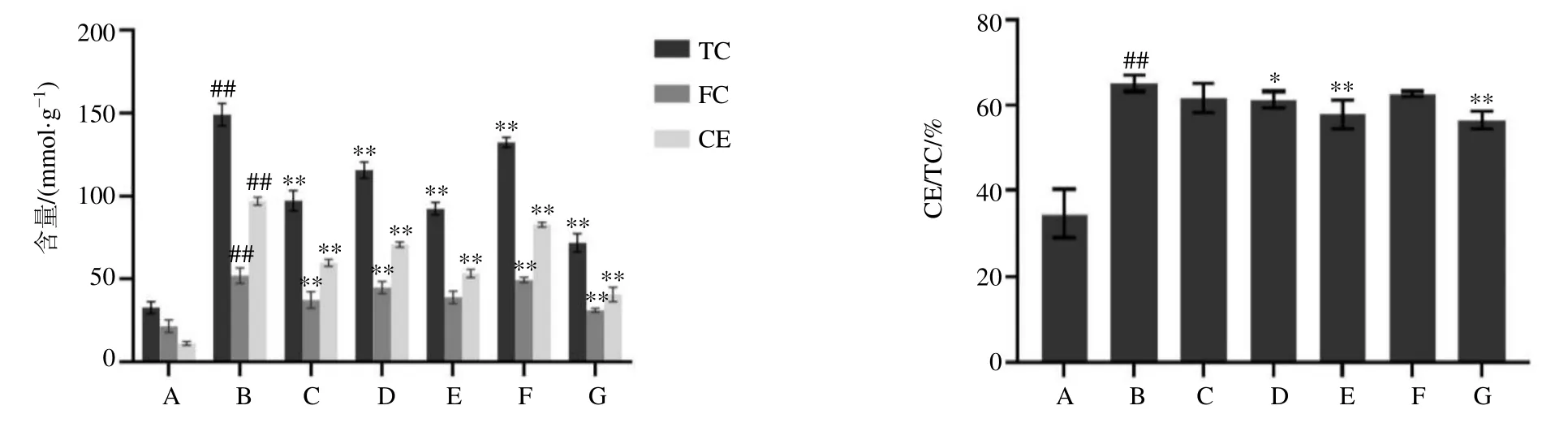
图8 含药血清对RAW264.7细胞内TC、FC、CE含量及CE/TC的影响 (±s , n=6)Fig.8 Effect of blank serum on contents of TC, FC, CE and CE/TC in RAW264.7 cells (±s , n=6)
2.2.5 含药血清对RAW264.7细胞泡沫化程度的影响 如图9和表2所示,对照组细胞形态多呈梭形,细胞内无明显脂质聚集,泡沫化细胞少。与对照组相比,模型组细胞多呈圆形,体积有明显的增大,胞内大量脂质积聚,泡沫化细胞显著增多(P<0.01)。与模型组相比,补阳还五汤组、苷类组分中剂量组细胞内脂质积聚减少,泡沫化细胞显著减少(P<0.05);阿托伐他汀组细胞内脂质积聚显著减少,泡沫化细胞显著减少(P<0.01);苷类组分高、低剂量组细胞内脂质积聚减少。
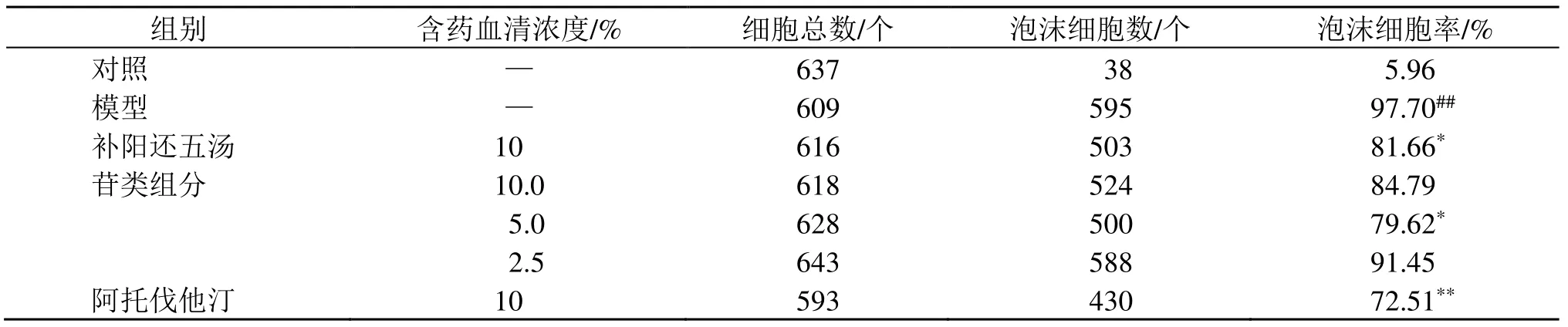
表2 油红O染色泡沫化细胞相对含量Table 2 Relative content of foamed cells stained with oil red O

图9 含药血清对ox-LDL干预的RAW264.7细胞泡沫化的影响 (×400)Fig.9 Effect of drug-containing serum on foaming of RAW264.7 cells intervened by ox-LDL (× 400)
2.2.6 含药血清对RAW264.7细胞炎性因子分泌的影响 如图10所示,与对照组比较,模型组细胞上清液中TNF-α和IL-6水平显著增加(P<0.01);与模型组比较,各给药组上清液中TNF-α和IL-6水平显著降低(P<0.01)。

图10 含药血清对RAW264.7细胞上清液中TNF-α和IL-6水平的影响 (±s , n=6)Fig.10 Effect of drug-containing serum on levels of TNF-α and IL-6 in supernatant of RAW264.7 cells (±s , n=6)
2.2.7 含药血清对RAW264.7细胞JAK2、p-JAK2、STAT3和p-STAT3蛋白表达的影响 如图11所示,与对照组比较,模型组细胞JAK2、p-JAK2、STAT3和p-STAT3蛋白表达水平均明显增高(P<0.01);与模型组比较,各给药组细胞JAK2、p-JAK2、STAT3和p-STAT3蛋白表达水平均明显降低(P<0.01)。

图11 含药血清对RAW264.7细胞JAK2、p-JAK2、STAT3和p-STAT3蛋白表达的影响 (±s , n=5)Fig.11 Effect of drug-containing serum on expressions of JAK2, p-JAK2, STAT3 and p-STAT3 in RAW264.7 cells(±s , n=5)
2.2.8 含药血清对RAW264.7细胞JAK2和STAT3mRNA表达的影响 如图12所示,与对照组相比,模型组细胞JAK2和STAT3mRNA表达水平均显著升高(P<0.01);与模型组相比,各给药组细胞JAK2和STAT3mRNA表达水平均显著降低(P<0.01)。

图12 含药血清对RAW264.7细胞JAK2和STAT3 mRNA表达的影响 (±s , n=5)Fig.12 Effect of drug-containing serum on mRNA expressions of JAK2 and STAT3 in RAW264.7 cells(±s , n=5)
3 讨论
AS是导致脑梗死、心肌梗死、冠心病等多种心脑血管疾病的主要病理基础,脑动脉、主动脉、冠状动脉及外周动脉的血管病变是AS的始动因素,主要特征是泡沫细胞的形成、脂质蓄积和局部血管炎性反应的发生。补阳还五汤及苷类组分(苦杏仁苷、芍药苷、黄芪甲苷)具有抗脑缺血、抗血管内膜增生、抗血管平滑肌增殖等作用[8,10,13-15];Liu等[3]基于网络药理学研究发现,补阳还五汤能够通过多组分激活NF-κB通路,抑制IL-6和TNF-α表达,调节脂质代谢,改善血管内膜,从而发挥抗AS作用。因此,补阳还五汤或其有效组分与阿托伐他汀联用可能具有较好的抗AS作用,其作用机制可能与抗炎、调脂稳斑的双重作用有关。本课题组前期研究发现,补阳还五汤苷类有效组分能够抑制增生内膜中细胞外基质(extracellular matrix,ECM)的合成,上调增生血管内膜I型胶原(collagen-I,Col-I)及基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)表达,促进ECM降解,发挥抗AS血管内膜增生的作用。基于此,本研究采用网络药理学方法,研究补阳还五汤主要苷类有效组分与阿托伐他汀治疗AS的潜在作用机制,结果显示,补阳还五汤苷类主要组分与阿托伐他汀能够调控AKT1、VEGFA、STAT3、CASP3等65个靶点,介导JAK/STAT、缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)、TNF等78条信号通路,在ECM或膜区,参与炎性反应的调节、白细胞迁移、肌细胞增殖、脂质定位等17个生物过程,从而治疗AS。本研究从生物信息学角度初步证实了补阳还五汤苷类有效组分与阿托伐他汀能够通过多靶点、多通路协同抗AS,其作用机制可能与调控JAK/STAT通路、调节炎性反应及脂质代谢异常有关,为进一步实验验证提供了理论基础和研究方向。
本研究进一步采用ox-LDL诱导RAW264.7细胞泡沫化,从细胞活力、细胞泡沫化等方面,选取10%血清浓度为无细胞毒性的血清浓度,以75 μg/mL ox-LDL刺激RAW264.7细胞24 h为最佳模型,与Cao等[16]用ox-LDL诱导RAW264.7细胞构建的AS模型一致。结果显示,各给药组均能够减少细胞内脂质沉积,降低泡沫化细胞数量,抑制RAW264.7细胞吞噬脂质,显著减少细胞内TC、FC、CE含量,补阳还五汤苷类组分中剂量组与阿托伐他汀组疗效相当,提示在调节脂质方面,中剂量补阳还五汤苷类组分与阿托伐他汀联合用药,可以协同发挥调脂稳斑的作用。各给药组均能够抑制TNF-α和IL-6分泌,补阳还五汤抗炎作用最佳,其次为中剂量补阳还五汤苷类组分,提示在抗炎方面,苷类组分可能为补阳还五汤的主要药效物质,可以作为补阳还五汤原方的精准有效组分替代药物发挥抗炎作用。各给药组均能够抑制JAK2/STAT3通路相关蛋白及mRNA表达水平,提示补阳还五汤及其苷类有效组分能够通过抑制JAK2/STAT3信号通路,在AS进程中发挥抗炎和调节脂质的作用。
综上所述,取10%血清浓度为无细胞毒性的血清浓度,以75 μg/mL ox-LDL刺激RAW264.7细胞24 h能较好地模拟AS疾病模型;补阳还五汤苷类有效组分与阿托伐他汀能够通过多靶点、多通路协同抗AS,其作用机制可能与抑制JAK2/STAT3信号通路,降低细胞内脂质沉积及TC、FC、CE含量,抑制炎性因子TNF-α、IL-6的分泌有关;适宜剂量的苷类组分调节脂质代谢方面与阿托伐他汀相当,且抗炎作用优于阿托伐他汀,提示苷类组分有望成为抗AS的有效药物。
利益冲突所有作者均声明不存在利益冲突

