大蒜素对不同浓度LPS作用下人牙周膜成纤维细胞炎症因子表达的影响
谢静 林湘林 林芝 丁熙
慢性牙周炎(CP)是菌斑微生物引起的牙周支持组织进行性破坏的炎症性疾病,脂多糖(LPS)在发病过程中起重要作用[1],其通过肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)等促炎因子和在细胞外基质降解过程中起关键作用的基质金属蛋白酶(MMPs)[2]启动联级反应,进而引起牙周组织的损伤及基质纤维的降解。大蒜素对多种口腔疾病具有良好疗效[3],其在牙周基质组织的形成过程中可起重要作用[4]。本研究采用不同浓度LPS作用于hPDLCs,加入6 μg/ml大蒜素,观察大蒜素对不同程度牙周炎的抗炎及抗基质降解的作用,为临床上使用大蒜素治疗牙周炎提供实验基础。
1 材料与方法
1.1 试剂 大蒜素(3 mg/ml)购自山东鲁抗辰欣药业有限公司,LPS购自Sigma公司,DMEM培养基、胎牛血清、胰蛋白酶均购自Gibco公司,抗波形丝蛋白单克隆抗体、角蛋白单克隆抗体、Human total MMP-1 ELISA试剂盒、TNF-α ELISA试剂盒、IL-1β ELISA试剂盒均购自武汉博士德生物工程有限公司。
1.2 组织来源 收集于本院口腔科就诊患者因正畸而拔除的无龋坏牙、无牙周疾病的前磨牙和阻生牙,刮取根中1/3牙周膜用于细胞培养。供牙者年龄12~20岁,无结缔组织疾病,未全身应用皮质类固醇等药物,均知情同意。
1.3 研究方法 (1)hPDLCs体外培养:采用组织块贴壁法,倒置显微镜下观察细胞形态,免疫组化法进行细胞鉴定,酶消化法常规传代,取第5代细胞用于实验。(2)分组:四甲基偶氮唑盐微量酶反应比色法(MTT法)测定细胞活性,10 cm培养皿中培养24 h。根据LPS浓度及大蒜素浓度分组,每组设6复孔,具体如下:①空白对照组:含2%胎牛血清的DMEM培养液;②调零对照组:6 μg/ml大蒜素+含2%胎牛血清的DMEM培养液;③0.1 μg/ml LPS组:0.1 μg/ml LPS+含2%胎牛血清的DMEM培养液;④0.1 μg/ml LPS+6 μg/ml大蒜素组:0.1 μg/ml LPS+6 μg/ml大蒜素+含2%胎牛血清的DMEM培养液;⑤1 μg/ml LPS组:1 μg/ml LPS+含2%胎牛血清的DMEM培养液;⑥1 μg/ml LPS+6 μg/ml大蒜素组:1 μg/ml LPS+6 μg/ml大蒜素+含2%胎牛血清的DMEM培养液;⑦10 μg/ml LPS组:10 μg/ml LPS+含2%胎牛血清的DMEM培养液;⑧10 μg/ml LPS+6 μg/ml大蒜素组:10 μg/ml LPS+6 μg/ml大蒜素+含2%胎牛血清的DMEM培养液。(3)大蒜素对不同浓度LPS诱导的hPDLCs分泌TNF-α、IL-1β及MMP-1的含量测定:取生长状态良好的第5代细胞以2×105/孔接种于96孔板,在温度37 ℃、5% CO2及饱和湿度条件下培养24 h,弃原培养液,使用无菌磷酸缓冲盐溶液(PBS)清洗3次,按上述分组方案加药,37℃、5% CO2及饱和湿度条件下培养48 h,之后收集培养液,采用ELISA试剂盒检测各组TNF-α、IL-1β及MMP-1的含量,于550 nm处读取酶标仪上的吸光度值(OD值),并通过标准曲线获得待测样本各指标的浓度值。各LPS浓度下,各指标的抑制率=(1-观察组值/对照组值)×100%。
1.4 统计学方法 采用SPSS 19.0统计软件。计量资料以()表示,进行双尾检验。采用析因设计的方差分析比较各组数据的统计学差异,单独效应分析采用One-way ANOVA,组间两两比较采用Bonferroni法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组TNF-α表达情况比较 见表1。
表1 各组TNF-α表达情况比较[pg/ml,()]

表1 各组TNF-α表达情况比较[pg/ml,()]
LPS(μg/ml) 0 0.1 1 10大蒜素 0 15.59±1.1938.65±4.5186.12±9.37106.13±8.0412.333 <0.001 6 17.34±1.0833.46±4.0765.02±5.85 75.74±5.28 14.330 <0.001抑制率(%) -11.22 13.43 24.50 28.63 F值 7.119 4.373 21.884 59.930 P值 0.024 0.063 0.001 <0.001组别F值 P值作用浓度
2.2 各组IL-1β的表达情况比较 见表2。
表2 各组IL-1β的表达情况比较[pg/ml,()]
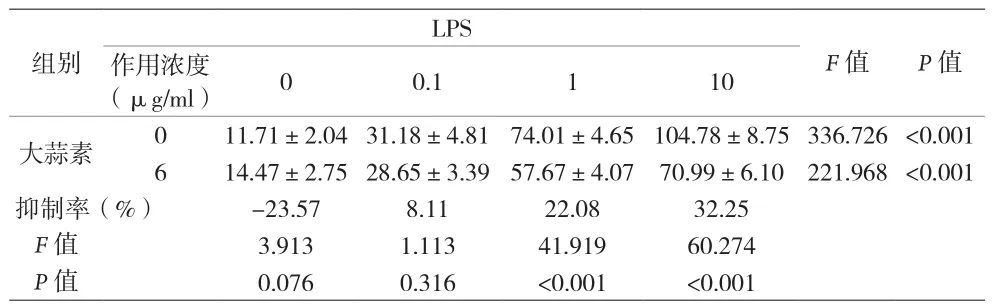
表2 各组IL-1β的表达情况比较[pg/ml,()]
LPS(μg/ml) 0 0.1 1 10大蒜素 0 11.71±2.0431.18±4.81 74.01±4.65104.78±8.75336.726 <0.001 6 14.47±2.7528.65±3.39 57.67±4.07 70.99±6.10 221.968 <0.001抑制率(%) -23.57 8.11 22.08 32.25 F值 3.913 1.113 41.919 60.274 P值 0.076 0.316 <0.001 <0.001组别F值 P值作用浓度
2.3 各组MMP-1表达情况比较 见表3。
表3 各组MMP-1表达情况比较[ng/ml,()]
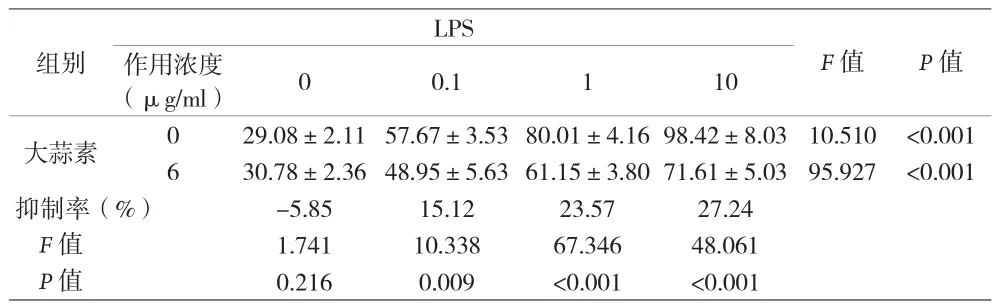
表3 各组MMP-1表达情况比较[ng/ml,()]
LPS(μg/ml) 0 0.1 1 10大蒜素 0 29.08±2.1157.67±3.5380.01±4.1698.42±8.03 10.510 <0.001 6 30.78±2.3648.95±5.6361.15±3.8071.61±5.03 95.927 <0.001抑制率(%) -5.85 15.12 23.57 27.24 F值 1.741 10.338 67.346 48.061 P值 0.216 0.009 <0.001 <0.001组别F值 P值作用浓度
3 讨论
研究发现,在患有严重牙周附着丧失及牙槽骨吸收的牙周炎患者的牙周组织中,TNF-α、IL-1β的表达明显升高,表明其在炎症中发挥关键作用[5]。TNF-α作为主要的促炎因子之一,可刺激机体产生多种炎症因子,并诱导破骨细胞成熟、促进骨组织吸收破坏,从而导致疾病进展[6]。在TNF-α拮抗剂的作用下,龈沟液中TNF-α的表达明显降低,牙龈炎症状况可得到改善[7]。此外,IL-1β也是牙周炎中的关键细胞因子,可趋化炎症细胞及相关因子在炎症区域聚集浸润,促进破骨效应,诱导骨质流失,促进牙周炎进展。有研究显示,牙周炎患者深部牙周袋中IL-1β浓度明显升高,而在有效治疗后其浓度明显下降[8]。MMPs是一种可降解细胞外基质的蛋白水解酶,可通过直接降解胶原蛋白或激活纤溶蛋白酶级联反应破坏结缔组织,是牙周炎进展的重要因子。MMP-1是成纤维细胞型胶原酶,可特异性降解Ⅰ、Ⅱ、Ⅲ型胶原,参与有机基质和胶原纤维的降解。
笔者前期有研究大蒜素对LPS作用下hPDLCs胶原代谢的影响,发现6 μg/ml浓度的大蒜素对细胞的刺激较小,降低LPS对hPDLCsⅠ型胶原合成及分泌的抑制作用的效果也较明显[4],故本研究观察组的大蒜素浓度设定为6 μg/ml。本研究结果显示,在未添加大蒜素的情况下,随着LPS浓度的逐渐增高,TNF-α、IL-1β及MMP-1的表达也呈增高趋势,提示不同浓度LPS对hPDLCs具有不同程度的炎症刺激作用,一定范围内较高浓度的LPS刺激产生炎症因子的能力较强。同时LPS作用于hPDLCs后也可促进MMP-1的分泌,分泌程度也呈LPS浓度依赖性。在添加6 μg/ml大蒜素后,虽然LPS浓度越高,TNF-α、IL-1β及MMP-1的增高趋势未变,但总体上与未添加大蒜素时相比均有所下降。在0.1 μg/ml LPS作用下,6 μg/ml大蒜素组与未添加大蒜素组比较,TNF-α、IL-1β及MMP-1均有所下降,但TNF-α、IL-1β差异无统计学意义,提示6 μg/ml大蒜素对低浓度LPS刺激下的hPDLCs抑制炎症因子作用不明显。在1 μg/ml、10 μg/ml LPS作用下,6 μg/ml大蒜素组与未添加大蒜素组比较,TNF-α、IL-1β及MMP-1均有较大幅度的下降,三者差异均有统计学意义,并且10 μg/ml LPS作用下6 μg/ml大蒜素对三者的抑制率高于1 μg/ml LPS作用下6 μg/ml大蒜素对三者的抑制率。以上结果提示,6 μg/ml大蒜素对较高浓度LPS刺激下的hPDLCs抑制炎症因子及MMP-1作用较明显,且在一定范围内LPS浓度越高,其抑制的效率也越高;与轻度牙周炎患者相比,大蒜素针对中、重度牙周炎患者可能具有更好的抗炎及抗基质降解作用。值得注意的是,在无LPS刺激的情况下,6 μg/ml大蒜素组与未添加大蒜素组比较,TNF-α、IL-1β及MMP-1均有所增高,虽然仅TNF-α差异有统计学意义,但此结果是否提示大蒜素本身的刺激对hPDLCs具有促炎及促基质降解作用,尚需进一步的研究探讨。
综上,不同浓度LPS作用于hPDLCs后可促进TNF-α、IL-1β及MMP-1的分泌,分泌程度呈LPS浓度依赖性。6 μg/ml大蒜素对不同浓度LPS刺激下的hPDLCs炎症因子及MMP-1具有抑制作用,其抑制效率在一定范围内与LPS浓度成正比,提示大蒜素对中、重度牙周炎患者可能具有更好的抗炎及抗基质降解作用。

