柴胡加龙骨牡蛎汤对H2O2损伤PC12细胞保护作用的研究
许 训,刘 薇,刘 昆,袁康瑞,叶晓梅,刘小柳,吴都督,陈 稚* (广东医科大学.动物中心;.药学院,广东东莞 5808;.广东省深圳市罗湖区人民医院医学检验科,广东深圳 58000)
氧化应激和抗氧化防御的失衡与阿尔兹海默症(AD)等多种疾病密切相关[1-3]。近年来,中药用于AD的治疗受到国内外学者的重视[4-9]。柴胡加龙骨牡蛎汤(CLM)源于仲师之《伤寒论》,其方药由小柴胡汤去甘草加桂枝、茯苓、龙骨、牡蛎、铅丹、大黄而成,具有化饮理肝、阴阳调和之功效[10]。现代药理学研究表明,CLM 具有抗氧化、衰老、抗炎等作用[11],在治疗抑郁、癫痫、痴呆等疾病方面也有较好的疗效[12-13],如肖慧琼等[14]发现CLM 能降低颞叶癫痫患者血清中的MDA 含量,增加SOD 活性,抑制脂质过氧化反应。因此,本研究探讨CLM 对氧化应激导致的神经元损伤的保护作用及其机制。
1 材料和方法
1.1 材料与制作
柴胡、龙骨、生姜、人参、去皮桂枝、茯苓、洗半夏、黄芩、铅丹、大黄、牡蛎、擘大枣(广东时珍制药有限公司),按原方比例即柴胡62 g,龙骨、生姜、人参、去皮桂枝、茯苓各23 g,洗半夏20 g,黄芩16 g,铅丹23 g,大黄31 g,熬牡蛎23 g,擘大枣6 枚称取定量的药材,再量取5 倍量的75%乙醇,将药材浸泡120 min之后,加热回流,收集滤液;再重复一次上述过程,收集滤液。将两次的滤液收集于同一烧杯中,过滤、浓缩,制成浓度为10 g/mL CLM母液。小鼠肾上腺嗜铬细胞瘤PC12 细胞株(上海细胞库);二甲基亚砜(索莱宝);DMEM 高糖培养基,0.25%胰蛋白酶(含EDTA),胎牛血清(GIBCO,美国);H2O2溶液(AR)(Sigma);细胞裂解液(RIPA)(碧云天);超氧化物歧化酶(SOD)活性测定试剂盒(南京建成生物工程公司),乳酸脱氢酶(LDH)测定试剂盒;BCA法蛋白定量试剂盒(赛默菲);一抗(兔抗鼠IgG) (Santa Cruz 公司);二抗(荧光标记的山羊抗兔IgG)(Santa Cruz公司)。
1.2 方法
1.2.1 PC12 细胞的培养 先在超净台配制含有20%胎牛血清、100 kU/L 青霉素和100 g/mL 链霉素的DMEM(高糖)培养基,用胰蛋白酶消化传代在细胞培养箱中培养一定时间后的PC12 细胞,选取对数生长期的细胞进行实验。
1.2.2 CLM对PC12细胞增殖的影响 采用CCK8法检测CLM 对PC12 细胞生存率的影响,用胰蛋白酶消化处于对数生长期的PC12细胞,将其进行离心,用细胞计数板计数,按5 000 个细胞/孔加入96 孔培养板,每孔100 μL,在37 ℃、5%CO2的条件下培养24 h。将CLM 溶于DMEM 中,并通过梯度稀释的方法,配制成0.1、1.0、5.0 g/mL 的低、中、高剂量组,每组浓度分别设置3 个平行孔,放置上述条件的培养箱中培养。空白对照组用DMEM做相同处理。培养24、48及72 h后,每孔加入10 μL CCK8 试剂,摇匀,在37 ℃条件下避光孵育2 h,采用酶标仪在450 nm 处测OD 值。取3孔的均数,细胞活力(%)=(试验孔均值/对照孔均值)×100%。
1.2.3 CCK8 检 测CLM 对PC12 细胞的保护将PC12 细胞以5 000 个/孔的密度将PC12 细胞种于96孔板中,每孔100 μL。置于孵箱中培养24 h。实验分为5 组:空白对照组、H2O2损伤模型组(200 μmol/L)、CLM 低剂量组:CLM(0.1 g/mL)+H2O2(200 μmol/L)、CLM 中剂量组:CLM(1.0 g/mL)+H2O2(200 μmol/L)及CLM高剂量组:CLM(5.0 g/mL)+H2O2(200 μmol/L)。反应24 h后,加入CCK8试剂10 μL,37 ℃反应1 h后,采用酶标仪在450 nm下测OD值。细胞活力(%)=(试验孔均值/对照孔均值)×100%。
1.2.4 PC12 细胞培养液中LDH、MDA 与SOD 含量测定 PC12 细胞在H2O2的损伤过程中,细胞内的LDH 释放到胞外,由于在活细胞中无法释放,因此通过检测细胞外LDH 的量,因此可以间接反映细胞的损伤程度。收集1.2.3 处理后的培养液,严格按照LDH、MDA 与SOD 测定试剂盒说明书进行处理,测定细胞培养液中LDH、MDA 与SOD 各酶的OD 值并计算相应活性。
1.2.5 CLM 对PC12 细胞的核因子E2 相关因子2(Nrf-2)表达水平的影响 将PC12细胞接种于6孔板,接种密度为3×106个/mL,共设置5组,依次为对照组、损伤模型组、CLM 低、中、高剂量组。孵箱孵育24 h后弃置培养基,PBS 洗2 次后用吸水纸吸干,放置于冰上。每孔加80 μL 蛋白裂解液,并置于冰上裂解,时间为30 min。将细胞碎片与裂解液用细胞刮刮至一侧,并转至1.5 mL EP 管(1.2×104r/min、4 ℃)离心10 min。取其中2.5 μL 上清液用BCA 法测定其蛋白浓度,剩下液体转移至1.5 mL EP 管中-80 ℃下保存备用。取50 μg 蛋白,使用10%SDS 聚丙烯凝胶电泳进行分离后,转至PVDF 膜上,并用脱脂奶粉进行封闭,加入相应的一抗,4 ℃过夜。PBST 洗膜,加入荧光二抗,室温反应2 h,用红外荧光成像系统显色。用Image J图像软件分析蛋白条带的灰度值。
1.3 统计学处理
用SPSS 20.0 软件包分析数据,各项实验每组均重复8次,计量资料以表示,多组比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 CLM对PC12细胞增殖的影响
与对照组比较,CLM 低、中、高剂量组对PC12 细胞的增殖率均明显增加(P<0.01),且以CLM高剂量组最为显著(P<0.01),CLM 低、中、高剂量组间两两比较差异均有统计学意义(P<0.01),见表1。
表1 CLM对PC12细胞增殖的影响 (,n=8)

表1 CLM对PC12细胞增殖的影响 (,n=8)
与对照组比较:aP<0.01;与CLM 低剂量组比较:bP<0.01;与CLM中剂量组比较:cP<0.01
2.2 CLM对PC12细胞存活率的影响
与对照组比较,H2O2损伤组PC12 细胞的存活率明显降低(P<0.01);与H2O2模型损伤组比较,CLM低、中、高剂量组细胞存活率均明显提高(P<0.01),且以CLM高剂量组最为显著(P<0.01),见图1。
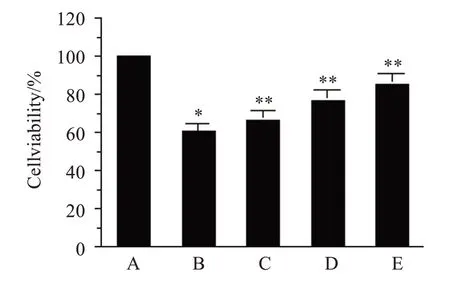
图1 CLM对H2O2诱导损伤后的PC12细胞存活率的影响
2.3 PC12细胞培养液中LDH、MDA和SOD含量测定
与对照组比较,H2O2损伤模型组细胞中的LDH和MDA 的含量增大,SOD 酶活性明显下降(P<0.01)。经CLM 干预后,与H2O2损伤模型组相比,不同浓度的CLM组均能有效降低细胞培养液中的LDH含量和MDA 含量(P<0.01),以CLM 高剂量组更为显著(P<0.01),见表2。
表2 CLM 对H2O2 诱导PC12 损伤后细胞培养液中LDH、MDA和SOD含量的影响 (,n=8)
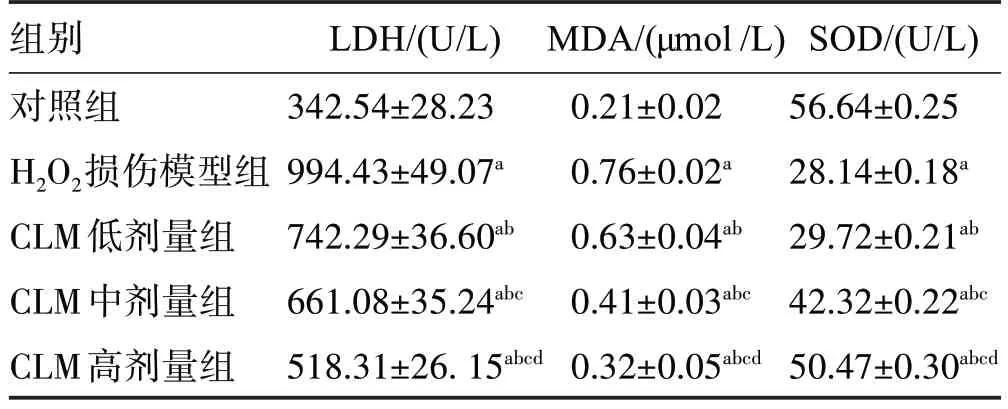
表2 CLM 对H2O2 诱导PC12 损伤后细胞培养液中LDH、MDA和SOD含量的影响 (,n=8)
与对照组比较:aP<0.01;与H2O2损伤模型组比较:bP<0.01;与CLM低剂量组比较:cP<0.01;与CLM中剂量组比较:dP<0.01
2.4 CLM对PC12细胞形态的影响
由图2 所示,与对照组相比,H2O2损伤模型组的PC12 细胞胞质不饱满、边缘不清晰、透光性差且生长缓慢,而CLM 给药组随着浓度增加,细胞形态逐渐恢复正常,且浓度越高,细胞状态越好。
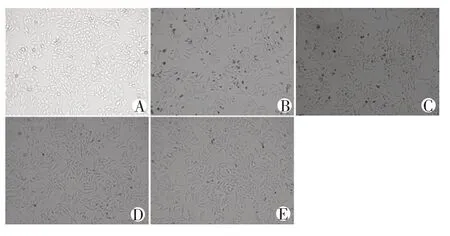
图2 CLM对H2O2损伤的PC12细胞形态的影响
2.5 CLM对PC12细胞的Nrf-2核蛋白表达水平的影响
与对照组相比,H2O2损伤模型组中的Nrf-2 蛋白水平明显下降,用不同剂量CLM 处理后,Nrf-2 蛋白水平有所提高,且以CLM 高剂量组更明显(P<0.01)。见表3。
表3 CLM对PC12细胞的Nrf-2核转运的灰度值的影响 (,n=8)

表3 CLM对PC12细胞的Nrf-2核转运的灰度值的影响 (,n=8)
与对照组比较:aP<0.01;与H2O2损伤模型组比较:bP<0.01;与CLM低剂量组比较:cP<0.01
3 讨论
根据现代临床研究进展,CLM 对神经系统、心血管系统、消化系统、妇科病等均有较好的治疗作用。CLM 治疗各种类型的抑郁症如肿瘤后抑郁、帕金森伴发抑郁等疗效显著,对室性早搏和心绞痛等心血管疾病也有较好的治疗效果[10]。CLM 的抗氧化作用也是如今研究的热点。本研究在观察CLM 对PC12 细胞增殖的影响中,结果显示,与对照组相比,CLM 低、中、高剂量组对PC12 细胞的增殖率均明显增加(P<0.01),且以CLM 高剂量组最为显著(P<0.01),表明不同浓度的CLM 对PC12 细胞的增殖均有促进作用,且随着浓度的增加,CLM 对PC12 细胞增殖的促进作用增强。在观察细胞存活率中,经CLM 干预后,与H2O2损伤模型组相比,不同浓度的CLM 组均能有效降低细胞培养液中的LDH 含量和MDA 含量(P<0.01),以CLM 高剂量组更为显著(P<0.01),也表明CLM 能有效抑制H2O2损伤导致的细胞存活率下降,提高PC12细胞的存活率,对由于过氧化损伤的神经元具有保护作用。
SOD 作为系统中至关重要的抗氧化酶,对于氧化平衡系统有着举足轻重的作用。因此,SOD 可以作为细胞内抗氧化能力的指标[16]。MDA 能反映脂质过氧化的程度及清除氧自由基的能力[17]。经H2O2损伤的PC12 细胞,出现胞膜脂质过氧化反应、胞内MDA 累积、自由基水平升高,作为自由基清除剂的SOD消耗增加。本研究结果显示不同浓度的CLM 处理PC12细胞后,MDA含量下降、SOD活性增加,表明CLM 可以在一定程度上对抗H2O2导致的过氧化损伤。
Nrf-2 是细胞中抗氧化转录因子,在机体内起到重要的抗氧化作用。它可对抗神经炎症,抑制氧化应激反应发生,从而起到缓解神经退行性疾病的作用。有研究表明,转录因子Nrf-2在细胞质中受到Kelch样ECH相关蛋白1(Keap1)的严格调控,在无应激的情况下,Keap1 有效地介导Nrf-2 的多泛素化,导致其被泛素-蛋白酶体降解系统(UPS)降解。Nrf-2 是细胞抗炎和抗氧化防御基因的主要转录调节因子,Nrf-2 信号的选择性激活,可有效抑制神经胶质细胞中炎性因子的释放[18]。在H2O2诱导的PC12 细胞氧化应激模型中,发现CLM 各浓度组核内Nrf-2 蛋白表达明显升高,表明CLM 能有效促进Nrf-2 的核转位,CLM 可能通过调节Nrf-2 蛋白的表达,产生抗氧化应激损伤的作用。
综上所述,CLM 对由H2O2诱导损伤的PC12细胞具有保护作用,其机制可能与CLM 降低LDH、MDA含量,增强SOD 酶活性以及调节核内Nrf-2 蛋白水平的表达有关。本实验的研究可为CLM 作为抗氧化剂抑制PC12 细胞的过氧化损伤,进行神经退行性疾病的治疗提供实验基础。

