VEGF及HIF-1α在小儿鼻咽部横纹肌肉瘤中的表达及临床意义
李 颖 姜 岚 张 可 任红波 僧东杰 陶 菁
小儿横纹肌肉瘤是多见的儿童恶性软组织肉瘤,可发生于头颅、四肢、躯干、泌尿生殖系等多部位,以肿物为主,因发病部位不同产生的压迫症状和邻近器官的侵犯症状而有所不同[1-2]。临床数据显示头颈部为多发部位,占到45%左右[3]。该疾病瘤体生长迅速,早期发现诊断困难、就诊时多处于临床Ⅱ期以上、瘤体复发率高等[4]。据报道近年来小儿横纹肌肉瘤发病率呈逐年上升趋势,尽管目前化疗、放疗与手术措施不断完善,使得患儿的生存率有了显著提高,但其预后受到病理类型和分期等多种因素影响,仍不甚满意,是临床研究的难点和重点问题[4-6]。本研究注意收集院内相关病例资料,观察血管内皮生长因子(vascular endothelial growth factor,VEGF)及缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)在小儿鼻咽部横纹肌肉瘤中的表达及临床意义,以期为诊治工作提供参考依据,总结报告如下。
1 材料与方法
1.1 一般资料
选取我院2017年4月至2018年3月诊治并且病理学确诊的小儿鼻咽部横纹肌肉瘤31例作为研究对象,纳入标准:①年龄1~12岁;②临床资料及病理学结果完整;③家长知情同意研究内容并配合完成随访工作。排除标准:①呼吸系统严重疾病患儿;②其他恶性肿瘤患儿;③其他疾病累及鼻咽部的患儿。本研究内容符合医学伦理学要求。患儿年龄1岁9个月~11岁5个月,平均(5.9±1.6)岁;病理类型:胚胎型25例,腺泡型6例;中低分化20 例;高分化11例;I、Ⅱ期 17例,Ⅲ、Ⅳ期14例;无淋巴结转移16例,淋巴结转移 15 例。
1.2 方法
所有患儿的组织标本均采用免疫组化法检测VEGF及HIF-1α表达情况,取材后石蜡包埋进行4 μm 连续切片,置于载玻片后75 ℃烤片,切片脱蜡,经3%过氧化物内源性过氧化酶消除、免疫组化抗原修复缓冲液修复,室温下加入山羊血清封闭,加入一抗4 ℃过夜、磷酸缓冲液冲洗、加入二抗温育30 min,冲洗后二氨基联苯胺显色液显色,苏木精对比染色,封片,采用双盲法让两位5年以上工作经验的病理科医师进行显微镜下观察,Hela细胞阳性对照,磷酸盐缓冲液替代一抗阴性对照。
1.3 判断标准
每张切片均在400倍镜显微精视野下随机选取5个视野,染色强度方面无着色0分、弱着色(淡黄色)1分、中等着色(棕黄色)2分、强着色(黄褐色)3分,每个视野计数100个细胞,阳性细胞百分率≤5% 0分、6%~25% 1分、26%~50% 2分、>50% 3分,染色强度和细胞计数分数相加后进行免疫组化结果判定,0分(-)、1~2分为(+),3~4分为(++),5~6分为(+++)。
1.4 统计学方法
应用SPSS 20.0统计分析软件进行数据处理,计数资料以[n(%)]表示、进行χ2检验,VEGF及HIF-1α的表达相关性采用Spearman等级相关分析,以P<0.05作为有统计学意义。
2 结果
2.1 VEGF及HIF-1α表达阳性率分析
31例小儿鼻咽部横纹肌肉瘤中,VEGF表达阳性率为71.0%(22/31)、HIF-1α表达阳性率为67.7%(21/31),VEGF及HIF-1α表达阳性具有较高的一致性,见表1。

表1 本组患儿VEGF及HIF-1α表达阳性率比较(例,%)
2.2 VEGF及HIF-1α在不同临床病理特征的患儿中表达情况分析
VEGF表达阳性与表达阴性的患儿病理类型、分化程度差异无统计学意义(P>0.05),临床分期、淋巴结转移差异有统计学意义(P<0.05),具体数据见表2;HIF-1α表达阳性与表达阴性的患儿病理类型、分化程度差异无统计学意义(P>0.05),临床分期、淋巴结转移差异有统计学意义(P<0.05),具体数据见表3。
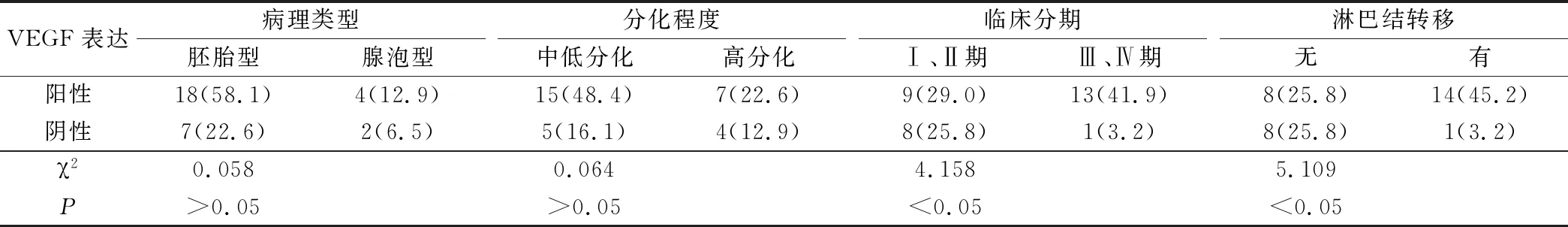
表2 VEGF在不同临床病理特征的患儿中表达情况分析(例,%)
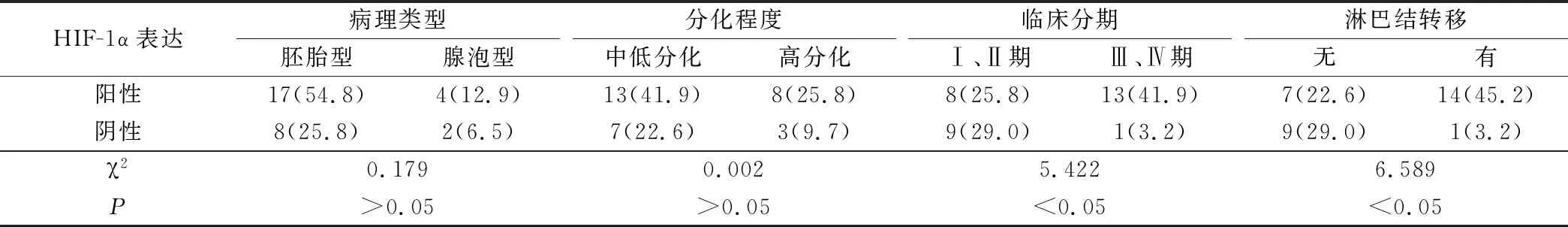
表3 HIF-1α在不同临床病理特征的患儿中表达情况分析(例,%)
2.3 相关性分析
31例小儿鼻咽部横纹肌肉瘤标本中,VEGF及HIF-1α表达结果对比具体数据见表4,VEGF及HIF-1α的表达呈正相关(γ=0.693,P<0.05)。

表4 本组患儿组织标本的VEGF及HIF-1α表达对比/例
2.4 随访生存率分析
VEGF及HIF-1α表达阳性的患儿1、2年随访生存率均略低于表达阴性组,但差异无统计学意义(P>0.05),具体数据见表5。

表5 VEGF及HIF-1α表达阳性的患儿生存率分析(例,%)
3 讨论
小儿横纹肌肉瘤起源于原始间叶组织,鼻咽部肿瘤可引起声音改变、气道梗阻、窒息和鼻出血,鼻旁窦肿瘤有疼痛、鼻腔分泌物增多、鼻出血症状,如有扩散转移可出现发热、厌食、体重下降、疼痛和衰弱等情况,因症状缺乏特异性,易造成误诊误治,需借助临床病理学、免疫组织化学等方法诊断[7-8]。
横纹肌肉瘤根据组织学和遗传学特点可分为胚胎型、腺泡型、成人多形型,小儿横纹肌肉瘤以胚胎型居多,本研究中小儿鼻咽部横纹肌肉瘤病理确诊胚胎型25例,腺泡型6例。中低分化20 例,高分化11例,有研究表明根据分化程度进行分层和综合治疗,可以不断优化化疗方案,进一步改善预后,提高疗效[9]。临床分期反映肿瘤局部浸润程度和转移情况,有利于治疗方案的选择和预后的判断,Ⅰ、Ⅱ期肿瘤局限,肉眼观完全切除,Ⅲ期肿瘤未完全切除或仅活检取样,肉眼有残留肿瘤,Ⅳ期诊断时已有远处转移,研究中I、Ⅱ期 17例,Ⅲ、Ⅳ期14例。无淋巴结转移患者 16例,淋巴结转移 15 例,横纹肌肉瘤因无完整薄膜容易通过血流、淋巴管转移,可以发生局部、区域及远处转移,有研究表明该疾病总体生存率偏低与淋巴结转移存在关联[10-11]。
研究结果显示本组小儿鼻咽部横纹肌肉瘤中VEGF、HIF-1α表达阳性率分别为71.0%、67.7%,并且表达阳性与表达阴性的患儿的临床分期、淋巴结转移差异有统计学意义,这与之前童刚领等[12]提出的“小儿鼻咽部横纹肌肉瘤组织中存在HIF-1a蛋白和VEGF蛋白的高表达,且与肿瘤分期有关”相一致。VEGF是1种高度特异性的促血管内皮细胞生长因子,在体内诱导血管新生、促进血管通透性增加、细胞外基质变性、血管内皮细胞迁移、增殖和血管形成等[13-14]。有研究证实HIF-1a是机体应答缺氧应激的关键因子,能够与上下游多种蛋白组成不同的信号通路,介导低氧信号,调控细胞产生一系列对缺氧的代偿反应,其可引起多种基因转录,使肿瘤细胞耐受低氧环境,是肿瘤细胞生长过程中重要的调控因子[15-17]。以上内容提示VEGF、HIF-1α在肿瘤的发展、转移中发挥着重要作用,其表达情况与肿瘤增殖、侵袭和转移、新生血管生成等密切相关,因此VEGF、HIF-1α不同表达情况的小儿鼻咽部横纹肌肉瘤临床分期、淋巴结转移存在显著差异。
研究结果还提示小儿鼻咽部横纹肌肉瘤组织中VEGF及HIF-1α的表达呈正相关,考虑是在低氧环境下HIF-1α这一缺氧诱导因子水平升高,HIF-1α在多种肿瘤VEGF信号通路中起着枢纽作用,能够增加VEGF转录活性,促进肿瘤新生血管形成、浸润、转移[18]。低氧环境下VEGF与内皮细胞膜上VEGF受体结合,自身磷酸化激活有丝分裂原活化蛋白激酶,诱导内皮细胞增生,并且低氧促使VEGF提高血浆酶原活化因子活性,促进细胞外蛋白水解[19]。可见小儿鼻咽部横纹肌肉瘤组织中VEGF及HIF-1α的表达具有高度一致性,在肿瘤细胞发生和转移中共同发挥作用,密切相关。
本组患儿均维持了较好的随访工作, 根据随访数据发现VEGF及HIF-1α表达阳性的患儿1、2年随访生存率均略低于表达阴性组,这与以往的报道结果并不一致,如童刚领[20]曾提示VEGF及HIF-1α表达阳性的患儿3年总生存率和无疾病进展生存率均显著低于阳性组。VEGF及HIF-1α表达与肿瘤增殖、侵袭和转移、新生血管生成等密切相关,说明其表达阳性率一定程度上反映疾病的进展情况,提示疾病严重程度、预测治疗预后,但是本研究数据并未体现出统计学意义,考虑与研究样本少、个体差异或跟踪随访时间仅有2年有关,有待积累病例资料深入研究VEGF及HIF-1α表达对于预后的预测作用。
综上所述可见,小儿鼻咽部横纹肌肉瘤中VEGF及HIF-1α表达阳性率均较高,与临床分期、淋巴结转移密切相关,并且VEGF及HIF-1α两者的表达呈正相关,具有较高的一致性,对小儿鼻咽部横纹肌肉瘤患儿的诊治、预后判断有一定的临床意义。

