MicroRNA-9通过SIRT1/NF-κB通路促进TNF-α诱导心肌细胞损伤的机制研究
张朝华,刘旭帮,朱银川,汤建民
国家心血管病中心发布的数据显示,我国心脑血管病患病人数已达到2.9亿,心血管疾病引起的死亡占居民疾病死亡构成40%以上,是引起居民疾病死亡的首位疾病[1]。炎症是引起心血管疾病患者心肌损伤的主要诱因之一,肿瘤坏死因子α(TNF-α)是体内重要的炎症细胞因子,是心血管疾病引起心肌损伤的关键炎症因子,在急性心肌梗死、冠状动脉(冠脉)硬化及心力衰竭(心衰)等心血管疾病中起重要作用,诱导心肌细胞损伤和破坏心肌组织[2,3]。microRNA-9(miR-9)是一个新发现的微小非编码RNA,被证实可参与神经干细胞分化[4],且被证实参与心脑血管疾病的发生发展[5]。本研究以人心肌细胞H9c2细胞作为研究对象,敲低H9c2细胞内miR-9表达以观察miR-9对TNF-α诱导心肌细胞损伤的影响,探讨其分子机制。
1 材料与方法
1.1 实验试剂与仪器人心肌细胞(H9c2)购买自中国科学院典型培养物保藏中心;RNAiso plus和PrimeScript RT reagent Kit with gDNA Eraser购买自日本TARAKA公司;胎牛血清、DMEM高糖培养基、Lipofectamine™ 2000转染试剂均购买自美国赛默飞世尔科技公司;CCK8试剂盒和荧光素酶报告基因检测试剂盒购买自中国碧云天生物技术有限公司;GoTaq® qPCR Master Mix购买自中国Promega公司;SIRT1抗体、p65抗体及p-p65抗体均购买自Cell Signaling Technology公司;酶标仪购买自BIORAD公司。
1.2 方法
1.2.1 细胞活性检测在96孔培养板每孔中接种100 μl浓度为1×105个/ml的心肌细胞,加入不同浓度(0、5、10、15和20 μg/ml)的TNF-α作用24 h,空白对照组(Control组)中心肌细胞不添加TNF-α培养24 h;或加入10 μg/ml的TNF-α刺激不同的时间(0、12、24、48和72 h),空白对照组(Control组)为心肌细胞不添加TNF-α分别培养不同时间(0、12、24、48和72 h);最后,向每孔加入10微升CCK-8溶液,在细胞培养箱中孵育1 h后,使用酶标仪在450 mm波长处读取OD值。TNF-α刺激组细胞活性=[(TNF-α刺激组OD450-空白对照组OD450)/空白对照组OD450]×100%。
1.2.2 miR-9表达水平检测10 μg/mL的TNF-α刺激心肌细胞24 h,通过胰酶消化作用以收集细胞,向心肌细胞中加入适量的RNAiso以提取RNA,用PrimeScript RT reagent Kit with gDNA Eraser将提取的RNA反转录成cDNA。 PCR参数设定:37℃ 60 min;85℃ 5 s。RT-qPCR:根据GoTaq® qPCR Master Mix试剂盒说明书制备20 μl RT-qPCR系统,使用ABI 7500荧光定量PCR仪器进行扩增。PCR参数设定:95℃,30 s;[90℃ 5 s,65℃ 30 s]-40个循环。以U6为内参,用2-△t△t法计算目的基因的相对表达量。PCR引物如下:miR-9-F:5'-ACACTCC AGCTGGGTCTTTGGTTATCTAGCT-3';miR-9-R:5'-TGGTGTCGTGGAGTCG-3';U6-F:5'-CTCGCTTCGGCAGCACA-3', U6-R:5'-AAC GCTTCACGAATTTGCGT-3'。
1.2.3 细胞培养与转染H9c2细胞均培养在添加10%胎牛血清的DMEM高糖培养基中,培养条件是37℃,5%CO2。根据按照Lipofectamine™ 2000转染试剂盒说明书所示的转染步骤将miR-NC(5'-GCUUAACCAUGCGACUAUUA-3')或miR-9-inhibitor (5'-AGAAACCA AUGCGACAUACU-3')分别转入H9c2细胞内。转染6 h后,更换细胞培养基,然后将细胞继续培养到37℃和5%CO2条件下以用于后续实验。
1.2.4 荧光素酶基因报告通过PCR技术扩增miR-9的3'-UTR的SIRT1结合基因序列,将野生型(WT)或突变型(MUT)的SIRT1基因序列克隆到pmirGLO质粒上以获得pmirGLO- SIRT1 WT/MUT,使用Lipofectamine™ 2000转染试剂将重组质粒与miR-NC或miR-9-inhibitor一起转入H9c2细胞中。48 h后,根据双荧光素酶报告基因试剂盒说明所述步骤检测荧光素酶活性。
1.2.5 蛋白表达检测经不同条件处理后的H9c9细胞被收集以用于提取细胞总蛋白。通过10% SDSPAGE分离50 μg总蛋白。将蛋白从SDS-PAGE凝胶转移到PVDF膜上,5%脱脂牛奶室温封闭1 h。用磷酸盐缓冲溶液洗涤膜3遍后,将膜与SIRT1抗体、p65抗体以及p-p65抗体等在4℃孵育过夜。室温下添加二抗孵育2 h。用磷酸盐缓冲液-洗涤3次后,加入ECL溶液(WBKLS0100,北京新晶科生物技术有限公司,中国)进行检测。
1.3 统计学分析方法研究数据由Grahpad Prism 5软件进行统计学分析,计量资料采用均数±标准差(±s)表示,两组间均数的比较采用t检验,多组间均数比较采用方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 TNF-α以剂量和时间依赖性降低心肌细胞活性使用不同浓度的TNF-α刺激心肌细胞(H9c2)24 h,然后通过CCK8试剂盒测定H9c2的细胞活性,结果显示:TNF-α刺激H9c2细胞的浓度越高,H9c2细胞的活性就越低,与不加TNF-α的Control组相比,差异均具有统计学意义(P<0.05),图1A。使用10 μg/mL的TNF-α刺激心肌细胞(H9c2)不同时间,检测H9c2的细胞活性,结果显示:TNF-α刺激H9c2细胞的时间越久,H9c2细胞的活性越低,与不加TNF-α的Control组相比,差异均具有统计学意义(P<0.05),图1B。

图1 TNF-α诱导心肌细胞损伤具有剂量和时间依赖性
2.2 TNF-α以剂量和时间依赖性促进心肌细胞表达miR-9使用不同浓度的TNF-α刺激心肌细胞(H9c2)24 h,收集细胞、提取细胞总RNA以检测miR-9表达,结果显示:TNF-α浓度越高,H9c2细胞中miR-9的表达水平越高,与0 μg/ml TNF-α刺激组相比,差异均具有统计学意义(P<0.05),图2A。使用10 μg/ml的TNF-α分别刺激心肌细胞(H9c2)不同时间,收集细胞、提取细胞总RNA以检测miR-9表达,结果显示:TNF-α刺激H9c2的时间越久,miR-9在H9c2细胞中的表达水平越高,与TNF-α刺激0 h相比,差异均有统计学意义(P<0.05),图2B。
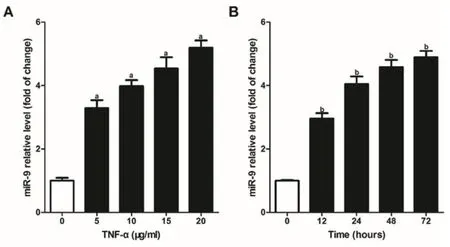
图2 TNF-α促进心肌细胞中miR-9的表达
2.3 敲低miR-9减少TNF-α诱导的心肌细胞损伤通过向H9c2细胞中转入miR-9-inhibitor以敲低miR-9的表达,经检测:与miR-NC组相比,miR-9-inhibitor组的H9c2细胞miR-9的表达水平显著降低,差异具有统计学意义(P<0.001),图3A。用10 μg/ml的TNF-α分别刺激miR-NC组及miR-9-inhibitor组H9c2细胞24 h,经检测:与miR-NC组相比,TNF-α刺激后,miR-9-inhibitor组的H9c2细胞活性更高(P<0.001),图3B。
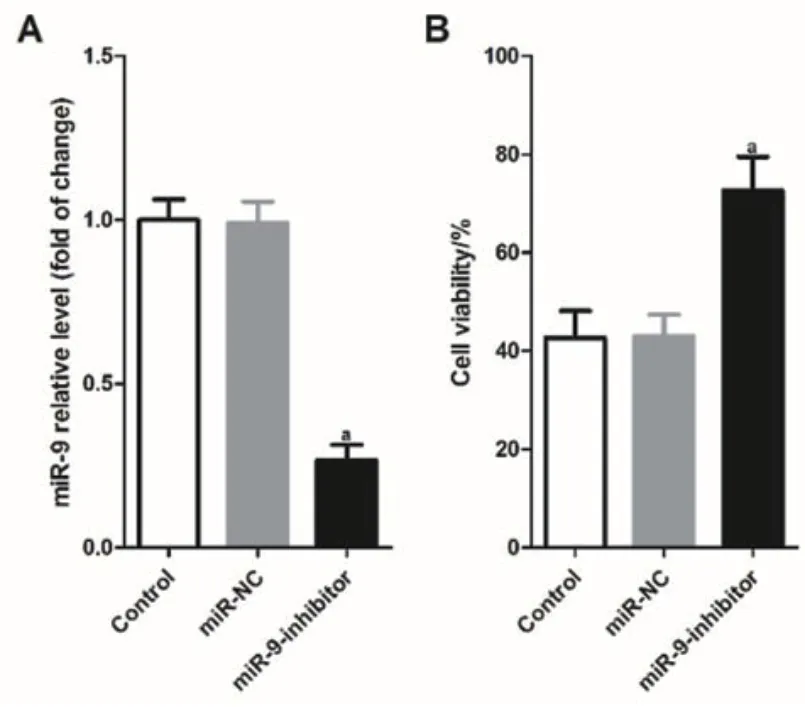
图3 敲低miR-9较少TNF-α诱导的心肌细胞损伤
2.4 miR-9通过抑制SIRT1表达而促进心肌细胞中NF-κB通路激活通过TargetScanHuman(http://www.targetscan.org/vert_72/)数据库查询miR-9潜在的靶基因,miR-9与SIRT1具有相互结合的基因序列,图4A。将pmirGLO-SIRT1 WT/MUT与miR-9-inhibitor共同转入到H9c2细胞中,然后测定荧光素酶活性。结果显示,在转入pmirGLO-SIRT1 MUT的H9c2细胞中,转入miR-9-inhibitor不影响荧光素酶活性;在转入pmirGLO-SIRT1 WT的H9c2细胞中,转入miR-9-inhibitor增强荧光素酶活性,差异具有统计学意义(P<0.05),图4B。此外,使用10 μg/mL的TNF-α分别刺激miR-NC组及miR-9-inhibitor组H9c2细胞24 h,收集细胞检测蛋白表达变化,结果显示:miR-NC组相比,转入miR-9-inhibitor以敲低miR-9的表达水平的H9c2细胞,在TNF-α刺激下SIRT1蛋白表达更高,而p-p65/p65蛋白表达比值更低,差异具有统计学意义(P<0.05),图4C、图4D。

图4 miR-9靶向抑制SIRT1表达而促进p65磷酸化
3 讨论
TNF-α位于人染色体6q21.33位置上,与主要的相容性复合体基因紧密相连,这种紧密连接保证了TNF-α在免疫调节基因产物的联合反应和调控中发挥重要作用[6]。在机体内,TNF-α是一种发挥多重生物学功能的炎症细胞因子,在心血管疾病的发生发展中发挥了重要作用,被证实在参与调控急性心肌梗死、动脉粥样硬化、病毒性心肌炎及器官移植排斥反应的病理进程。本研究中,我们发现TNF-α以剂量和时间依赖形式促进心肌细胞损伤。之前研究已表明,TNF-α在心血管疾病中主要通过招募巨噬细胞等免疫细胞诱导血管内皮细胞和心肌细胞损伤,降低正常细胞增殖活性和诱导心肌细胞凋亡[7,8]。
microRNA是一类在真核细胞中发现的、由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,通过其对靶基因转录的调控参与到真核细胞的分化、增殖、生长和凋亡的调解。在心血管疾病的中,miRNA不仅通过其对靶基因的调控而在心肌肥大、心肌坏死和凋亡中发挥着举足轻重的作用,并且参与到急性心肌梗死发病的每个过程[9-11]。同时,由于miRNA在血液中异常的稳定,且对各种病理生理条件下表达差异明显,是一种理想的疾病血液检测生物标志物。Liu等[12]研究指出,血浆miR-1,miR-208和miR-499是汉人群急性心肌梗死的潜在预测生物标志物。本次研究发现,TNF-α不仅以剂量和时间依赖性诱导心肌细胞损伤,且还以剂量和时间依赖性促进心肌细胞中miR-9表达。
为研究miR-9在TNF-α诱导的心肌细胞损伤中发挥的作用,向心肌细胞中转入miR-9-Inhibitor以敲低心肌细胞中miR-9的表达。结果发现:敲低miR-9可显著降低TNF-α诱导的心肌细胞损伤。MiR-9作为一种microRNA并不编码蛋白而发挥生物学功能,而只能通过对其靶基因的调控而间接参与细胞生物学功能的调控。为了进一步研究miR-9对TNF-α诱导的心肌细胞损伤的调控作用,通过生物学信息手段查询到SIRT1是miR-9的靶基因,且本文通过双荧光素酶报告基因系统验证发现,miR-9靶向抑制心肌细胞的SIRT1的表达。SIRT1是sirtuin蛋白家族的成员之一,是一种烟酰胺腺嘌呤二核苷酸依赖性组蛋白去乙酰化酶,不仅可通过去乙酰化组蛋白而维持染色质和基因组的稳定,还可通过其去乙酰化非组蛋白的功能而参与细胞生物学功能的调控[13]。之前研究指出,上调SIRT1的表达不仅降低脓毒血症小鼠体内的炎症性损伤[14],通过其去乙酰化功能而抑制p65蛋白进入细胞核,抑制NF-κB信号通路的激活,减轻炎症[15]。本研究发现,敲低miR-9不仅显著增加心肌细胞中SIRT1蛋白的表达,且显著降低p65蛋白的磷酸化,提示miR-9可能通过靶向抑制SIRT1蛋白表达而促进NF-κB信号通路的激活,降低细胞活性。
综上所述,miR-9可能通过靶向抑制SIRT1蛋白表达、促进NF-κB信号通路的激活从而在TNF-α诱导的心肌细胞损伤过程中发挥促进炎症损伤的作用。而敲低miR-9可减轻TNF-α诱导的心肌细胞损伤,提高心肌细胞活性。

